修回日期: 2009-03-24
接受日期: 2009-03-30
在线出版日期: 2009-04-28
目的: 观察胃泌素对人结肠癌细胞株HT-29水通道蛋白4表达的影响, 探讨胃泌素促进结肠癌侵润转移的另一可能机制.
方法: 体外培养结肠癌细胞株, 采用不同浓度的胃泌素(10-6、10-7、10-8 mol/L)干预HT-29细胞12 h, 同时用10 mmol/L的胃泌素受体拮抗剂丙谷胺处理细胞1 h, 再给予10-7 mol/L的胃泌素干预相同时间. 采用免疫细胞化学和流式细胞技术的方法检测水通道蛋白4表达的变化.
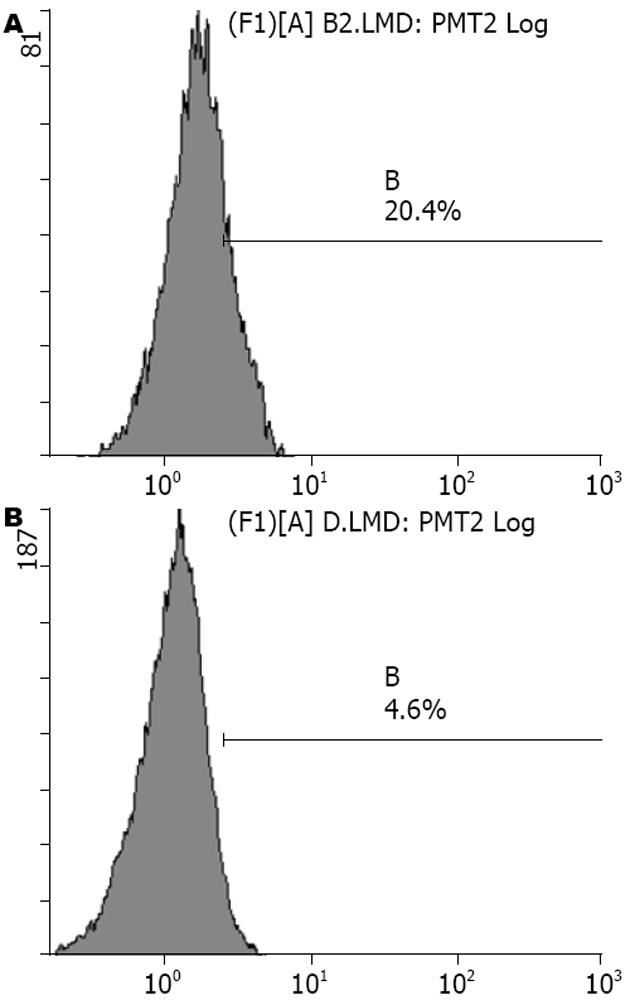
结果: 各浓度胃泌素干预后, 细胞水通道蛋白4的表达与空白组和丙谷胺处理组相比均明显增加(16.08%±1.93%, 17.00%±2.72%, 16.48%±2.22% vs 9.28%±2.74%, 8.52%±2.72%, 均P<0.01); 丙谷胺处理组的表达与空白组无差别, 胃泌素各浓度组间亦无差别.
结论: 胃泌素能够增加结肠癌细胞水通道蛋白4的表达, 丙谷胺能够阻断胃泌素的作用.
引文著录: 张玉, 罗和生. 胃泌素对结肠癌细胞株HT-29水通道蛋白4表达的影响. 世界华人消化杂志 2009; 17(12): 1234-1237
Revised: March 24, 2009
Accepted: March 30, 2009
Published online: April 28, 2009
AIM: To observe the effect of gastrin on aquaporin 4 expression in human colon cancer HT-29 cell line, and to explore possible mechanism for gastrin promoting the invasion and metastasis in colon cancer.
METHODS: The human colon cancer HT-29 cells were cultivated in vitro and treated with gastrin in different concentrations (10-6 mol/L, 10-7 mol/L, 10-8 mol/L) for 12 h. Simultaneously proglumide was used to block the gastrin receptors for 1 h and then treated with gastrin (10-7 mol/L) again for 12 h. The expression level of aquaporin 4 was detected by immunocytochemistry and flow cytometry.
RESULTS: The aquaporin 4 expression levels were significantly higher in the gastrin treated group compared with the normal group and the proglumide group (16.08% ± 1.93%, 17.00% ± 2.72%, 16.48% ± 2.22% vs 9.28% ± 2.74%, 8.52% ± 2.72%, all P < 0.01). The levels between the proglumide group and the normal group had no difference. The expression levels among the three gastric treatment groups also had no difference.
CONCLUSION: Gastrin could elevate the aquaporin 4 expression level in colon cancer cells. This effect could be blocked by proglumide.
- Citation: Zhang Y, Luo HS. Effect of gastrin on aquaporin 4 expression in human colon cancer HT-29 cell line. Shijie Huaren Xiaohua Zazhi 2009; 17(12): 1234-1237
- URL: https://www.wjgnet.com/1009-3079/full/v17/i12/1234.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i12.1234
水通道蛋白(aquaporin, AQP)是一类相对分子质量为30×103左右的膜蛋白, 现已从哺乳动物体内发现了13种AQP(AQP0-AQP12), 他主要介导水的跨膜转运. 目前对AQP在疾病发生发展中所起到的作用已经做了很多的研究[1], 特别是AQP与细胞迁移的关系的研究[2-3]. 已有研究证实一些肿瘤细胞的迁移活动与细胞膜上的AQP具有密切的关系[4]. 胃泌素作为胃肠道的一种营养因子的同时, 也能影响胃肠道肿瘤的迁移和侵袭能力[5]. 对于结肠癌细胞, 胃泌素能够通过增加基质蛋白酶的表达增强结肠癌细胞株的侵袭能力[6], 还能够减少细胞间的黏附复合物的形成[5]. 本实验主要研究胃泌素对结肠癌细胞株HT-29AQP4表达的影响, 来阐明胃泌素促进结肠癌侵润转移在分子水平又一可能途径, 为结肠癌的研究提供新的方向.
HT-29细胞(人结肠癌细胞株)购于中国科学院上海生命科学研究院细胞库; RPMI 1640培养基(Gibco)、四季青胎牛血清; 人胃泌素购于北京博奥森生物技术有限公司; 丙谷胺原料药购于杭州良金生物科技有限公司; 兔抗人AQP4抗体及SABC试剂盒购于武汉博士德生物工程有限公司; FITC标记的抗人AQP4 mAb来源于Santa Cruz公司.
1.2.1 细胞培养: 人结肠癌细胞株HT-29, 培养基为RPMI 1640, 添加100 mL/L的胎牛血清, 在37℃含50 mL/L CO2的温箱中培养.
1.2.2 分组: 胃泌素刺激组: 含胃泌素浓度分别为10-6、10-7和10-8 mol/L, 分别记为a、b、c组; 丙谷胺阻滞组: 含10 mmol/L的丙谷胺及10-7 mol/L的胃泌素, 记为d组; 空白对照组: 仅给予培养液, 记为e组.
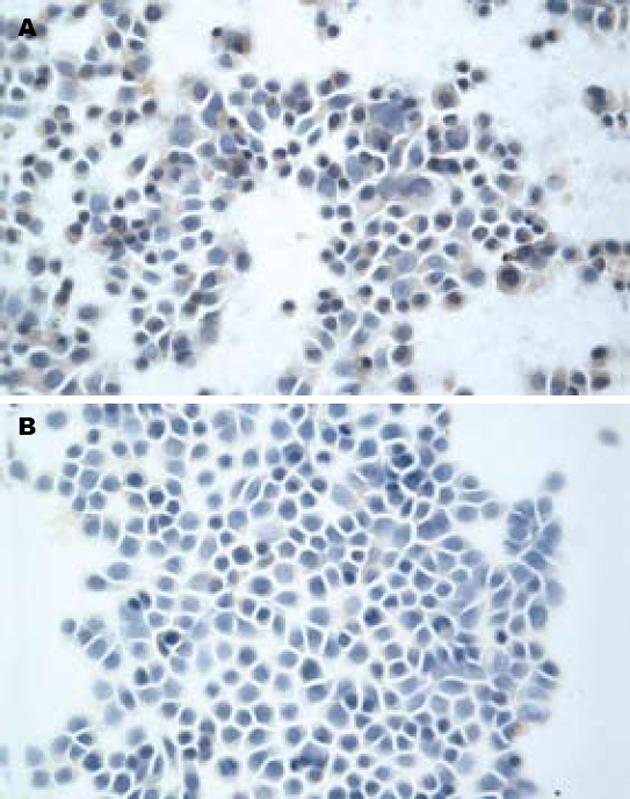
1.2.3 免疫细胞化学检测: 处理好的盖玻片置于12孔板中, 将生长至80%融合的细胞消化接种于板中, 24 h后换无血清培养基培养, 12 h后换液并给予相应处理, 胃泌素组加入终浓度分别为10-6、10-7和10-8 mol/L的胃泌素, 丙谷胺组换用培养液溶解的终浓度为10 mmol/L的丙谷胺溶液, 之后加入终浓度为10-7 mol/L的胃泌素, 培养12 h后, PBS洗3次, 40 g/L的多聚甲醛固定10-15 min, PBS洗3次. 风干后将细胞面朝上贴于载玻片上染色观察. 采用SABC法检测AQP4的表达, 具体步骤参照SABC试剂盒说明书. DAB显色, 苏木素复染, 中性树胶封片后进行图像采集, 采用Image-Pro Plus 6.0图像分析系统进行IA(累计吸光度)半定量分析.
1.2.4 流式细胞仪检测: 在12孔板中接种细胞, 处理过程如上. 终止时将各组细胞消化后细胞计数, 取约105-106个细胞离心, 弃上清, 1 mL PBS重悬后离心, 弃上清后取100 μL PBS液再次重悬, 加入20 μL FITC标记的AQP4抗体混匀, 室温孵育30 min, 1 mL PBS重悬, 流式细胞仪检测.
统计学处理 用SPSS15.0统计软件分析上述结果, 数据mean±SD表示, 采用单因素方差分析, 组间比较采用LSD检验, P<0.05表示差异具有显著性.
胃泌素刺激组各组间差异无显著性, 丙谷胺组与空白组表达量差异也无统计学意义, 而胃泌素刺激组与空白组及丙谷胺组间的表达量具有明显差异(P<0.01, 图1, 表1).
胃泌素也称促胃液素(gastrin)是由胃和上段小肠黏膜中的G细胞分泌的一种多肽类激素, 他的主要生物学作用是刺激壁细胞分泌胃酸. 此外胃泌素还具有促进肠黏膜的生长和修复以及促进胃肠蠕动的功能. 他的生物学效应是通过膜受体-胆囊收缩素-2(CCK-2)/促胃液素受体介导的[7]. 近年来胃泌素对胃肠道肿瘤的生长促进作用受到很大的关注, 很多研究表明血清胃泌素水平与结肠癌的侵润转移相关, 胃泌素能够使细胞间的黏附复合物减少[5], 胃泌素刺激能够通过增加基质金属蛋白酶的表达增强结肠癌细胞的侵袭能力[6].
AQP4在消化系统中主要表达于正常胃黏膜壁细胞和主细胞, 目前有研究表明AQP4在结肠癌组织中也呈现高表达, 并且与结肠癌的分期和转移密切相关[8]. 这说明AQP在结肠癌发生发展过程中具有重要作用. 在对其他类型AQP的表达与细胞迁移的关系上, 研究显示很多类型的AQP表达增加会增强细胞的迁移能力[2], 例如AQP4的表达与脑星型胶质细胞的迁移和穿刺后伤口的修复有关[9]; 高表达AQP1的肝癌细胞迁移能力明显高于底表达细胞[10], 故有推测称AQP介导的细胞膜高水通透性能够通过增强细胞的变形能力以及影响一系列电生理活动来促进细胞的迁移. AQP在迁移中的细胞上往往呈现极性分布并且与细胞迁移相关的一些离子转运体也呈相应的极性分布.
本实验检测胃泌素处理过的结肠癌细胞AQP4表达的变化, 结果显示三个浓度的胃泌素都能够使结肠癌细胞AQP4的表达显著增加(P<0.01). 10 mmol/L的丙谷胺能够完全阻断胃泌素的作用. 丙谷胺是胃泌素受体的阻滞剂, 胃泌素受体包括CCKA、CCKB(即CCK-2)、CCKC受体, 胃泌素对CCK-2受体的亲和力最强, 丙谷胺不是特异性的CCK-2受体阻断剂[11], 故阻滞效应不强, 需要较大剂量才能完全阻断胃泌素的作用.
综合各方面研究显示胃泌素能够上调结肠癌细胞AQP4的表达, 推测这可能与结肠癌细胞的迁移能力变化有一定的关系, 有待更进一步的实验研究证实, 其中具体的过程及机制还有待深入研究. AQP4在消化系统中表达的调节机制目前研究的不是很多, 主要有磷酸化调节, pH值调节, 结构调节等. 磷酸化调节主要介导AQP胞内胞膜循环[12]. 激素的调节在其他AQP中已有研究, 包括胰高血糖素对大鼠肝细胞AQP8分布的调节[13], 促胰液素对胆管细胞AQP1胞内胞膜循环的影响等[14]. 研究胃泌素作为一种调节因子对AQP4的影响有助于对结肠癌侵袭转移相关因素展开更深入研究, 为结肠癌的早期治疗提供新的方向.
胃泌素也称促胃液素(gastrin)是由胃和上段小肠黏膜中的G细胞分泌的一种多肽类激素, 他的主要生物学作用是刺激壁细胞分泌胃酸. 到目前为止, 很多研究证明胃泌素对消化系肿瘤的生长有促进作用. 有研究表明某些结肠癌细胞株自身能够产生胃泌素并且表达胃泌素受体, 通过自分泌、旁分泌和内分泌的方式促进自身的增殖侵润和转移.
任建林, 教授, 厦门大学附属中山医院消化内科
AQP与细胞迁移的关系研究也是水通道研究的热点问题, 如国内关于AQP1的表达与肝癌细胞迁移能力关系的研究. 国外对AQP4的表达与脑星型胶质细胞的迁移的关系研究; AQP3在皮肤角质形成细胞表达缺失会引起伤口愈合不良等等. 另外, AQP表达的调节因素和机制也是现在研究的一个热点.
本文主要研究胃泌素对结肠癌细胞株HT-29 AQP4表达的影响, 来阐明胃泌素作为一种影响因素对AQP4表达的影响, 另外探索胃泌素在促进结肠癌侵润转移方面的又一可能途径, 为结肠癌的研究提供新的方向.
本研究先进性、科学性均较好, 设计合理, 结果可靠, 学术价值较好.
编辑: 李军亮 电编:何基才
| 2. | Papadopoulos MC, Saadoun S, Verkman AS. Aquaporins and cell migration. Pflugers Arch. 2008;456:693-700. [PubMed] [DOI] |
| 3. | 刘 军, 石 琳琳, 杨 红, 麻 彤辉. 细胞运动中的水通道蛋白-细胞迁移及相关生理和病理机制的新视点. 生物化学与生物物理进展. 2005;32:583-586. |
| 4. | Warth A, Mittelbronn M, Wolburg H. Redistribution of the water channel protein aquaporin-4 and the K+ channel protein Kir4.1 differs in low- and high-grade human brain tumors. Acta Neuropathol. 2005;109:418-426. [PubMed] [DOI] |
| 5. | Grabowska AM, Watson SA. Role of gastrin peptides in carcinogenesis. Cancer Lett. 2007;257:1-15. [PubMed] [DOI] |
| 6. | Kermorgant S, Lehy T. Glycine-extended gastrin promotes the invasiveness of human colon cancer cells. Biochem Biophys Res Commun. 2001;285:136-141. [PubMed] [DOI] |
| 7. | Colucci R, Blandizzi C, Tanini M, Vassalle C, Breschi MC, Del Tacca M. Gastrin promotes human colon cancer cell growth via CCK-2 receptor-mediated cyclooxygenase-2 induction and prostaglandin E2 production. Br J Pharmacol. 2005;144:338-348. [PubMed] [DOI] |
| 8. | 唐 会峰, 张 玉华, 徐 皓, 魏 尉, 肇 毅, 吴 文溪. 水通道蛋白4在大肠癌组织中的表达. 南京医科大学学报(自然科学版). 2007;27:1236-1239. |
| 9. | Saadoun S, Papadopoulos MC, Watanabe H, Yan D, Manley GT, Verkman AS. Involvement of aquaporin-4 in astroglial cell migration and glial scar formation. J Cell Sci. 2005;118:5691-5698. [PubMed] [DOI] |
| 11. | Smith AM, Watson SA. Review article: gastrin and colorectal cancer. Aliment Pharmacol Ther. 2000;14:1231-1247. [PubMed] [DOI] |
| 12. | 王 晓玲, 王 俊平. 水通道蛋白4在消化系统表达及调节的研究进展. 胃肠病学和肝病学杂志. 2007;16:290-293. |
| 13. | Gradilone SA, García F, Huebert RC, Tietz PS, Larocca MC, Kierbel A, Carreras FI, Larusso NF, Marinelli RA. Glucagon induces the plasma membrane insertion of functional aquaporin-8 water channels in isolated rat hepatocytes. Hepatology. 2003;37:1435-1441. [PubMed] [DOI] |
| 14. | Marinelli RA, Tietz PS, Pham LD, Rueckert L, Agre P, LaRusso NF. Secretin induces the apical insertion of aquaporin-1 water channels in rat cholangiocytes. Am J Physiol. 1999;276:G280-G286. [PubMed] |