修回日期: 2009-04-01
接受日期: 2009-04-08
在线出版日期: 2009-04-28
目的: 观察植物乳杆菌(Lactobacillus plantarum, LP)灌胃对IL-10基因敲除小鼠肠道炎症和淋巴细胞归巢的影响.
方法: 取IL-10基因敲除(knockout, KO)小鼠和未作基因敲除的背景鼠分为4组: 对照组(野生组WT)、加植物乳杆菌组(WT+LP)、IL-10基因敲除模型组(KO)、模型加植物乳杆菌组(KO+LP). 4 wk开始对照组和KO组每日予PBS灌胃, WT+LP和KO+LP组予溶于PBS的LP灌胃, 持续4-8 wk结束. 实验结束后取各组小鼠结肠行炎症评分和电镜亚显微结构观察, 并用RT-PCR和Western blot检测归巢相关分子MAdCAM-1、ICAM-1、α4β7及CD3的表达.
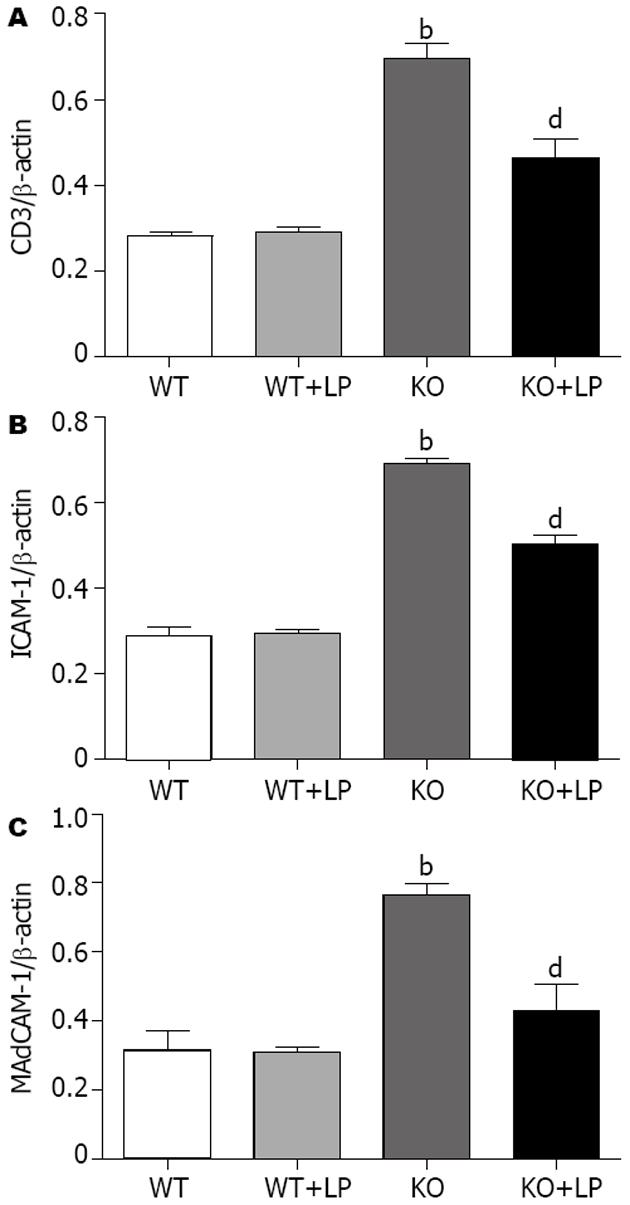
结果: 8 wk后KO小鼠100%发生肠道炎症, 且其CD3及黏附分子α4β7、ICAM-1和MAdCAM-1的mRNA和蛋白表达水平较WT组均明显增高(mRNA: t = 39.42, 8.83, 25.53, 45.78, 均P<0.01; CD3、ICAM-1、MAdCAM-1蛋白: t = 19.04, 29.57, 12.29, 均P<0.01). 予以益生菌LP灌胃后, KO+LP组小鼠CD3及黏附分子α4β7、ICAM-1和MAdCAM-1的mRNA和蛋白表达水平较KO组均明显降低(mRNA: t = 20.34; 4.95; 14.21; 22.31, 均P<0.01; CD3、ICAM-1、MAdCAM-1蛋白: t = 6.82, 14.10, 7.03, 均P<0.01); WT+LP组小鼠CD3及黏附分子α4β7、ICAM-1和MAdCAM-1的mRNA较WT组均明显降低(t = 9.33, 10.55, 7.75, 6.69, 均P<0.01), 而WT+LP组小鼠CD3及黏附分子ICAM-1和MAdCAM-1的蛋白表达水平无明显降低.
结论: 植物乳杆菌能下调黏附分子在IL-10基因敲除结肠炎小鼠中的高表达, 这可能是其减轻炎症状态, 缓解炎症性肠病的重要机制之一.
引文著录: 储昭新, 陈红旗, 张明, 秦环龙. 植物乳杆菌对IL-10基因敲除结肠炎小鼠黏附分子的影响. 世界华人消化杂志 2009; 17(12): 1190-1196
Revised: April 1, 2009
Accepted: April 8, 2009
Published online: April 28, 2009
AIM: To investigate the effect of lactobacillus plantarum (LP) daily intragastric administration on lymphocyte homing and intestinal inflammation in IL-10 gene knockout mice colitis.
METHODS: Both two groups of 10 IL-10 KO mice and two groups of normal background controls were consecutively fed on phosphate buffered saline containing LP 1258 at 1012 CFU/L, and unmodified phosphate buffered saline, respectively, from 4 to 8 wk. At sacrifice, the bowels were histologically scored under light microscope and observed under transmission electron microscope. Expression of CD3 and intestinal homing-related molecules MAdCAM-1, ICAM-1, α4β7 were detected by reverse-transcription polymerase chain reaction and Western blot.
RESULTS: At 8 wk, 100% of the IL-10 gene-deficient mice showed histological inflammation. CD3, adhesion molecules α4β7, ICAM-1 and MAdCAM-1 had a significantly higher expression of both mRNA and protein levels in KO than WT group (mRNA: t = 39.42, 8.83, 25.53, 45.78, all P < 0.01; CD3, ICAM-1, MAdCAM-1 protein: t = 19.04, 29.57, 12.29, all P < 0.01). After LP treatment, the expression of both mRNA and protein was significantly reduced in KO+LP, compared with KO mice (mRNA: t = 20.34, 4.95, 14.21, 22.31, all P < 0.01; CD3, ICAM-1, MAdCAM-1 protein: t = 6.82, 14.10, 7.03, all P < 0.01). The expression of mRNA was significantly reduced in WT+LP, compared with WT mice (t = 9.33, 10.55, 7.75, 6.69, all P < 0.01), however, protein expression was not significantly reduced.
CONCLUSION: LP can interfere with upregulation of adhesion molecules, attenuating colitis of IL-10 gene knockout mice.
- Citation: Chu ZX, Chen HQ, Zhang M, Qin HL. Lactobacillus plantarum attenuates up-regulation of adhesion molecules expression in IL-10 gene knockout mice with colitis. Shijie Huaren Xiaohua Zazhi 2009; 17(12): 1190-1196
- URL: https://www.wjgnet.com/1009-3079/full/v17/i12/1190.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i12.1190
诸多研究表明炎症性肠病(inflammatory bowel disease, IBD)肠道炎症浸润部位T、B细胞数量增加[1-2], 而且黏附分子的表达也明显增加, 并认为IBD的发生发展与淋巴细胞归巢(lymphocyte homing, LH)密切相关. 近来, 一些学者开始探索如何通过抑制肠道LH, 来辅助治疗IBD, 开发了一些新的药物, 如英夫利昔(infliximab, TNFα单抗)[3-8]、α4β7的抑制物(MLN02)和CCR9的抑制物(Traficet-EN, Chemocentryx)[9-13].
除药物外, 近几年来微生态制剂在临床中的应用日益引起胃肠病学家的关注[14-18], 并发现了其有效性和安全性. Schultz et al[19]采用4种不同的实验方案, 在不同的时间点通过饮水使IL-10基因敲除(knockout, KO)小鼠摄入植物乳杆菌(Lp299v), 发现: 饲养于SPF条件下已发生结肠炎症的IL-10 KO小鼠, 在给予Lp299v后, 炎症显著缓解, 黏膜炎症因子如IFN-γ、IL-12等降低; 在GF动物体内, 同时定植Lp299v和无特殊病原微生物(specific-pathogen free, SPF)菌, 对结肠炎的发生没有任何预防作用; 在IL-10-/-无菌小鼠中定植入Lp299v, 可出现轻度的免疫系统激活, 但不发生结肠炎; 先让GF小鼠服用Lp299v, 然后把小鼠肠道暴露于SPF菌中, 再继续以Lp299v治疗, 也可使炎症显著缓解, 炎症评分降低. 但益生菌对IBD的肠道LH的影响机制尚不明确.
本实验选择病变以盲肠和结肠为主, 病理学特征与人类克罗恩病(Crohn's disease, CD)十分相似的IL-10 KO小鼠作为IBD模型, 给予植物乳杆菌(Lactobacillus plantarum, LP)在早期(4-8 wk)灌胃, 观察小鼠肠道黏附分子α4β7、ICAM-1和MAdCAM-1 mRNA和蛋白表达水平的变化, 从而探讨益生菌对LH和IBD的作用.
纯合型IL-10 KO小鼠(129-Il10tm1Cgn/J)及对照组(wild type, WT)小鼠(129S1/SvImJ)均购自美国Jackson Laboratories公司. 实验小鼠饲养于SPF条件下, 给予灭菌的标准饮食, 小鼠随意饮食. 益生菌为单一的LP, 由上海交大昂立医药研究院提供, 菌株号为CGMCC No.1258. LP以低压冻干菌粉的形式在-20℃下保存, 实验用LP批号为2007070526, 用PBS稀释后2 h内经改良MC培养基(Oxoid, UK)37℃厌氧培养48 h表明, 其活菌数达5×1010 CFU/g.
1.2.1 实验干预: 4 wk龄♂IL-10 KO小鼠和对照组小鼠各20只, 各自随机分成2组, 共4组: 对照组(野生组WT)、加植物乳杆菌组(WT+LP)、IL-10基因敲除模型组(KO)、模型加LP组(KO+LP), 每组10只小鼠. WT和KO组用PBS灌胃(每只0.5 mL/d), WT+LP和KO+LP组灌胃用LP(每只每天0.02 g/0.5 mL), 每天摄入LP 1×1012 CFU/L. 每天上午9:00左右灌胃, 灌胃期间小鼠随意饮食, 持续灌胃4 wk后实验结束.
1.2.2 病理及电镜检查: 实验结束后, 处死小鼠, 快速取少量结肠组织(每组取3只小鼠), 清洗后切成小块(1 mm×1 mm)置100 g/L甲醛中固定, 脱水、浸透、包埋聚合、切片及染色后透射电镜下观察结肠亚显微结构(上皮细胞紧密连接、微绒毛及细胞器的变化). 同时切取小鼠小肠、盲肠和结肠组织, 100 g/L甲醛固定24 h, 石蜡包埋, 4 μm切片, 苏木素-伊红(HE)染色后由两位观察者按照盲作法组织学评分, 评分标准按Saverymuttu et al[20]采用的评分方法(表1), 即总的评分(0-10分)由四部分组成: 黏膜溃疡(0-3分)、上皮增生(0-3分)、黏膜固有层单核细胞浸润(0-2分)和中性粒细胞浸润(0-2分).
| 组织损伤评分系统 | 分值 |
| 黏膜溃疡形成 | |
| 正常 | |
| 上皮表面炎症 | 1 |
| 糜烂 | 2 |
| 溃疡形成 | 3 |
| 上皮细胞增生 | |
| 正常 | 0 |
| 轻度增生 | 1 |
| 中度增生 | 2 |
| 假息肉 | 3 |
| 黏膜固有层单核细胞浸润 | |
| 正常 | 0 |
| 轻微增加 | 1 |
| 显著增加 | 2 |
| 黏膜固有层中性白细胞浸润 | |
| 正常 | 0 |
| 轻微增加 | 1 |
| 显著增加 | 2 |
1.2.3 RT-PCR检测结肠CD3、α4β7、ICAM-1和MAdCAM-1 mRNA表达: 采用鼠GAPDH作为内参, GAPDH、MAdCAM-1、ICAM-1、α4β7及CD3引物设计参照文献和GenBank, 确定的序列交上海生工公司合成(表2). TRIzol(Invitrogen公司)抽提总RNA后去除基因组DNA, 用紫外分光光度法测定总RNA纯度和浓度, A260/A280为1.8-2.0. 采用美国Bio-Rad Laboratories公司一步法RT-PCR系统做反转录聚合酶链反应. RT-PCR扩增反应体系组成如下: 2×PCR缓冲液25 μL、PCR Mix 2 μL、引物各1 μL、cDNA第一链反应液5 μL, 其余由16 μL灭菌双蒸水补足50 μL. 反应条件: 50℃×30 min, 94℃×4 min, 1个循环; 94℃×45 s, 56℃×45 s, 72℃×1 min, 26个循环; 72℃延伸10 min. 扩增产物进行20 g/L琼脂糖凝胶(含EB)电泳, 溴化乙淀染色, 用图像分析仪进行分析.
| 引物 | 序列 | 扩增片段 (bp) |
| GAPDH | S CAAGAAGGTGGTGAAGCAGG | 320 |
| A AGGGAGATGCTCAGTGTTGG | ||
| ICAM-1 | S CTTTCGGAGCTGAAGGTCAG | 450 |
| A GGCCATGGAGTCACCGATTT | ||
| α4β7 | S CTGAAGCATCCCTGGCCACT | 280 |
| A AACAGCATCACCGCTTCCCG | ||
| CD3 | S TAGGGACTCTCAATACTTCTA | 210 |
| A AGCCACTTGATAGTCTTGTC | ||
| MAdCAM-1 | S ATGGATTTCGGACTGGCC | 170 |
| A ATCACTTCTCCCTGCGTGG |
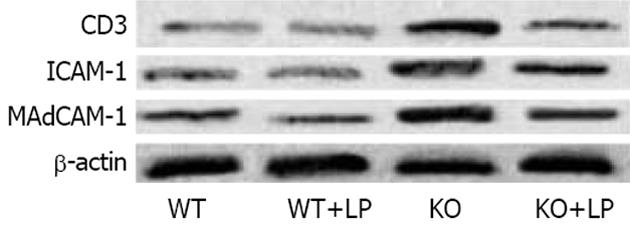
1.2.4 Western blot检测结肠CD3、ICAM-1和MAdCAM-1蛋白表达: 将结肠组织置于研钵中, 使用研钵在液氮中研磨成粉末状, 加入蛋白质裂解缓冲液及蛋白酶抑制剂(30 mmol/L Tris, pH7.5, 150 mmol/L NaCl, 1 mmol/L PMSF, 1 mmol/L Na3VO4, 1% Nonidet P-40, and 10% glycerol). 离心取上清液, BCA法(BCA试剂盒购自碧云天公司)测定蛋白质含量. SDS-PAGE电泳后行Western blot. 一抗为1∶1500稀释的兔抗小鼠CD3多抗、大鼠抗小鼠MAdCAM-1、ICAM-1 mAb(均购自英国Abcam公司, 用TBST稀释), 二抗为羊抗兔IgG-HRP或兔抗大鼠IgG-HRP(TBST稀释1∶5000 Santa Cruz公司), 加入ECL显色液(美国GE公司), 置于柯达活体成像仪(美国Kodak公司)中观察结果, 条件设置为曝光5 min, CCD自动获取图片结果. 相应蛋白表达值为条带的灰度值除以β-actin(1∶1000 Santa公司 43 kDa)内参照校正.
统计学处理 数据以mean±SD表示. 采用SPSS13.0软件对数据进行统计学分析, 两组间比较采用t检验, 以P<0.05为有统计学意义, P<0.01有显著统计学意义.
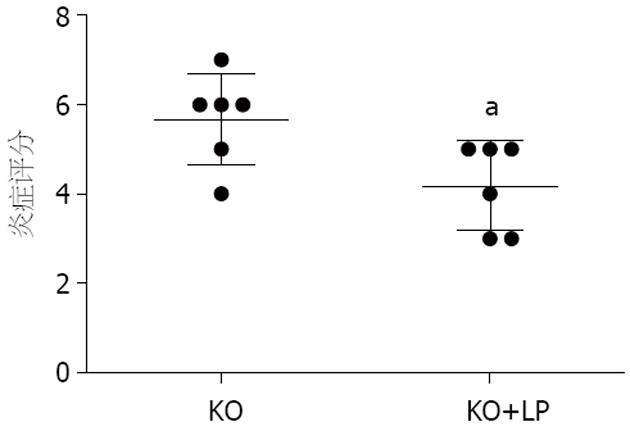
KO组小鼠出现不同程度的腹泻、体质量下降. 病理切片镜检发现, 8 wk龄IL-10 KO小鼠均发生肠道炎症, 其中结肠较明显, 盲肠最为严重, 而小肠中只有末端回肠有轻度的炎症. 局灶性的组织坏死和表浅糜烂以及浸润达黏膜肌层以下的溃疡可将8 wk龄IL-10 KO小鼠的结肠上皮断裂为斑片状, 可见中性粒细胞和淋巴细胞聚集, 而肠上皮细胞出现不同程度的增生. 此外, 在糜烂和溃疡区域以外的黏膜固有层和黏膜肌层内也有中性和淋巴细胞浸润. 给予LP灌胃后, 炎症细胞减少, 组织损伤和增生有所缓解, 与KO组比较, 炎症评分好转(t = 2.58, P<0.05, 图1).
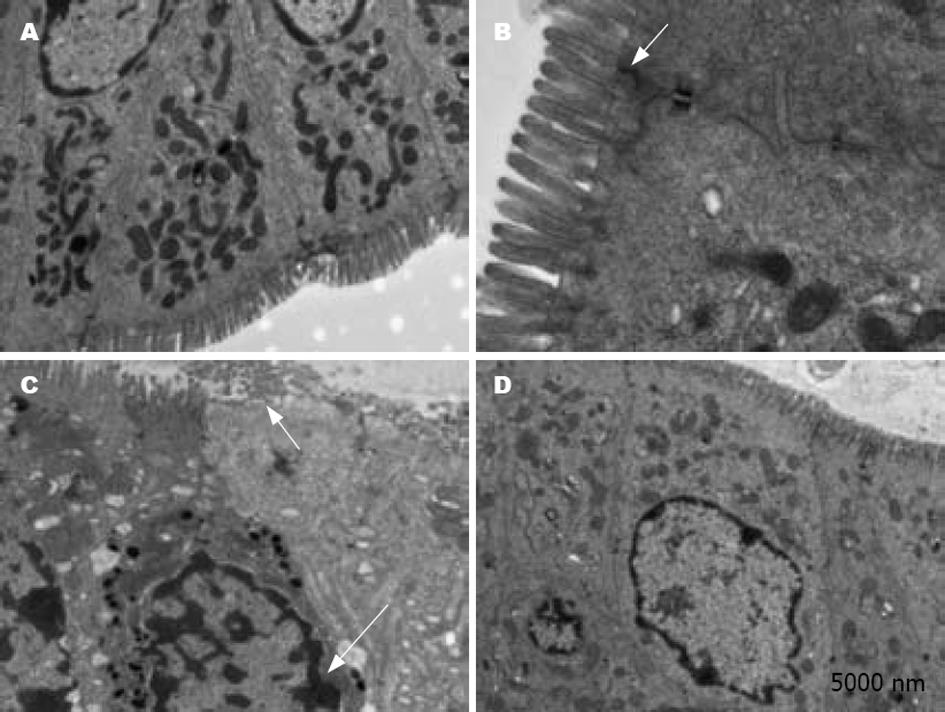
电镜检查发现, WT和WT+LP组小鼠结肠均显示正常的亚显微结构: 上皮细胞核形态, 微绒毛及上皮细胞间连接正常(图2A-B). KO小鼠可见肠微绒毛缺失, 并可观察到上皮细胞核固缩, 碎裂(图2C), 予LP灌胃后, KO+LP组小鼠肠绒毛大部分恢复完整, 染色质凝聚现象减少(图2D).
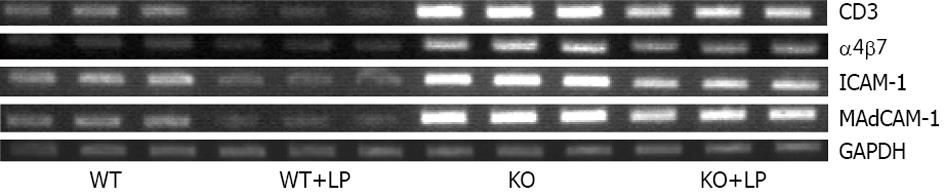
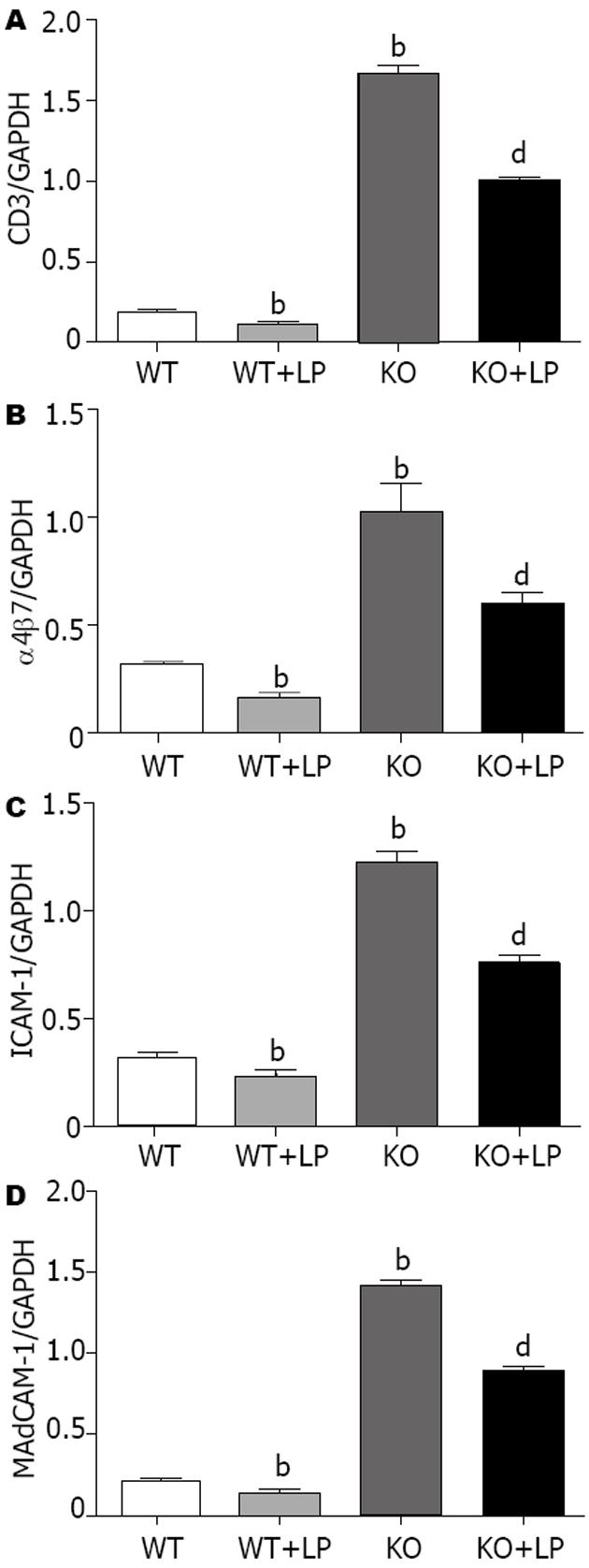
与WT组比较, KO组CD3及黏附分子α4β7、ICAM-1、MAdCAM-1的mRNA转录水平显著增加(t = 39.42, 8.83, 25.53, 45.78, 均P<0.01). KO+LP组干预后CD3及黏附分子α4β7、ICAM-1、MAdCAM-1的mRNA转录水平较KO组均显著减少(t = 20.34, 4.95, 14.21, 22.31, 均P<0.01); WT+LP组干预后mRNA转录水平较WT组也显著减少(t = 9.33, 10.55, 7.75, 6.69, 均P<0.01, 图3-4).
KO组结肠CD3及黏附分子MAdCAM-1和ICAM-1的蛋白表达量较WT组明显增高(t = 19.04, 12.29, 29.57, 均P<0.01), 予以LP灌胃后, 其蛋白表达量又明显降低(t = 6.82, 7.03, 14.10, 均P<0.01, 图5-6). WT+LP组蛋白表达水平与WT组比较无统计学意义.
肠道微生态学家对肠道细菌的研究集中于几种优势细菌, 健康成人粪便中大约80%的细菌由6种优势菌构成, 分别是双歧杆菌属、乳酸杆菌属、类杆菌属、Cleptum菌属、Ccoccoides菌属和肠杆菌属[21]. 肠道细菌主要由粪便细菌与肠道黏膜细菌构成.近来研究提示IBD患者存在肠道菌群失调[22], 乳酸杆菌和双歧杆菌等细菌数量明显减少, 致病菌、条件致病菌的数量剧增[23-26]. Madsen et al[27]发现IL-10 KO小鼠在2 wk尚未发生结肠损伤, 肠道黏膜黏附和肠道总乳酸杆菌数量较对照组有所减少; 2-8 wk是肠道炎症形成期, 肠道总乳酸杆菌数量明显减少. Ott et al[28]利用单链构象多态性分析(single strand conformation polymorphism, SSCP)和RT-PCR技术发现活动期的IBD患者肠道某些正常黏膜厌氧菌如乳酸杆菌、拟杆菌和真杆菌缺失.
有研究表明乳酸杆菌能对其他细菌施加拮抗作用, 限制肠道菌群, 从而在抑制肠道病原细菌的生长和黏附方面发挥重要作用. 本实验中使用的益生菌为单一的LP, 该菌最初从婴儿粪便中分离纯化而来, 具有良好的益生菌特性: 是人类来源的, 具有非致病性和耐酸、耐胆汁性, 能黏附肠上皮细胞, 并能定植于胃肠道内发挥其代谢活性.
本实验以病理学特征与人类CD十分相似的IL-10 KO小鼠作为结肠炎模型(损伤以结肠为主, 较少累及回肠). IL-10 KO小鼠在第2周时结肠的组织表型仍是正常的, 从第4周开始表现为中度的结肠炎并逐渐加重至第8周炎症达高峰[27]. 本实验中, 可观察到8 wk龄IL-10 KO小鼠发生肠道炎症, 局灶性的组织坏死和表浅糜烂以及浸润达黏膜肌层以下的溃疡可将结肠上皮断裂为斑片状, 饲养于同等条件下的对照组小鼠无组织损伤. 加植物乳杆菌干预后, 在光镜和电镜下观察, KO小鼠肠道炎症均缓解.
Angulo et al[29]通过手术在大鼠结肠中创造一段无粪流的肠段, 用抗生素除去该肠段原有菌群后, 植入来自炎症大鼠结肠的正常菌群, 其是否含干酪乳杆菌(Lactobacillus casei, L. casei)作对照研究, 三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)诱导结肠炎, 发现L. casei干预能显著降低结肠LH, 同时伴有ICAM-1表达明显降低. Okada et al[30]报道给予DSS干预之前或之后, 在饮水中添加费氏丙酸杆菌的提取物1, 4-二羟基-2-萘甲酸(1, 4-Dihydroxy-2-naphthoic acid, DHNA), 均能提高DSS诱导IBD小鼠的存活率, 改善炎症评分, 并能显著缓解结肠部位增高的MAdCAM-1和β7-整合素阳性细胞数量. 本实验中我们观察到给予LP干预后, LH相关分子的mRNA和蛋白表达水平均显著降低, 提示通过LH相关分子影响LH, 从而减轻IBD的炎症状态, 可能是益生菌缓解IBD的重要机制之一.
总之, LP能干扰黏附分子在炎症中的上调, 缓解IL-10 KO小鼠结肠炎. 其他一种益生菌或几种复合益生菌是否能影响肠道黏附分子及LH, 效果如何, 是否有协同或拮抗作用等问题需进一步研究.
诸多研究表明炎症性肠病(IBD)肠道炎症浸润部位T、B淋巴细胞浸润增加, 而且黏附分子的表达也明显增加, 并认为IBD的发生发展与淋巴细胞归巢(LH)密切相关. 本实验选择病变以盲肠和结肠为主, 病理学特征与人类克罗恩病(CD)十分相似的IL-10基因敲除小鼠作为IBD模型, 给予植物乳杆菌(LP)在早期(4-8 wk)灌胃, 观察小鼠肠道黏附分子α4β7、ICAM-1和MAdCAM-1 mRNA和蛋白表达水平的变化, 从而探讨益生菌对LH和IBD的作用.
曹洁, 副教授, 中国人民解放军第二军医大学微生物学教研室
迄今为止, 关于多种益生菌对IBD治疗作用的动物实验和临床研究有很多, 证实了一些单一或复合益生菌能缓解IBD的复发, 起到辅助治疗的效果, 但益生菌改善IBD临床表现的作用机制目前尚不明确.
Angulo et al通过手术在大鼠结肠中创造一段无粪流的肠段, 用抗生素除去该肠段原有菌群后, 植入来自炎症大鼠结肠的正常菌群, 其是否含干酪乳杆菌(L. casei)作对照研究, 三硝基苯磺酸(TNBS)诱导结肠炎, 发现L. casei干预能显著降低结肠LH, 同时伴有ICAM-1表达明显降低.
乳酸杆菌能对其他细菌施加拮抗作用, 限制肠道菌群, 从而在抑制肠道病原细菌的生长和黏附方面发挥重要作用.
本文选题新颖, 实验设计合理, 结果可信, 具有一定的参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Matsuzaki K, Tsuzuki Y, Matsunaga H, Inoue T, Miyazaki J, Hokari R, Okada Y, Kawaguchi A, Nagao S, Itoh K. In vivo demonstration of T lymphocyte migration and amelioration of ileitis in intestinal mucosa of SAMP1/Yit mice by the inhibition of MAdCAM-1. Clin Exp Immunol. 2005;140:22-31. [PubMed] [DOI] |
| 2. | Teramoto K, Miura S, Tsuzuki Y, Hokari R, Watanabe C, Inamura T, Ogawa T, Hosoe N, Nagata H, Ishii H. Increased lymphocyte trafficking to colonic microvessels is dependent on MAdCAM-1 and C-C chemokine mLARC/CCL20 in DSS-induced mice colitis. Clin Exp Immunol. 2005;139:421-428. [PubMed] [DOI] |
| 3. | Rutgeerts P, Sandborn WJ, Feagan BG, Reinisch W, Olson A, Johanns J, Travers S, Rachmilewitz D, Hanauer SB, Lichtenstein GR. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med. 2005;353:2462-2476. [PubMed] [DOI] |
| 4. | Järnerot G, Hertervig E, Friis-Liby I, Blomquist L, Karlén P, Grännö C, Vilien M, Ström M, Danielsson A, Verbaan H. Infliximab as rescue therapy in severe to moderately severe ulcerative colitis: a randomized, placebo-controlled study. Gastroenterology. 2005;128:1805-1811. [PubMed] [DOI] |
| 5. | Lees CW, Heys D, Ho GT, Noble CL, Shand AG, Mowat C, Boulton-Jones R, Williams A, Church N, Satsangi J. A retrospective analysis of the efficacy and safety of infliximab as rescue therapy in acute severe ulcerative colitis. Aliment Pharmacol Ther. 2007;26:411-419. [PubMed] |
| 6. | Aratari A, Papi C, Clemente V, Moretti A, Luchetti R, Koch M, Capurso L, Caprilli R. Colectomy rate in acute severe ulcerative colitis in the infliximab era. Dig Liver Dis. 2008;40:821-826. [PubMed] [DOI] |
| 7. | Gisbert JP, González-Lama Y, Maté J. Systematic review: Infliximab therapy in ulcerative colitis. Aliment Pharmacol Ther. 2007;25:19-37. [PubMed] |
| 8. | Jakobovits SL, Jewell DP, Travis SP. Infliximab for the treatment of ulcerative colitis: outcomes in Oxford from 2000 to 2006. Aliment Pharmacol Ther. 2007;25:1055-1060. [PubMed] |
| 9. | Feagan BG, Greenberg GR, Wild G, Fedorak RN, Paré P, McDonald JW, Dubé R, Cohen A, Steinhart AH, Landau S. Treatment of ulcerative colitis with a humanized antibody to the alpha4beta7 integrin. N Engl J Med. 2005;352:2499-2507. [PubMed] [DOI] |
| 10. | Danese S, De la Rue SA, Gasbarrini A. Antibody to alpha4beta7 integrin for ulcerative colitis. N Engl J Med. 2005;353:1180-1181; author reply 1180-1181. [PubMed] [DOI] |
| 11. | D'Haens G, Daperno M. Advances in biologic therapy for ulcerative colitis and Crohn's disease. Curr Gastroenterol Rep. 2006;8:506-512. [PubMed] [DOI] |
| 12. | Hatoum OA, Heidemann J, Binion DG. The intestinal microvasculature as a therapeutic target in inflammatory bowel disease. Ann N Y Acad Sci. 2006;1072:78-97. [PubMed] [DOI] |
| 13. | Mackay CR. Moving targets: cell migration inhibitors as new anti-inflammatory therapies. Nat Immunol. 2008;9:988-998. [PubMed] [DOI] |
| 14. | Schultz M. Clinical use of E. coli Nissle 1917 in inflammatory bowel disease. Inflamm Bowel Dis. 2008;14:1012-1018. [PubMed] [DOI] |
| 15. | Bibiloni R, Fedorak RN, Tannock GW, Madsen KL, Gionchetti P, Campieri M, De Simone C, Sartor RB. VSL#3 probiotic-mixture induces remission in patients with active ulcerative colitis. Am J Gastroenterol. 2005;100:1539-1546. [PubMed] [DOI] |
| 16. | Miele E, Pascarella F, Giannetti E, Quaglietta L, Baldassano RN, Staiano A. Effect of a probiotic preparation (VSL#3) on induction and maintenance of remission in children with ulcerative colitis. Am J Gastroenterol. 2009;104:437-443. [PubMed] [DOI] |
| 17. | Ewaschuk JB, Tejpar QZ, Soo I, Madsen K, Fedorak RN. The role of antibiotic and probiotic therapies in current and future management of inflammatory bowel disease. Curr Gastroenterol Rep. 2006;8:486-498. [PubMed] [DOI] |
| 18. | Zocco MA, dal Verme LZ, Cremonini F, Piscaglia AC, Nista EC, Candelli M, Novi M, Rigante D, Cazzato IA, Ojetti V. Efficacy of Lactobacillus GG in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther. 2006;23:1567-1574. [PubMed] [DOI] |
| 19. | Schultz M, Veltkamp C, Dieleman LA, Grenther WB, Wyrick PB, Tonkonogy SL, Sartor RB. Lactobacillus plantarum 299V in the treatment and prevention of spontaneous colitis in interleukin-10-deficient mice. Inflamm Bowel Dis. 2002;8:71-80. [PubMed] [DOI] |
| 20. | Saverymuttu SH, Camilleri M, Rees H, Lavender JP, Hodgson HJ, Chadwick VS. Indium 111-granulocyte scanning in the assessment of disease extent and disease activity in inflammatory bowel disease. A comparison with colonoscopy, histology, and fecal indium 111-granulocyte excretion. Gastroenterology. 1986;90:1121-1128. [PubMed] |
| 21. | Marteau P, Lepage P, Mangin I, Suau A, Doré J, Pochart P, Seksik P. Review article: gut flora and inflammatory bowel disease. Aliment Pharmacol Ther. 2004;20 Suppl 4:18-23. [PubMed] [DOI] |
| 22. | Bibiloni R, Mangold M, Madsen KL, Fedorak RN, Tannock GW. The bacteriology of biopsies differs between newly diagnosed, untreated, Crohn's disease and ulcerative colitis patients. J Med Microbiol. 2006;55:1141-1149. [PubMed] [DOI] |
| 23. | Martinez-Medina M, Aldeguer X, Gonzalez-Huix F, Acero D, Garcia-Gil LJ. Abnormal microbiota composition in the ileocolonic mucosa of Crohn's disease patients as revealed by polymerase chain reaction-denaturing gradient gelelectrophoresis. Inflamm Bowel Dis. 2006;12:1136-1145. [PubMed] [DOI] |
| 24. | Sokol H, Seksik P, Rigottier-Gois L, Lay C, Lepage P, Podglajen I, Marteau P, Doré J. Specificities of the fecal microbiota in inflammatory bowel disease. Inflamm Bowel Dis. 2006;12:106-111. [PubMed] [DOI] |
| 25. | Tamboli CP, Neut C, Desreumaux P, Colombel JF. Dysbiosis in inflammatory bowel disease. Gut. 2004;53:1-4. [PubMed] [DOI] |
| 26. | Conte MP, Schippa S, Zamboni I, Penta M, Chiarini F, Seganti L, Osborn J, Falconieri P, Borrelli O, Cucchiara S. Gut-associated bacterial microbiota in paediatric patients with inflammatory bowel disease. Gut. 2006;55:1760-1767. [PubMed] [DOI] |
| 27. | Madsen KL, Doyle JS, Jewell LD, Tavernini MM, Fedorak RN. Lactobacillus species prevents colitis in interleukin 10 gene-deficient mice. Gastroenterology. 1999;116:1107-1114. [PubMed] [DOI] |
| 28. | Ott SJ, Musfeldt M, Wenderoth DF, Hampe J, Brant O, Fölsch UR, Timmis KN, Schreiber S. Reduction in diversity of the colonic mucosa associated bacterial microflora in patients with active inflammatory bowel disease. Gut. 2004;53:685-693. [PubMed] [DOI] |
| 29. | Angulo S, Llopis M, Antolín M, Gironella M, Sans M, Malagelada JR, Piqué JM, Guarner F, Panés J. Lactobacillus casei prevents the upregulation of ICAM-1 expression and leukocyte recruitment in experimental colitis. Am J Physiol Gastrointest Liver Physiol. 2006;291:G1155-G1162. [PubMed] [DOI] |
| 30. | Okada Y, Tsuzuki Y, Miyazaki J, Matsuzaki K, Hokari R, Komoto S, Kato S, Kawaguchi A, Nagao S, Itoh K. Propionibacterium freudenreichii component 1.4-dihydroxy-2-naphthoic acid (DHNA) attenuates dextran sodium sulphate induced colitis by modulation of bacterial flora and lymphocyte homing. Gut. 2006;55:681-688. [PubMed] [DOI] |