修回日期: 2009-03-26
接受日期: 2009-03-30
在线出版日期: 2009-04-28
目的: 观察白花丹含药血清对大鼠肝星状细胞(HSC-T6)增殖、凋亡细胞周期的影响, 探讨白花丹抗肝纤维化的作用及其机制.
方法: SD大鼠用白花丹水煎液灌胃(大、中、小剂量), 取得含药血清. 含药血清按不同浓度(50、100、200 mL/L)分组与大鼠HSC-T6孵育. 设立空白对照组, 并以秋水仙碱和复方鳖甲软肝片含药血清为阳性对照组. 孵育后各组采用MTT比色法检测各组HSC-T6的增殖; 流式细胞仪检测细胞凋亡及各细胞周期DNA含量的百分比.
结果: HSC-T6白花丹含药血清各组与空白组比较, 增殖抑制率和细胞凋亡率明显增高, 有显著性差异(P<0.01); 并且含药血清浓度增高时, HSC-T6的抑制率、凋亡率也逐渐增强; 血清高浓度组的增殖抑制率和细胞凋亡率明显高于秋水仙碱组(P<0.01), 与复方鳖甲软肝片组相当; 各组的G2/M期细胞百分比无明显变化. HSC-T6白花丹含药血清各组与空白组比较, G0/G1期的细胞百分比明显增高(55.23%±2.83%, 52.60%±2.26%, 48.75%±1.37% vs 44.08%±1.41%, 均P<0.01)、S期细胞百分比明显降低(31.47%±1.26%, 34.14%±1.17%, 40.28%±1.62% vs 47.36%±1.35%, 均P<0.01). 并且含药血清浓度下降时, G0/G1期的细胞百分比逐渐下降, S期细胞百分比逐渐增高. 同一血清浓度下, 与秋水仙碱组比较, 白花丹组的G0/G1期细胞百分比明显较高(P<0.01), S期细胞百分比明显较低; 而与复方鳖甲软肝片组无显著性差异.
结论: 白花丹含药血清可以抑制HSC-T6增殖, 诱导其凋亡, 且作用具有剂量依赖性. 白花丹含药血清抑制HSC-T6增殖的机制可能是使HSC-T6细胞周期停滞于G0/G1期, 阻止其通过G1/S关卡.
引文著录: 李荣华, 彭岳, 赵铁建, 韦燕飞, 谢海源, 廖丹, 方卓, 刘雪梅. 白花丹对大鼠肝星状细胞增殖、凋亡及细胞周期的影响. 世界华人消化杂志 2009; 17(12): 1171-1177
Revised: March 26, 2009
Accepted: March 30, 2009
Published online: April 28, 2009
AIM: To observe the effects of the plumbago -containing serum on proliferation, apoptosis and cell cycle of the rat hepatic stellate cells (HSC-T6) so as to explore the plumbago's anti-hepatic fibrosis effects and its mechanism.
METHODS: Plumbago-containing serum was obtained by intragastric administration to the SD rats with plumbago decoction. HSC-T6 was incubated at different concentrations of the plumbago -containing serum. The colchicine and Fufang compound biejia containing serum were used as positive control group. MTT were applied to measure the HSC-T6 proliferation and flow cytometry to measure the cell apoptosis, and the percentage of DNA content in different groups.
RESULTS: Compared with blank group, all the plumbago-containing serum groups had a significantly higher proliferation inhibition rate and apoptosis rate (P < 0.01). When the plumbago-containing serum concentration was increased, proliferation inhibition rate and apoptosis rate to HSC-T6 reached the highest. Its action intensity was the same as compound biejia but stronger than that of Colchicine's. Cell percentage in G2/M phase had no significant change in each group. Compared with blank control group, the cell percentage in G0/G1 phase was significantly increased and significantly decreased in S phase in all plumbago -containing serum groups, (55.23% ± 2.83%, 52.60% ± 2.26%, 48.75% ± 1.37% vs 44.08% ± 1.41%, all P < 0.01; 31.47% ± 1.26%, 34.14% ± 1.17%, 40.28% ± 1.62% vs 47.36% ± 1.35%, all P < 0.01). When the plumbago-containing serum concentration was decreased, the cell percentage was significantly decreased in G0/G1 phase and significantly decreased in S phase. Compared with colchicine group at the same serum concentration, the cell percentage was significantly increased in G0/G1 phase and significantly decreased in S phase in all plumbago-containing serum groups, compared with compound biejia group, but there was no significant difference.
CONCLUSION: The plumbago-containing serum can inhibit the proliferation and induce apoptosis to HSC-T6, in a dose-dependent manner. Its action intensity is the same as compound biejia but stronger than that of Colchicine's. The possible mechanism to inhibit the proliferation of HSC-T6 may be related with HSC-T6's stagnation in G0/G1 phase due to plumbago's action to prevent HSC-T6 to pass G1/S checkpoint.
- Citation: Li RH, Peng Y, Zhao TJ, Wei YF, Xie HY, Liao D, Fang Z, Liu XM. Effects of plumbago zeylanica on the proliferation, apoptosis and cell cycle of HSC-T6. Shijie Huaren Xiaohua Zazhi 2009; 17(12): 1171-1177
- URL: https://www.wjgnet.com/1009-3079/full/v17/i12/1171.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i12.1171
肝纤维化(hepatic fibrosis, HF)是多种慢性肝病病情发展的共同病理基础, 其进一步发展可形成肝硬化, 严重影响患者健康及生命[1]. HF是各种致病因素导致肝内结缔组织异常增生的肝内弥散性细胞外基质(extracellular matrix, ECM)过度沉积的病理过程, 是机体对慢性损伤的主动性修复反应[2]. 以肝脏ECM增生与沉积为特征[3]. 目前, 学者们普遍认为, 肝星状细胞(hepatic stellate cell, HSC)的增生和激活, 是HF发生的中心环节, 是HF形成的细胞学基础[4]. 激活后的HSC进一步转化为肌成纤维细胞, 后者可大量合成ECM蛋白, 而ECM的大量沉积, 最终导致了HF形成[5].
鉴于HSC的重要作用, 以HSC作为靶细胞, 建立体外HF模型对于筛选新的抗HF药物, 研究其作用机制就具有重要意义. 本实验采用具有稳定形态与细胞生物学特性的大鼠HSC系HSC-T6作为研究靶标, 研究广西特产药用植物白花丹的抗HF作用.
已有多方面研究显示, 白花丹显示出有效的治疗和逆转HF的药理作用[6-9]. 他的抗HF作用是通过抑制HSC的活性实现的吗? 如果是, 那HSC的增殖和凋亡的具体情况又如何? 故本研究采用MTT比色法观察白花丹药物血清对HSC-T6增殖的影响, 流式细胞术测细胞凋亡及细胞周期. 从而为白花丹的临床应用奠定实验基础.
清洁级Sprague Dawley(简称SD)大鼠24只, 雌雄各半, 体质量200-230 g, 湖南省实验动物中心提供[scxk(湘)2006-0001]. HSC-T6细胞由上海中医药大学肝病研究所徐列明教授提供. 白花丹购自广西中医学院国医药店. 四甲基噻唑蓝(MTT)及碘化丙锭(PI)为美国Sigma公司产品.
1.2.1 分组与各组工作液配制: (1)制备含药血清的动物的分组: 将SD大鼠随机分为正常血清对照组(A组)、白花丹大、中、小剂量灌胃组(B、C、D组)、秋水仙碱灌胃组(E组)、复方鳖甲软肝片灌胃组(F组), 共6组. 每组4只. 每组样本量的确定参照文献[10]方法. (2)细胞分组: 将对数分裂期的HSC-T6细胞接种入培养板后, 以孔为单位, 先按以上大鼠血清种类分为A、B、C、D、E、F共6大组, 每大组又按工作液中的含药血清浓度(50、100、200 mL/L的含药血清)分为3个小组. 每小组设5个复孔. (3)各组细胞工作液的配制: A组: 低浓度小组(含50 mL/L正常大鼠血清): 10 μL正常大鼠血清+190 μL DMEM; 中浓度小组(含100 mL/L正常大鼠血清): 20 μL正常大鼠血清+180 μL DMEM; 高浓度小组(含200 mL/L大鼠血清): 40 μL正常大鼠血清+160 μL DMEM. B、C、D、E、F组的各浓度梯度小组的工作液配制同A组.
1.2.2 各用药组灌胃药液的制备: (1)白花丹水煎液的制备: 将白花丹原药90 g浸泡20 min(水浸过药面2 cm). 武火煮沸后改用文火煎30 min, 冷却30 min后滤渣取汁. 将滤渣如上法再煎煮2次取汁. 将3次药汁混合, 用文火适度, 浓缩至120 mL, 浓度为0.75 kg/L, 制成大剂量白花丹水煎剂, 置冰箱4℃备用. 使用前按要求稀释成中剂量(白花丹中剂量为成人用量的30倍, 即7.5 g/kg). (2)秋水仙碱灌胃药液的制备: 秋水仙碱治疗肝纤维化, 成人(60 kg)的日用量为1 mg, 大鼠的中剂量为成人用量的30倍(即0.25 mg/kg). 使用时以蒸馏水调制药液成0.025 g/L. (3)复方鳖甲软肝片灌胃药液的制备: 复方鳖甲软肝片的成人(60 kg)日用量为6 g, 0.1 g/kg, 大鼠用量为成人用量的15倍(即1.5 g/kg). 用时以蒸馏水调制, 使1 mL药液中含复方鳖甲软肝片0.15 g. 各组剂量选择, 按参考文献[11]方法, 以临床常用量按体表面积换算.
1.2.3 灌胃给药: 以上各组均以相应的药物灌胃(正常血清对照组以生理盐水灌胃). 灌胃量均为1 mL/100 g体质量. 每天灌胃2次, 间隔12 h, 连续给药3 d[12].
1.2.4 标本采集及处理: 末次给药后1 h采血(灌药前禁食不禁水12 h), 10 g/L戊巴比妥钠(0.35 mL/100 g)腹腔麻醉, 腹主动脉采血, 室温下静置4 h, 3000 r/min离心15 min, 分离血清, 同组血清相混, 将各组血清用56℃水浴灭活30 min, 以除去可能存在的生物活性物质, 再用0.22 μm的微孔滤膜过滤除菌, 置-20℃冰箱保存备用[13].
1.2.5 用MTT比色法检测HSC-T6的增殖: 相关方法参考章静波 et al[14]论著, 具体步骤如下: (1)待HSC-T6细胞生长融合成单层后, 用2.5 g/L胰蛋白酶消化, 并接种至无菌96孔板内, 细胞接种密度约为5×106个/L, 每孔加入细胞悬液200 μL, 继续培养; (2)在37℃、50 mL/L CO2培养箱中培养24 h后, 加入无血清DMEM培养液(每孔200 μL)培养24 h, 使细胞同步化于静止期. (3)弃上清. 各孔按实验分组要求加入相应的工作液. 移入细胞培养箱继续培养48 h. (4)48 h后取出培养板, 每孔加入MTT溶液20 μL. 37℃继续培养4 h后, 小心吸去上清, 每孔加入DMSO 200 μL, 室温下, 用微型超声振荡器混匀; (5)用酶标仪(波长为570 nm, 参比波长为450 nm)测定每组细胞的A值, 重复3次. (6)按以下公式计算细胞抑制率(inhibition rate, IR): 抑制率 = (1-实验组平均A值/对照组平均A值)×100%[15].
1.2.6 流式细胞术检测细胞凋亡及各周期DNA含量: 相关方法参考文献[16-17], 具体步骤如下: (1)取对数生长期的HSC-T6细胞, 胰酶消化后制备成细胞悬液. 离心收集细胞(2000 r/min, 5 min), 用含50 mL/L胎牛血清的DMEM培养液配成1×108个/L浓度的细胞悬液, 以每孔2 mL的量接种于6孔培养板内. (2)将6孔培养板移入细胞培养箱, 在37℃、50 mL/L CO2培养箱中培养24 h. (3)弃旧培养液. 各孔按实验分组要求加入相应的工作液. 移入细胞培养箱继续培养48 h. (4)培养结束后, 再用胰酶消化, 制备成细胞悬液. 离心收集细胞(2000 r/min, 5min)后, 用PBS液洗涤细胞1次, 离心弃PBS, 再次用PBS充分混匀细胞. 加入冰冷的700 mL/L乙醇进行细胞固定, 混匀, 用封口膜封口, 4℃过夜. (5)弃去700 mL/L乙醇后, 以PBS洗涤细胞2次. 用剩余的约0.5 mL的PBS液将固定了的细胞混匀. 加入流式细胞试剂RnaseA(终浓度为50 mg/L). 在37℃消化1 h后, 加入试剂PI(终浓度为50 mg/L), 于4℃染色1 h后, 上流式细胞仪检测. (6)在Epicsxl流式细胞仪上进行测定, 分析细胞的凋亡情况及细胞的周期情况[18]. 计算细胞周期的各个时相时DNA的百分含量. 包括DNA静止期/DNA合成前期(G0/G1期)、DNA合成期(S期)、DNA合成后期(G2期)及分裂期(M期)DNA的百分含量. 以氩离子激光器488或514 nm波长光激发; 阻断滤片为620 nm长波通滤片. 每份标本约测定10 000个细胞. 测定速率为每秒50-60个细胞.
统计学处理 各组数据均以mean±SD表示. 数据处理采用PEMS3.1统计软件, 多个样本比较用q检验. 以P<0.05为有统计学差异.
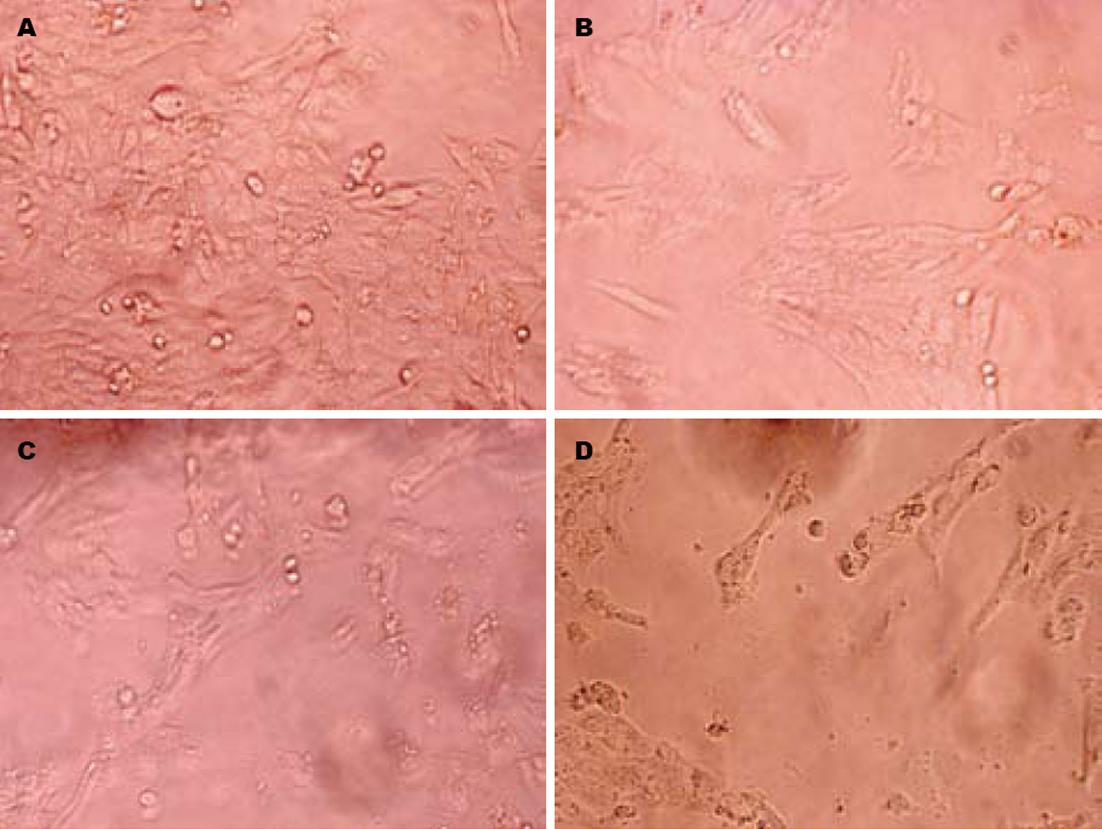
倒置显微镜下HSC-T6细胞正常血清对照组的细胞成集落, 细胞较丰富, 形态多样且较大, 呈星型、梭型、多边形, 折光性好(图1A). 白花丹各药物血清组与正常血清对照组相比, 细胞集落现象减少, 可见较多散在细胞, 且细胞体积变小, 胞体皱缩, 可见弥散的较小细胞组织, 折光性减弱; 且随着白花丹灌胃剂量增加及药物血清浓度增大, 细胞的集落现象更少甚至消失, 细胞的形态也更小, 细胞呈散在状态, 总数减少, 且胞体皱缩更加明显, 弥散的较小细胞组织增多, 折光性进一步减弱(图1B-D).
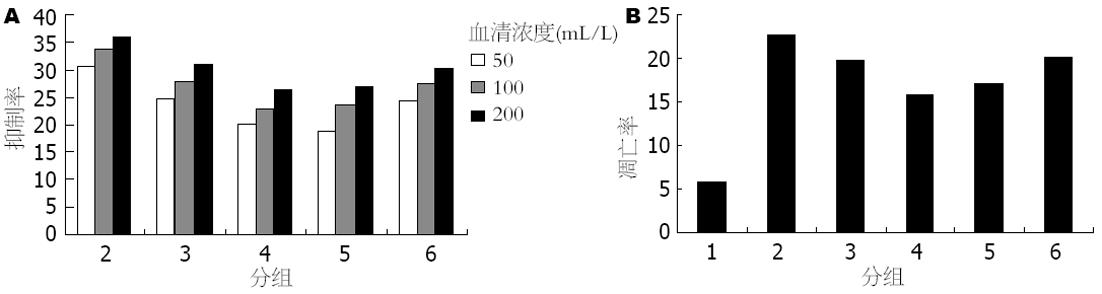
与A组相比, B、C、D、E、F各药物血清均可抑制HSC-T6的增殖, 差异有显著的统计学意义(均P<0.01); 在50-200 mL/L的血清浓度范围内, B、C、D、E、F各药物血清对HSC-T6的抑制作用逐渐增强; 同血清浓度B、C组增殖的抑制率均显著高于E组(均P<0.01), C组增殖的抑制率与F组相当; 同血清浓度B、C、D组随着白花丹灌胃剂量的减少, 抑制作用逐渐减弱(表1, 图2A).
与A组相比, B、C、D、E、F各药物血清组HSC-T6细胞凋亡率均明显增高, 差异有显著的统计学意义(22.64%±3.12%, 19.76%±2.41%, 15.86%±2.04%, 17.15%±2.14%, 20.09%±2.66% vs 5.87%±1.06%, 均P<0.01, 图2B); B、C组的凋亡率显著高于E组, 差异有显著的统计学意义(均P<0.01), C组的凋亡率与F组相当; B、C、D组随着白花丹灌胃剂量的减少, 凋亡率也逐渐降低(图3).
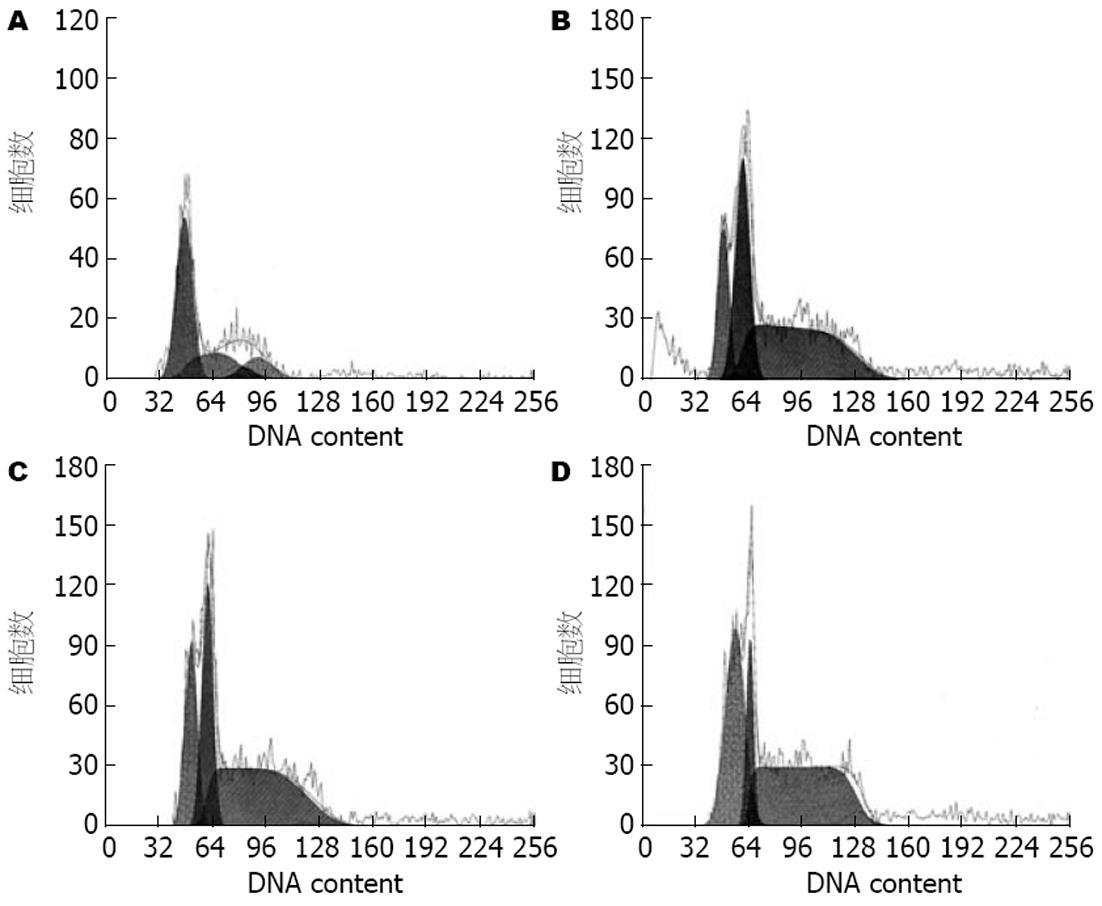
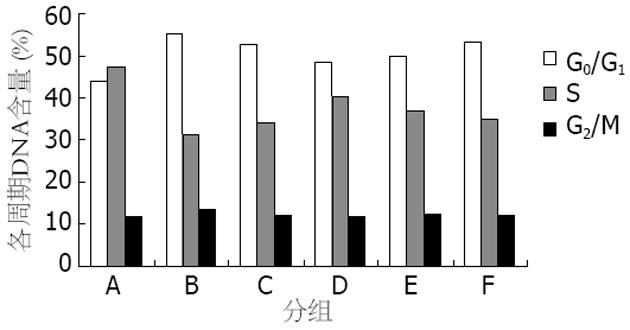
与A组相比, B、C、D、E、F各组HSC-T6 G0/G1期细胞百分比明显增高(均P<0.01), B组、C组明显高于E组(均P<0.01), C组与F组相当; B、C、D组随着白花丹灌胃剂量减少, G0/G1期细胞百分比也逐渐降低(表2, 图3). 与A组相比, B、C、D、E、F各组HSC-T6 S期细胞百分比明显降低(均P<0.01), B组、C组明显低于E组(均P<0.01), C组与F组相当; B、C、D组随着白花丹灌胃剂量减少, S期细胞百分比逐渐增高. 各组药物血清干预后, G2/M期细胞百分比无明显变化(图4).
HF是肝脏受到慢性损伤时, 针对损伤因子所产生的一个自我愈合过程, 同时又是所有慢性肝病进展成肝硬化的共同病理基础与必经阶段, 是影响慢性肝病预后的重要环节. 我国是肝病高发国家, 以慢性乙型、丙型病毒性肝炎最为常见, 严重影响着我国人民的生命质量和劳动力水平, 在当前尚无良好抗病毒方法的情况下, 阻止或逆转HF进程已成为慢性肝病相当重要的治疗对策.
HF的病理学基础为ECM的合成增加, 降解减少, 导致胶原过度沉积[19]. 随着对HF发病机制的深入研究和认识, 目前普遍认为HSC是肝脏合成ECM的主要细胞. HSC的激活和增殖在HF发生、发展过程中起核心作用, 所以, 如何通过抑制HSC的活化和增殖, 诱导其凋亡而达到抗HF目的, 是一个较为关键的问题.
随着HF发生机制的逐渐阐明, 使HF的预防, 治疗, 甚至逆转成为可能. 但迄今为止, 现代医学尚无良好的治疗方法, 而中医中药以其对HF的良好预防和治疗效果及低毒性反应等特点目前已引起国内外学者的广泛关注. 植物白花丹是一种具有治疗肝炎肝硬化的广西特色中草药, 其味苦、性微温、有毒. 该药有祛风止痛、散瘀消肿的作用, 可治疗风湿骨痛、腰腿痛、心胃气痛、肝脾肿大等, 为多民族的常用药材, 在民间应用较广泛. 经总结, 从各民族的民间应用记载[20], 中医理论对肝纤维化的辩证施治的认识, 临床应用的疗效[6]以及现代医学对其干预HF疾病的研究[21]等方面来看, 白花丹所显示的药理作用对治疗和逆转HF都是有效的, 具有较大的研究开发价值.
血清药理学是指动物或人服用一定剂量的药物后, 经过一定时间后采血分离血清, 用此含药物的血清进行体外药理实验的一种实验方法. 体外药理研究具有快捷迅速、敏感特异、条件易控等优点[22]. 该方法可以在一定程度上克服传统的中药在体外研究方法中的某些弊病. 传统体外研究方法中, 将药物的提取物直接加到细胞的培养液中, 不能反映出中药在体内代谢后有效成分发生的变化, 影响了实验的可靠性. 采用药物血清培养细胞可以模拟药物成分经过代谢转化后作用于靶细胞的直接作用模式, 便于应用细胞学和分子生物学手段, 从基因、基因产物、药物受体和酶活性等诸方面准确地阐述药理机制.
本实验以白花丹含药血清作为施加因素, 以公认具有较稳定细胞形态与生物学特性的HSC-T6细胞株作为受试对象, 以HSC-T6细胞的增殖抑制率、细胞的凋亡和周期变化作为效应指标. 实验结果表明白花丹药物血清可以明显地抑制HSC-T6增殖, 并诱导其凋亡; 细胞周期分析, 白花丹含药物血清抑制HSC-T6细胞增殖的机制可能是使其周期停滞于G0/G1期, 阻止其通过G1/S关卡; 在抑制HSC-T6增殖、诱导其凋亡作用上, 白花丹药物血清作用强于秋水仙碱对照组, 与复方鳖甲软肝片对照组相当.
白花丹为广西特产药用植物. 味苦、性微温、有毒. 其可祛风、散瘀、解毒. 为广西民族药材, 各民族用于治疗肝炎、肝硬化和肝区疼痛、肝脾肿大, 疗效肯定. 但对白花丹进行细胞和分子水平的研究, 探讨其抗肝纤维化的作用及其机制报道甚少.
徐列明, 教授, 上海中医药大学附属曙光医院(东部)肝二科
随着HF发生机制的逐渐阐明, 使HF的预防, 治疗, 甚至逆转成为可能. 但迄今为止, 现代医学尚无良好的治疗方法, 而中医中药以其对HF的良好预防和治疗效果及低毒性反应等特点已引起国内外学者的广泛关注.
本课题组的前期研究已证明: 白花丹提取物具有抑制CCl4诱导的急性肝损害和肝组织脂质过氧化作用; 并能减轻肝纤维化组织内纤维增生. 白花丹含药血清对HSC增殖有明显抑制作用并降低Ⅰ型和Ⅲ型胶原表达和沉积面积.
本研究采用药物血清培养细胞可以模拟药物成分经过代谢转化后作用于靶细胞的直接作用模式, 便于应用细胞学和分子生物学手段, 从基因、基因产物、药物受体和酶活性等诸方面准确地阐述药理机制.
本研究选题尚可, 有一定的创新性, 对开发抗肝纤维化药物有一定的启发意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Lee KS, Buck M, Houglum K, Chojkier M. Activation of hepatic stellate cells by TGF alpha and collagen type I is mediated by oxidative stress through c-myb expression. J Clin Invest. 1995;96:2461-2468. [PubMed] [DOI] |
| 3. | Li D, Friedman SL. Liver fibrogenesis and the role of hepatic stellate cells: new insights and prospects for therapy. J Gastroenterol Hepatol. 1999;14:618-633. [PubMed] [DOI] |
| 4. | Parsons CJ, Bradford BU, Pan CQ, Cheung E, Schauer M, Knorr A, Krebs B, Kraft S, Zahn S, Brocks B. Antifibrotic effects of a tissue inhibitor of metalloproteinase-1 antibody on established liver fibrosis in rats. Hepatology. 2004;40:1106-1115. [PubMed] [DOI] |
| 5. | Iwamoto H, Nakamuta M, Tada S, Sugimoto R, Enjoji M, Nawata H. Platelet-derived growth factor receptor tyrosine kinase inhibitor AG1295 attenuates rat hepatic stellate cell growth. J Lab Clin Med. 2000;135:406-412. [PubMed] [DOI] |
| 6. | 国家中医药管理局《中华本草》编委会. 中华本草. 上海: 上海科学技术出版社 2000; 132. |
| 9. | 赵 铁建, 钟 振国, 方 卓, 付 杰军, 覃 玉智, 段 雪琳, 廖 丹. 白花丹水煎液对四氯化碳慢性肝损伤小鼠肝组织脂质过氧化的影响. 广西医科大学学报. 2006;23:725-726. |
| 11. | 徐 叔云, 卞 如濂, 陈 修. 实验药理方法学. 第3版. 北京: 人民卫生出版社 2002; 202-1351. |
| 12. | 张 绪富, 吕 志平, 赵 进军. 血清药理学在抗肝纤维化研究中的应用概况. 南京中医药大学学报(自然科学版). 2002;18:127-128. |
| 13. | Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983;65:55-63. [PubMed] [DOI] |
| 14. | 章 静波, 黄 东阳. 细胞生物学实验技术. 北京: 化学工业出版社 2006; 70-74. |
| 15. | Bellamy WT. Prediction of response to drug therapy of cancer. A review of in vitro assays. Drugs. 1992;44:690-708. [PubMed] [DOI] |
| 16. | 彭 黎明, 王 曾礼. 细胞凋亡的基础与临床. 北京: 人民卫生出版社 2000; 153. |
| 17. | David L, Spector D, Robert D. 细胞实验指南. 北京: 科学出版社 2001; 102. |
| 20. | 黄 燮才. 广西民族药简编. 第1版. 南宁: 广西民族出版社 1980; 252. |