修回日期: 2009-03-02
接受日期: 2009-03-09
在线出版日期: 2009-04-18
目的: 探讨大黄素、小檗碱改善非酒精性脂肪肝患者体内高瘦素水平的作用及机制.
方法: 用MTT法筛选大黄素、小檗碱作用于HepG2细胞实验浓度, 在HepG2细胞中加入高浓度的瘦素(10-6 mol/L)作为模型组, 在模型组中分别加入大黄素、小檗碱及地塞米松, 并设对照组进行比较. 用RT-PCR检测细胞上瘦素长型受体及短型受体mRNA的表达水平.
结果: 模型组细胞上瘦素长型受体及短型受体mRNA的表达水平较对照组显著下调(P<0.01), 大黄素、小檗碱及地塞米松组较模型组显著上调(P<0.01), 较对照组无明显改变(P>0.05).
结论: 大黄素和小檗碱具有通过上调瘦素受体mRNA的表达来治疗高浓度瘦素诱导机体产生非酒精性脂肪肝的作用.
引文著录: 尹春梅, 王琦, 王慧莲. 大黄素和小檗碱对高浓度瘦素作用下HepG2细胞瘦素受体mRNA表达的影响. 世界华人消化杂志 2009; 17(11): 1122-1125
Revised: March 2, 2009
Accepted: March 9, 2009
Published online: April 18, 2009
AIM: To investigate the effect of the emodin and berberine on leptin in patients with non-alcoholic fatty liver disease and its mechanism.
METHODS: The concentration of emodin and berberine-treating HepG2 cells was screened by MTT assay. Then high concentration of leptin was added (10-6 mol/L) to the HepG2 cells to establish a model group, and emodin, berberine and dexamethasone were given in the model group respectively. RT-PCR was used to detect the level of leptin receptor long-and short-receptor mRNA expression.
RESULTS: Compared with the normal control group, mRNA expression levels of leptin long- receptor and short-receptor in cells were significantly elevated in model group (P < 0.01). Emodin, berberine and dexamethasone obviously improved the expression (P < 0.01) compared with normal group. However, no significant change was noted (P > 0.05).
CONCLUSION: Emodin and berberine are effective for high-concentration leptin-induced non-alcoholic fatty liver disease through up-regulating the mRNA expression of leptin receptor.
- Citation: Yin CM, Wang Q, Wang HL. Impact of emodin and berberine on the mRNA expression of leptin receptor in HepG2 cells treated with high concentrations of leptin. Shijie Huaren Xiaohua Zazhi 2009; 17(11): 1122-1125
- URL: https://www.wjgnet.com/1009-3079/full/v17/i11/1122.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i11.1122
瘦素系肥胖基因表达、由脂肪细胞分泌的循环激素, 在调节机体能量平衡中起重要作用, 可调节非脂肪细胞中游离脂肪酸和甘油三脂含量的稳定, 避免细胞发生脂毒性[1-2]. 作为蛋白质激素,瘦素的多种生物学作用是通过靶细胞膜上的瘦素受体(obese receptor, OB-R)和相应信号转导系统实现的, 信号发送主要是通过其受体基因编码的两种细胞表面受体长型受体(OB-Rb)和短型受体(OB-Ra)[3]. 许多研究发现[4-6]非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)患者存在高瘦素水平, 机体在高浓度瘦素的作用下可对能量物质代谢产生不利影响, 高瘦素水平可提高胰岛素水平、促进胰岛素抵抗(insulin resistance, IR), 并改变胰岛素信号, 增加肝细胞内脂肪酸含量, 最终引起脂肪肝.
瘦素受体或受体后缺陷在高浓度瘦素引起机体产生NAFLD中可发挥一定的作用[7-9], 大量实验研究发现小檗碱及大黄素具有减肥降糖, 降低血胰岛素水平, 改善脂代谢紊乱及IR等作用[10-11], 但其对于NAFLD患者体内存在的高瘦素现象有无影响及其分子生物学作用机制尚不明确, 故本实验采用高浓度瘦素作用于HepG2细胞后, 加入大黄素、小檗碱, 通过检测细胞上瘦素受体的表达情况, 以探讨他们对高浓度瘦素引起的NAFLD治疗作用, 为临床治疗NAFLD提供理论依据.
小檗碱、大黄素、软脂酸购于Sigma公司; 人类瘦素为法国Diaclone Reserch公司产品; RPMI 1640培养基购于美国Gibco BRL公司; MTT北京夏斯生物技术有限公司; RNA提取试剂盒购于美国Gentra公司; PCR反应试剂盒购于美国Promega公司.
1.2.1 HepG2细胞的培养: 在含100 mL/L胎牛血清的RPMI 1640培养液中培养HepG2细胞, 将增殖状态良好的细胞用胰酶消化, 对其进行传代并置于37 ℃, 50 mL/L CO2饱和湿度的培养箱中.
1.2.2 MTT实验: 取大黄素浓度为0.1、5、10、15、20、25、30 µmol/L, 小檗碱(浓度分组同大黄素)用MTT法, 分别于酶标仪上检测570 nm、490 nm吸光度A值, 计算细胞存活率(细胞存活率=实验组A值/对照组A值×100%), 取细胞存活率为90%时的浓度为实验浓度.
1.2.3 细胞模型制作: 将瘦素溶于含有100 mL/L胎牛血清的RPMI 1640培养液中, 使其终浓度为10-6 mol/L, 小心吸弃HepG2细胞中的培养液, 加入含高浓度瘦素的培养液, 置于37 ℃, 50 mL/L CO2饱和湿度的培养箱中孵育24 h, 即成为细胞模型(模型组).
1.2.4 分组: 吸弃模型细胞中的培养液, 分别加入含大黄素、小檗碱及地塞米松的培养液以及正常培养液, (即将模型组分为4组: 模型组、大黄素组、小檗碱组、地塞米松组, 并设HepG2细胞作为对照组), 置于37 ℃, 50 mL/L CO2饱和湿度的培养箱中孵育24 h.
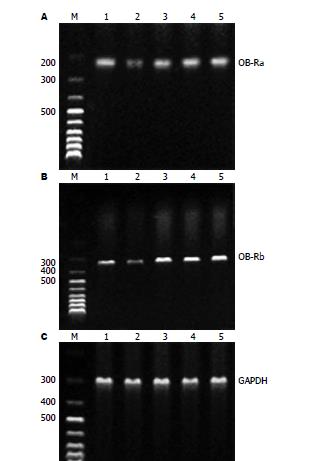
1.2.5 RT-PCR检测细胞中瘦素长型受体及短型受体mRNA的表达: (1)细胞总RNA的提取: TRIzol一步法提取细胞总RNA, 操作按说明书进行, 紫外分光光度仪测定RNA的A260/A280值. (2)cDNA第一链的合成: 逆转录反应体系为20 µL, 其中5×逆转录缓冲液4 µL, 核糖核酸酶抑制剂0.4 µL, 10 mmol/L dNTP 2 µL, 寡聚T引物0.4 µL, 细胞总RNA5 µg, M-MLV(逆转录酶)1 µL(200 U), 用DEPC-双蒸水补充至20 µL. 反应条件为42 ℃水浴1 h, 然后70 ℃水浴10 min以灭活逆转录酶. (3)RT-PCR: OB-Ra、OB-Rb的引物设计是根据GenBank库中OB-Ra、OB-Rb的cDNA序列进行, OB-Ra的上游引物: 5'-ATGTTCCGAACCCCAAGAAT-3', 下游引物: 5'-CAATAGTGGAGGGAGGGTCA-3', 扩增片段221 bp. OB-Rb的上游引物: 5'-CAGAAGCCAGAAACGTTTGAG-3',下游引物5'-AGCCCTTGTTCTTCACCAGT-3', 扩增片段344 bp; 内参照为GAPDH, 其上游引物: 5'-TGAACGGGAAGCTCACTGG-3', 下游引物: 5'-TCCACCACCCTGTTGCTGTA-3', 扩增片段307 bp. 反应体系25 µL, 其中Buffer 20.5 µL, cDNA 1 µL, Taq DNA聚合酶1.5 µL(5 U), 0.2 µmol/L上游引物及下游引物各1 µL. 扩增条件: 首次95 ℃预变性2 min, 然后95 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸45 s, 循环35次, 最后72 ℃延伸10 min. 取扩增产物5 µL, 用20 g/L的琼脂糖凝胶(EB浓度为0.5 mg/L)电泳, 以100 bp为分子质量标准, 在300 nm紫外光下摄影, 通过图像分析软件进行分析. 内参照也采用上述同样的实验方法进行分析. OB-Rb、OB-Ra的表达水平用他们的平均灰度值与内参的平均灰度值的比值表示.
统计学处理 全部数据使用SPSS13.0统计软件进行数据处理; 每组数据以mean±SD表示, 进行单因素方差分析, 组间两两比较用SNK检验, 取α = 0.01为显著性检验水准, P<0.05有统计学意义.
MTT实验测得大黄素、小檗碱可抑制HepG2细胞的生长并可诱导其凋亡, 这一作用呈剂量依赖性. 大黄素浓度为10 µmol/L时, HepG2存活率为90.8%, 小檗碱浓度为10 µmol/L时, HepG2存活率为91.3%, 故本实验大黄素、小檗碱均采用10 µmol/L作为实验浓度(表1).
| 分组浓度(µmol/L) | 细胞存活率(%) | |
| 大黄素 | 小檗碱 | |
| 0.1 | 1.116±0.053 | 1.032±0.050 |
| 5 | 0.986±0.031 | 0.972±0.028 |
| 10 | 0.908±0.035 | 0.913±0.024 |
| 15 | 0.882±0.024 | 0.887±0.033 |
| 20 | 0.806±0.048 | 0.811±0.055 |
| 25 | 0.670±0.032 | 0.671±0.030 |
| 30 | 0.491±0.021 | 0.512±0.047 |
HepG2细胞用高浓度软脂酸培养24 h后, OB-Ra mRNA、OB-Rb mRNA的表达的较正常组显著下降(Pa = 0.00047, Pb = 0.00032). 大黄素(Pa = 0.00067, Pb = 0.00042)、小檗碱(Pa = 0.00054, Pb = 0.00039)、地塞米松组(Pa = 0.00041, Pb = 0.00022)OB-Ra mRNA、OB-Rb mRNA的表达较模型组显著增高(均P<0.01), 与正常组相比无统计学差异(图1).
瘦素受体是Ⅰ类细胞因子受体家族的成员, 为一跨膜受体, 由胞外区、跨膜区和胞内区组成. 目前已知瘦素受体至少存在5种亚型, 其中最主要的为OB-Rb和OB-Ra. OB-Rb的胞内区有JAK/STAT结合位点, 能进行信号转导以调节热量摄入及能量消耗, 为功能受体, 他主要分布于下丘脑的弓形核、腹内侧核、背内侧核、室旁核等与体质量调节有关的核团上, 瘦素主要通过与下丘脑的OB-Rb结合, 从而激活JAK-STAT途径发挥作用[12-14]. OB-Ra几乎分布于全身各组织, 主要与瘦素的转运、代谢等有关[15].
瘦素在调节机体能量平衡中起重要作用, 可调节非脂肪细胞中游离脂肪酸和甘油三脂含量的稳定, 避免细胞发生脂毒性, 他的生物学作用是通过靶细胞膜上的瘦素受体和相应信号转导系统实现的, 信号发送主要是通过OB-Rb和OB-Ra.
Liu et al研究表明[15], 高浓度瘦素可抑制HepG2细胞上瘦素受体mRNA的表达水平, 在瘦素浓度为10-6 mol/L时这种抑制作用最为明显, 这可能与NAFLD患者体内存在高瘦素水平有关. 在本实验中我们亦观察到瘦素浓度为10-6 mol/L时可显著抑制HepG2细胞上瘦素长型及短型受体mRNA的表达水平, 这与他们的研究结果一致, 同时我们也观察到大黄素、小檗碱可以通过上调瘦素受体mRNA的表达水平来改善这种抑制作用, 上调后, 瘦素受体mRNA的表达量与对照组相似, 结果无统计学差异. 由此可见大黄素、小檗碱可通过影响瘦素受体mRNA的表达来调节机体内瘦素在调节能量平衡中所起的作用, 从而影响NAFLD的发展及预后, 这对于临床用于治疗NAFLD有一定的应用价值.
随着人们饮食结构的改变, 近年来NAFLD已成为我国常见的慢性肝病之一, 现代医学多使用的化学合成药物由于其对心血管系统具有严重的不良反应且长期服用具有肝毒性, 故中医中药的研究对于脂肪肝药物治疗具有重要意义.
党双锁, 教授, 西安交通大学第二医院感染科.
大黄素及小檗碱是否可以通过调节瘦素受体的表达来改善浓度瘦素对NAFLD的影响, 值得深入研究.
Liu et al研究表明, 高浓度瘦素可抑制HepG2细胞上瘦素受体mRNA的表达水平, 在瘦素浓度为10-6 mol/L时这种抑制作用最为明显, 这可能与NAFLD患者体内存在高瘦素水平有关.
本研究设计合理, 结果可靠, 对探讨大黄素、小檗碱治疗脂肪肝有重要意义.
编辑: 李军亮 电编:何基才
| 1. | Unger RH, Zhou YT, Orci L. Regulation of fatty acid homeostasis in cells: novel role of leptin. Proc Natl Acad Sci USA. 1999;96:2327-2332. [PubMed] [DOI] |
| 2. | Brown RE. Could there be a fine-tuning role for brain-derived adipokines in the regulation of bodyweight and prevention of obesity? Mcgill J Med. 2008;11:177-184. [PubMed] |
| 3. | Falsey AR, Erdman D, Anderson LJ, Walsh EE. Human metapneumovirus infections in young and elderly adults. J Infect Dis. 2003;187:785-790. [PubMed] [DOI] |
| 4. | Huang XD, Fan Y, Zhang H, Wang P, Yuan JP, Li MJ, Zhan XY. Serum leptin and soluble leptin receptor in non-alcoholic fatty liver disease. World J Gastroenterol. 2008;14:2888-2893. [PubMed] [DOI] |
| 5. | Le D, Marks D, Lyle E, Corless CL, Diggs BS, Jobe BA, Kay T, Deveney CW, Wolfe BM, Roberts CT Jr, O'Rourke RW. Serum leptin levels, hepatic leptin receptor transcription, and clinical predictors of non-alcoholic steatohepatitis in obese bariatric surgery patients. Surg Endosc. 2007;21:1593-1599. [PubMed] [DOI] |
| 6. | Nobili V, Manco M, Ciampalini P, Diciommo V, Devito R, Piemonte F, Comparcola D, Guidi R, Marcellini M. Leptin, free leptin index, insulin resistance and liver fibrosis in children with non-alcoholic fatty liver disease. Eur J Endocrinol. 2006;155:735-743. [PubMed] [DOI] |
| 7. | Ikejima K, Okumura K, Lang T, Honda H, Abe W, Yamashina S, Enomoto N, Takei Y, Sato N. The role of leptin in progression of non-alcoholic fatty liver disease. Hepatol Res. 2005;33:151-154. [PubMed] [DOI] |
| 8. | Ikejima K, Takei Y, Honda H, Hirose M, Yoshikawa M, Zhang YJ, Lang T, Fukuda T, Yamashina S, Kitamura T. Leptin receptor-mediated signaling regulates hepatic fibrogenesis and remodeling of extracellular matrix in the rat. Gastroenterology. 2002;122:1399-1410. [PubMed] [DOI] |
| 10. | 刘 锋, 冷 三华, 陆 付耳, 官 纯寿, 高 志强, 徐 丽君, 王 开富. 小檗碱对HepG2细胞肝细胞核因子基因表达的影响. 中国 中西医结合消化杂志. 2007;15:141-144. |
| 12. | Funahashi H, Yada T, Suzuki R, Shioda S. Distribution, function, and properties of leptin receptors in the brain. Int Rev Cytol. 2003;224:1-27. [PubMed] [DOI] |
| 13. | Jiang L, You J, Yu X, Gonzalez L, Yu Y, Wang Q, Yang G, Li W, Li C, Liu Y. Tyrosine-dependent and -independent actions of leptin receptor in control of energy balance and glucose homeostasis. Proc Natl Acad Sci USA. 2008;105:18619-18624. [PubMed] [DOI] |
| 14. | Ranadive SA, Vaisse C. Lessons from extreme human obesity: monogenic disorders. Endocrinol Metab Clin North Am. 2008;37:733-751, x. [PubMed] [DOI] |
| 15. | Liu ZJ, Yao XJ, Wang YC, Wang DY, Chen ZM, Zhai LL. [Effects of leptin and insulin on leptin receptors mRNA expression in human hepatocellular HepG2 cells]. Zhonghua Yixue Zazhi. 2005;85:396-399. [PubMed] |