修回日期: 2009-03-26
接受日期: 2009-03-30
在线出版日期: 2009-04-18
目的: 分析人胃癌组织和胃癌SGC7901细胞中STAT1、Caspase-7及p21waf的表达关系, 并探讨胃癌中IFN-γ-STAT1分子通路特点.
方法: 人胃癌组织免疫组织化学染色, IFN-γ及STAT1反义寡核苷酸处理SGC7901细胞. 免疫细胞化学、RT-PCR及图像分析的方法检测mRNA和蛋白水平变化, 应用Hoechest 33258观察细胞凋亡.
结果: 人胃癌组织Caspase-7与STAT1和p21waf正相关(r = 0.32, 0.22, 均P<0.05); SGC7901细胞经IFN-γ处理后, STAT1、Caspase-7和p21waf mRNA和蛋白表达明显上升(P<0.05). 经IFN-和不同浓度STAT1反义寡核苷酸联合处理后, STAT1 mRNA和蛋白表达较IFN-γ单独处理明显下降, 有浓度依赖性(P<0.05). Caspase-7和P21waf蛋白表达较IFN-γ单独处理明显下降, 有浓度依赖性(P<0.05), 但是mRNA表达量则随着STAT1反义寡核苷酸浓度变化, 出现Caspase-7先下降后上升, p21waf先上升后下降的变化. 经IFN-γ和STAT1反义寡核苷酸处理后细胞无明显凋亡.
结论: 人胃癌组织和胃癌细胞系SGC7901中存在IFN-γ-STAT1通路, 且可上调Caspase-7和p21waf的表达, 但无明显凋亡调控作用; 胃癌IFN-γ-STAT1分子通路的下游分子在mRNA水平和蛋白水平表达变化不一致.
引文著录: 邓昊, 镇鸿燕, 周红艳, 陈琼霞, 刘丽江. 人胃癌IFN-γ-STAT1通路的作用及其机制. 世界华人消化杂志 2009; 17(11): 1103-1107
Revised: March 26, 2009
Accepted: March 30, 2009
Published online: April 18, 2009
AIM: To investigate relationships among STAT1, Caspase-7 and p21waf in gastric adenocarcinoma tissue and gastric adenocarcinoma cell SGC7901, and to shed light on features of IFN-γ-STAT1 pathway in gastric adenocarcinoma.
METHODS: Gastric adenocarcinoma tissue was tested by immunohistochemical method. SGC7901 cell was treated with IFN-γ and STAT1 antisense oligonucleotides, and mRNA and protein expression was detected using RT-PCR, immunocytochemistry and image analysis methods. Apoptosis was determined by Hoechest 33258.
RESULTS: Caspase-7 was positive correlation with STAT1 and p21waf (r = 0.32, 0.22, both P < 0.05) in gastric adenocarcinoma tissue. IFN-γ promoted mRNA and protein expression of STAT1, Caspase-7 and p21waf was up-regulated in SGC7901 cell (P < 0.05). After treatment with IFN-γ along with varied concentrations of STAT1 antisense oligonucleotides, significantly lower STAT1 mRNA and protein expression was observed than IFN-γ used alone in SGC7901 cells, which showed a concentration-dependent manner (P < 0.05); significantly lower Caspase-7 and P21waf protein expression was observed than IFN-γ used alone in SGC7901 cell in a concentration-dependent manner (P < 0.05). However, mRNA expression of Caspase-7 was down-regulated first and then up-regulated, while mRNA expression of p21waf was up-regulated first and then down-regulated.
CONCLUSION: There is a IFN-γ-STAT1 pathway in gastric adenocarcinoma tissue and SGC7901 cell line. IFN-γ-STAT1 could up-regulate the expression of Caspase-7 and p21waf in gastric adenocarcinoma, but could not induce apoptosis. The downstream molecular of IFN-γ- STAT1 pathway has different expression features in mRNA and protein expression level in gastric adenocarcinoma.
- Citation: Deng H, Zhen HY, Zhou HY, Chen QX, Liu LJ. Role of IFN-γ-STAT1 pathway in human gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(11): 1103-1107
- URL: https://www.wjgnet.com/1009-3079/full/v17/i11/1103.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i11.1103
胃癌是一类严重威胁我国人群健康的恶性肿瘤[1-2]. 临床资料和实验研究显示胃癌细胞的凋亡率较低[3]. 转录信号转导子和活化子1(signal transducer and activator of transcription 1, STAT1)是干扰素γ(IFN-γ)信号传导通路中的重要分子, 可促进肿瘤细胞凋亡[4-6]. IFN-γ是Ⅱ型干扰素中的唯一成员, 在抗病毒, 细胞生长调节以及细胞凋亡调节等方面发挥其生物学作用[7-8]. IFN-γ主要通过与Jak蛋白酪氨酸激酶(janus protein tyrosine kinase, JAK)2受体结合, 促进STAT1蛋白的Y701和S727位点磷酸化并使STAT1同源二聚化. STAT1同源二聚体入核后, 可与具有GAS(gamma activated sequence)结构的启动子序列结合发挥转录调控作用[9-11]. 在细胞凋亡方面, 所涉及的主要环节可能是STAT1可促进p21waf、Caspase-7等表达[12-13]. 本研究拟通过使用临床病理学和细胞生物学的方法, 观察STAT1、Caspase-7和p21waf在胃癌组织和细胞系中的表达关系, 及经IFN-γ处理后三者分子水平的变化以及细胞凋亡情况, 探讨胃癌IFN-γ-STAT1分子通路的特点以及在胃癌中发挥的生物学作用.
收集江汉大学附属医院1989-2003年胃腺癌根治性手术切除标本102例. 所有病例术前均未进行放疗和化疗. 胃癌细胞株SGC-7901, 使用含100 g/L小牛血清(Gibcol)的RMPI 1640培养基(Gibcol), 置于37 ℃, 50 mL/L CO2(体积分数)的培养箱中培养, 2-3 d换液1次. 抗STAT1 mAb(P84/P91, C-136, Santa Cruz公司产品)购至北京中山公司, 即用型鼠抗人Caspase-7 mAb(7CSP01, NeoMark公司产品), 即用型鼠抗人p21waf mAb(F-5, sc-6246, Santa Cruz公司产品)和SP法即用型检测试剂盒均购至福州迈新生物公司.
1.2.1 ASON的转染以及药物处理: 使用1000 IU/mL IFN-γ[14](102CY27, PEPROTECH EC)分别处理细胞0.5、3和24 h. 反义寡核苷酸及引物序列由赛百胜生物技术有限公司合成, 使用阳离子脂质体Transfectin(TianGENE)进行转染. 反义寡核苷酸的序列设计以及浓度的使用根据已发表的文献, STAT1反义寡核苷酸(ASON)5'-CCACTGAGACATCCTG CCACC-3', 按照600 nmol/L和800 nmol/L的浓度转染[15]. 将STAT1 ASON与1000 IU/L IFN-γ联合处理细胞24 h; 细胞的转染严格按照说明书操作, 反义寡核苷酸:脂质体约为1:2-3.
1.2.2 RT-PCR检测及图像分析: 用TRIzol (Invitrogen)提取总RNA, 样品纯度和浓度经核酸测定仪测定, A260/280为1.8-2.0. 严格按照RT-PCR试剂盒(TaKaRa)说明书操作进行RT-PCR. 使用Primer 5.0引物设计软件分别设计STAT1、Caspase-7、p21waf和β-actin的上游和下游引物(表1). 目的引物与β-actin用一管法进行PCR. PCR产物经1.5 g/L的琼脂糖凝胶电泳检测, 使用Biostep Photoimpact软件分析各组目的基因与β-actin条带的平均吸光度, 计算两者的比值, 进行相对定量.
| 引物 | 上游 | 下游 | 长度(bp) |
| STAT1 | 5'-CATGCGGTTGAACCCTACA-3' | 5'-TTCTACAGAGCCCACTATCC-3' | 342 |
| Caspase-7 | 5'-ATTTGACAGCCCACTTTAGG-3' | 5'-GCATGATTTCCAGGTCTTTT-3' | 297 |
| p21waf | 5'-GCGACTGTGATGCGCTAATGG-3' | 5'-TAGAAATCTGTCATGCTGGTCTGC-3' | 358 |
| β-actin 1 | 5'-TGCTGTCCCTCTACGCCTCT-3' | 5'-GCTTCTCCTTGATGTCGC-3' | 234 |
1.2.3 免疫组织化学、免疫细胞化学及图像分析: 使用DAB显色, STAT1以癌组织细胞质和/或细胞核内呈棕黄色表达为阳性. Caspase-7和p21waf以癌组织细胞质内呈棕黄色表达为阳性. 染色操作严格按照说明书要求进行. 免疫细胞化学染色结果, 经图像采集, 使用MOTIC图像分析系统测量其平均吸光度.
1.2.4 Hoechest3325染色检测细胞凋亡: 无菌条件下取出细胞爬片并固定后, Hoechest33258孵育15 min, 0.01 mol/L PBS洗5 min×1次. 水溶性封片剂封片, 荧光显微镜紫外光下观察, Hoechest33258染料呈现蓝色荧光. 高倍镜下观察, 凋亡细胞为蓝色亮点, 亮度明显强于未凋亡细胞, 形态学上出现核膜消失、核固缩、核碎裂等特征. 随机数取1000个细胞进行凋亡细胞记数.
统计学处理 全部数据经SPSS12.0统计学软件处理, 相关因素分析采用Spearman等级相关分析, 各组平均光密度值通过t检验分析. P<0.05有统计学意义.
STAT1, p21waf与Caspase-7呈正相关关系(r = 0.32, 0.22, P = 0.001, 0.02). STAT1与p21waf无关(r = 0.03, P = 0.75).
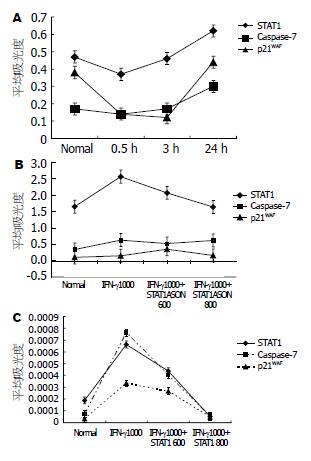
RT-PCR结果显示: IFN-γ刺激SGC7901细胞0.5、3和24 h后STAT1、Caspase-7和p21waf mRNA表达呈先下降后上升的趋势,并于IFN-γ处理24 h时三者表达量达到峰值(P<0.05, 图1A). 免疫细胞化学结果显示: IFN-γ刺激SGC7901细胞24 h后与对照组比较, STAT1蛋白表达明显上调(P = 0.04); Caspase-7与p21waf的表达量较未处理组相应上升(均P = 0.03, 图1C).
RT-PCR结果显示: 使用IFN-γ处理的同时, 使用STAT1反义寡核苷酸600 nmol/L和800 nmol/L浓度抑制STAT1表达, 与IFN-γ组比较, IFN-γ+600 nmol/L组STAT1(P = 0.008)和Caspase-7(P = 0.0002)表达量显著降低, p21waf表达量显著升高(P = 0.002); 与未处理组比较, STAT1(P = 0.003)、Caspase-7(P = 0.0005)和p21waf(P = 0.006)表达量升高(图1B). 与IFN-γ组比较, IFN-γ+800 nmol/L组STAT1 (P = 0.002)表达量显著降低, 而Caspase-7(P = 0.2)和p21waf(P = 0.8)无显著变化. 与未处理组比较, STAT1表达量无显著变化(P = 0.9), Caspase-7(P = 0.0005)和p21waf(P = 0.006)表达量升高(图1B). IFN-γ+600 nmol/L组和IFN-γ+800 nmol/L间STAT1(P = 0.005)、Caspase-7(P<0.0001)和p21waf(P = 0.03)表达有显著性差异(图1B).
免疫细胞化学结果显示: 使用IFN-γ处理的同时, 使用STAT1反义寡核苷酸600 nmol/L和800 nmol/L浓度抑制STAT1表达, 与IFN-γ组比较, IFN-γ+600 nmol/L组STAT1(P = 0.28)、Caspase-7(P = 0.18)和p21waf(P = 0.52)表达量无显著性差异; 与未处理组比较, STAT1(P = 0.18)表达量无显著变化, Caspase-7(P = 0.001)和p21waf(P = 0.002)表达量升高(图1C). 与IFN-γ组比较, IFN-γ+800 nmol/L组STAT1(P = 0.01)、Caspase-7(P = 0.03)和p21waf(P = 0.03)表达量显著降低. 与未处理组比较, STAT1(P = 0.2), Caspase-7(P = 0.4)和p21waf(P = 0.5)表达量无显著变化(图1C). IFN-γ+600 nmol/L组和IFN-γ+800 nmol/L间STAT1(P = 0.04)、Caspase-7(P<0.0001)和p21waf(P = 0.005)表达有显著性差异(图1C).
Hoechest33258染色结果显示, SGC7901胃癌细胞在未处理组、IFN-γ处理组、IFN-γ+STAT1反义寡核苷酸600 nmol/L组、IFN-γ+STAT1反义寡核苷酸800 nmol/L组, 凋亡细胞数无明显变化(P>0.05).
胃癌是全球第二大常见的恶性肿瘤, 是我国最常见的恶性肿瘤之一, 一经发现多为进展期. 迄今, 有关胃癌的发生与发展的机制尚未取得突破性的进展. 信号转导子和转录活化子(signal transducer and activator of transcription, STAT)家族至少包括STAT1(α和β)、2、3、3β、4、5、6和果蝇STAT蛋白[即D-STAT(mrl)]等8个成员. STAT1是该家族的重要成员, 可促肿瘤细胞凋亡[16]. 虽然其机制尚未完全阐明, 但所涉及的主要环节可能是: (1) IFN-γ等信号因子作用于Jak 2等, 使胞质中STAT1激活并形成二聚体, 进入细胞核促进相应靶基因转录, 从而促进细胞凋亡[17]. (2)STAT1直接上调细胞质Caspase-3、7的水平, 诱发细胞凋亡[18]. (3)STAT1促进p21waf表达, 后者与细胞周期调节因子CDK4结合为复合物, 使肿瘤细胞生长停滞, 继而诱发凋亡[19]. 胃癌细胞中STAT1促凋亡及其机制的研究较少. Beppu et al研究发现, IFN-γ可同时促进胃癌细胞系MK-1和GCTM中STAT1(促凋亡)和NF-κB(抑凋亡)表达上调[20], 当IFN-γ和环孢菌素A(CsA, 抑制NF-κB活性)同时使用时, 凋亡明显增加, 继而使用STAT1反义寡核苷酸抑制STAT1活性时, 胃癌细胞系凋亡发生率大大下降. 证实IFN-γ主要通过JAK-STAT1途径促进胃癌凋亡. 但STAT1在胃癌中抑制凋亡的分子通路, 尚未见文献报道.
本研究在人体胃癌组织中发现STAT1与Caspase-7正相关, p21waf与Caspase-7正相关. 提示人胃癌中STAT1的作用机制可能与其他肿瘤一致. 因此, 选用胃癌细胞系SGC7901进一步研究. SGC7901是1981年建立的一株胃癌淋巴结转移癌细胞系, 该细胞系凋亡率低[17].
本研究通过使用IFN-γ处理细胞后, STAT1在mRNA和蛋白水平的表达量均明显升高, 而当同时使用IFN-γ和STAT1反义寡核苷酸作用与细胞时, STAT1表达量出现不同程度的降低, 且下降程度与STAT1反义寡核苷酸的浓度有关. 提示, 本研究中使用IFN-γ和反义寡核苷酸对于细胞的处理是成功的, 同时, IFN-γ-STAT1可促进Caspase-7以及p21waf表达的上调. 在IFN-γ处理不同时间点, 三者mRNA有先下降再上升的趋势未见报道, 其机制有待进一步研究.
当同时使用IFN-γ和STAT1反义寡核苷酸作用与细胞时, Caspase-7以及P21waf的蛋白表达量出现下降的变化, 而且下降程度与STAT1反义寡核苷酸的浓度有关. 该现象与STAT1通过上调Caspase-7和p21waf的表达, 实现促细胞凋亡功能的理论一致.
但在mRNA水平, 两者表达量的变化则与蛋白水平不同步, 出现Caspase-7先下降后上升, p21waf先上升后下降的变化. 该结果提示: STAT1在胃癌中分子通路的调控形式与其他肿瘤不同, 其下游分子(Caspase-7和p21waf)在mRNA水平和蛋白水平表达并不一致, 可能存在其他上游调控基因或在mRNA和蛋白水平之间存在调控, 具体机制有待进一步研究.
本研究中, 使用IFN-γ作用于SGC7901细胞, 细胞凋亡水平无明显变化, 该结果与Beppu et al研究结果一致[20].
传统观念认为STAT1是IFN-γ信号传导途径中及其重要的一环, 几乎所有IFN-γ刺激表达的蛋白均要通过其转录调控实现表达, 但是近期研究发现IFN-γ信号网络非常复杂, 当经典的IFN-γ-JAK2-STAT1通路缺如的情况下, 仍有接近1/3的蛋白被激活表达[21-24]; 同时, IFN-γ在促进STAT1磷酸化时, 也激活了CAMKⅡ(Calcium/Calmaculint Kinase Ⅱ), 3-kinase(PI3-K)/Akt, MAPK(Mitogen Activated Protein Kinase)和PKC(Protein Kinase C)等信号通路分子[25-29], 这些现象及其发挥的作用远非IFN-γ-JAK2-STAT1经典通路可以解释. 本研究发现, 人胃癌中存在IFN-γ-JAK2-STAT1通路; 人胃癌细胞系SGC7901中, IFN-γ可促进STAT1表达继而上调Caspase-7和p21waf表达, 而当STAT1缺如时, 两者在蛋白质和mRNA水平的表达却不一致, 同时IFN-γ-JAK2-STAT1通路对胃癌凋亡无明显调节作用; 提示胃癌细胞中存在IFN-γ-JAK2-STAT1及其通路, 且该通路可被IFN-γ激活但无明显凋亡调节作用, 该通路在胃癌中的作用及其机制尚需进一步研究.
胃癌是一类严重威胁我国人群健康的恶性肿瘤, 其凋亡率较低. 迄今, 有关胃癌低凋亡率的机制尚未取得突破性的研究进展. 干扰素γ(IFN-γ)是Ⅱ型干扰素中的唯一成员, 其可通过STAT1促进肿瘤细胞凋亡. 所涉及的主要环节可能是通过STAT1上调p21waf、Caspase-7等表达, 进而促细胞凋亡. 关于胃癌IFN-γ-STAT1分子通路的特点以及与胃癌凋亡的关系当前研究较少.
龚建平, 教授, 重庆医科大学附属第二医院肝胆外科.
传统观念认为STAT1是IFN-γ信号传导途径中极其重要的一环, 几乎所有IFN-γ刺激表达的蛋白均要通过其转录调控实现表达, 但是近期研究发现当STAT1通路缺如时, 仍有接近1/3的蛋白被激活表达; 同时, IFN-γ在促进STAT1磷酸化时, 也激活了大量其他信号通路分子, 这些现象及其发挥的作用远非IFN-γ-JAK2-STAT1经典通路可以解释. 胃癌中IFN-γ的生物学作用以及其信号通路的特点尚待研究.
本研究证实人胃癌中存在IFN-γ-JAK2-STAT1及其通路, 并可调节其下游凋亡相关调控分子, 但无明显凋亡调节作用, 该结论可望进一步完善当前凋亡调控理论, 并为临床治疗提供新的角度和思考.
转录信号转导子和活化子1(STAT1): 是干扰素γ(IFN-γ)信号传导通路中的重要分子, 参与调节许多正常功能活动, 如: 分化、增殖、生存、凋亡和血管发生等, 在肿瘤中主要发挥促凋亡作用.
本研究着眼于胃癌细胞中STAT1凋亡信号通路的探讨, 重点研究了STAT1与下游因子Caspase-7和p21waf的关系, 以期为阐明胃癌发病机制做基础性研究, 立题较新颖, 理论依据较充分, 目的明确, 结果具有较大实用价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况 分析及其发展趋势预测. 中华肿瘤杂志. 2002;24:101-105. |
| 3. | Lauwers GY, Scott GV, Karpeh MS. Immunohistochemical evaluation of bcl-2 protein expression in gastric adenocarcinomas. Cancer. 1995;75:2209-2213. [PubMed] [DOI] |
| 4. | Klampfer L. The role of signal transducers and activators of transcription in colon cancer. Front Biosci. 2008;13:2888-2899. [PubMed] [DOI] |
| 5. | Klampfer L. Signal transducers and activators of transcription (STATs): Novel targets of chemopreventive and chemotherapeutic drugs. Curr Cancer Drug Targets. 2006;6:107-121. [PubMed] [DOI] |
| 6. | Battle TE, Frank DA. The role of STATs in apoptosis. Curr Mol Med. 2002;2:381-392. [PubMed] [DOI] |
| 7. | Isaacs A, Lindenmann J, Valentine RC. Virus interference. II. Some properties of interferon. Proc R Soc Lond B Biol Sci. 1957;147:268-273. [PubMed] [DOI] |
| 8. | Boehm U, Klamp T, Groot M, Howard JC. Cellular responses to interferon-gamma. Annu Rev Immunol. 1997;15:749-795. [PubMed] [DOI] |
| 9. | Briscoe J, Rogers NC, Witthuhn BA, Watling D, Harpur AG, Wilks AF, Stark GR, Ihle JN, Kerr IM. Kinase-negative mutants of JAK1 can sustain interferon-gamma-inducible gene expression but not an antiviral state. EMBO J. 1996;15:799-809. [PubMed] |
| 10. | Wen Z, Zhong Z, Darnell JE Jr. Maximal activation of transcription by Stat1 and Stat3 requires both tyrosine and serine phosphorylation. Cell. 1995;82:241-250. [PubMed] [DOI] |
| 11. | Decker T, Kovarik P, Meinke A. GAS elements: a few nucleotides with a major impact on cytokine-induced gene expression. J Interferon Cytokine Res. 1997;17:121-134. [PubMed] [DOI] |
| 12. | Huang YQ, Li JJ, Karpatkin S. Thrombin inhibits tumor cell growth in association with up-regulation of p21(waf/cip1) and caspases via a p53-independent, STAT-1-dependent pathway. J Biol Chem. 2000;275:6462-6468. [PubMed] [DOI] |
| 13. | Sironi JJ, Ouchi T. STAT1-induced apoptosis is mediated by caspases 2, 3, and 7. J Biol Chem. 2004;279:4066-4074. [PubMed] [DOI] |
| 15. | Beppu K, Morisaki T, Matsunaga H, Uchiyama A, Ihara E, Hirano K, Kanaide H, Tanaka M, Katano M. Inhibition of interferon-gamma-activated nuclear factor-kappa B by cyclosporin A: A possible mechanism for synergistic induction of apoptosis by interferon-gamma and cyclosporin A in gastric carcinoma cells. Biochem Biophys Res Commun. 2003;305:797-805. [PubMed] [DOI] |
| 16. | Olie RA, Simões-Wüst AP, Baumann B, Leech SH, Fabbro D, Stahel RA, Zangemeister-Wittke U. A novel antisense oligonucleotide targeting survivin expression induces apoptosis and sensitizes lung cancer cells to chemotherapy. Cancer Res. 2000;60:2805-2809. [PubMed] |
| 18. | Leonard WJ, O'Shea JJ. Jaks and STATs: biological implications. Annu Rev Immunol. 1998;16:293-322. [PubMed] [DOI] |
| 19. | Li F, Ambrosini G, Chu EY, Plescia J, Tognin S, Marchisio PC, Altieri DC. Control of apoptosis and mitotic spindle checkpoint by survivin. Nature. 1998;396:580-584. [PubMed] [DOI] |
| 20. | Reed JC, Bischoff JR. BIRinging chromosomes through cell division--and survivin' the experience. Cell. 2000;102:545-548. [PubMed] [DOI] |
| 21. | Gil MP, Bohn E, O'Guin AK, Ramana CV, Levine B, Stark GR, Virgin HW, Schreiber RD. Biologic consequences of Stat1-independent IFN signaling. Proc Natl Acad Sci USA. 2001;98:6680-6685. [PubMed] [DOI] |
| 22. | Shresta S, Sharar KL, Prigozhin DM, Snider HM, Beatty PR, Harris E. Critical roles for both STAT1-dependent and STAT1-independent pathways in the control of primary dengue virus infection in mice. J Immunol. 2005;175:3946-3954. [PubMed] [DOI] |
| 23. | Malmgaard L, Salazar-Mather TP, Lewis CA, Biron CA. Promotion of alpha/beta interferon induction during in vivo viral infection through alpha/beta interferon receptor/STAT1 system-dependent and -independent pathways. J Virol. 2002;76:4520-4525. [PubMed] [DOI] |
| 24. | Ramana CV, Gil MP, Schreiber RD, Stark GR. Stat1-dependent and -independent pathways in IFN-gamma-dependent signaling. Trends Immunol. 2002;23:96-101. [PubMed] [DOI] |
| 25. | Varinou L, Ramsauer K, Karaghiosoff M, Kolbe T, Pfeffer K, Muller M, Decker T. Phosphorylation of the Stat1 transactivation domain is required for full-fledged IFN-gamma-dependent innate immunity. Immunity. 2003;19:793-802. [PubMed] [DOI] |
| 26. | Choudhury GG. A linear signal transduction pathway involving phosphatidylinositol 3-kinase, protein kinase Cepsilon, and MAPK in mesangial cells regulates interferon-gamma-induced STAT1alpha transcriptional activation. J Biol Chem. 2004;279:27399-27409. [PubMed] [DOI] |
| 27. | Deb A, Haque SJ, Mogensen T, Silverman RH, Williams BR. RNA-dependent protein kinase PKR is required for activation of NF-kappa B by IFN-gamma in a STAT1-independent pathway. J Immunol. 2001;166:6170-6180. [PubMed] |
| 28. | Nair JS, DaFonseca CJ, Tjernberg A, Sun W, Darnell JE Jr, Chait BT, Zhang JJ. Requirement of Ca2+ and CaMKII for Stat1 Ser-727 phosphorylation in response to IFN-gamma. Proc Natl Acad Sci USA. 2002;99:5971-5976. [PubMed] [DOI] |