修回日期: 2009-03-10
接受日期: 2009-03-23
在线出版日期: 2009-04-18
目的: 构建Survivin启动子介导自杀基因胞嘧啶脱氨酶(CD)与Survivin Cys84Ala突变体(SurMut)融合基因的重组腺相关病毒质粒(pAM/SurP-CDglySurMut), 探讨其在肿瘤细胞中有效表达融合基因的能力.
方法: PCR扩增E.coli CD基因和带有甘氨酸(gly)连接体的Survivin突变体片段, 亚克隆至具有Survivin启动子的腺相关病毒载体pAM/SurP, 获得重组表达载体pAM/SurP-CDglySurMut. 重组载体瞬时转染胃癌细胞, Western blot检测融合蛋白的表达.
结果: 经PCR扩增成功克隆E.coli CD基因和带有gly连接体的Survivin突变体片段. 重组阳性克隆经限制性酶切鉴定和基因测序, 证实目的基因CDglySurMut已正确插入pAM/SurP载体中. Western blot证实Survivin启动子能够驱动CDglySurMut融合基因在胃癌细胞中表达.
结论: pAM/SurP-CDglySurMut载体能够在肿瘤细胞中表达融合蛋白, 为进一步探讨其靶向治疗肿瘤奠定了实验基础.
引文著录: 孙萍胡, 吴云林, 董文杰, 乔敏敏, 朱黎明, 涂水平. Survivin启动子介导自杀基因与突变体融合基因真核表达载体的构建. 世界华人消化杂志 2009; 17(11): 1085-1090
Revised: March 10, 2009
Accepted: March 23, 2009
Published online: April 18, 2009
AIM: To construct a recombinant survivin promoter (SurP)-mediated adeno-associated virus expression vector carrying a fusion gene constituted with cytosine deaminase (CD) gene and glycin-linked survivin mutant (glySurMut), and to examine the expression of CDglySurMut fusion protein in cancer cells transfected with this vector.
METHODS: The CD gene and glySurMut fragments were amplified by polymerase chain reaction (PCR), and cloned into the adeno-associated virus expression vector PAM with survivin promoter (PAM/SurP). The recombinant vector was transformed into E.coli DH5α. and the positive clones were selected. The plasmid DNA was identified using restriction enzyme analysis and sequencing. The recombinant vector pAM/SurP-CDglySurMut was transfected into gastric cancer cells MKN45. The expression of fusion protein in cancer cells was detected using Western blot.
RESULTS: The CD gene and glySurMut were cloned from E.coli and gastric cancer cells, respectively. The restrictive enzyme analysis and sequencing showed that the fusion gene of CD and glySurMut was successfully inserted into the PAM/SurP vector. Western blot showed that the recombinant vector expressed the CDglySurMut fusion protein in gastric cancer cells.
CONCLUSION: Our results show the pAM/SurP-CDglySurMut vector can efficiently express the recombinant CDglySurMut fusion protein in gastric cancer cells, thus provides experiment evidence for targeting cancer gene therapy using this pAM/SurP-CDglySurMut vector.
- Citation: Sun PH, Wu YL, Dong WJ, Qiao MM, Zhu LM, Tu SP. Construction of a survivin promoter-mediated adeno-associated virus expression vector carrying a fusion gene constituted with cytosine deaminase and survivin mutant. Shijie Huaren Xiaohua Zazhi 2009; 17(11): 1085-1090
- URL: https://www.wjgnet.com/1009-3079/full/v17/i11/1085.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i11.1085
Survivin是凋亡抑制蛋白(inhibitor of apoptosis, IAP)家族的成员, 他在成熟的高度分化的组织(除胸腺、造血干细胞、分泌期子宫内膜等)中不表达[1], 而在大多数恶性肿瘤中特异性高表达[2]. 而Survivin突变体(Cys84Ala)可以通过和有丝分裂器结合, 替代野生型生存素结合到聚合微管, 引起细胞凋亡和有丝分裂障碍[3]. 近年来研究发现Survivin启动子在肿瘤细胞和组织中具有较强的转录活性, 其介导目的基因能特异性表达于各种肿瘤细胞, 而不表达于正常分化细胞和静止的血管内皮细胞, 具有高度的肿瘤组织特异性[4-5].
我们先前研究结果证明, 腺相关病毒(adeno-associated virus, AAV)载体介导Survivin突变体能够诱导肿瘤细胞和肿瘤血管内皮细胞凋亡, 抑制肿瘤血管生成. 然而, 我们也发现, 单独应用Survivin突变体基因治疗虽能抑制结肠癌裸鼠移植瘤的生长, 但是并没能完全消退肿瘤; 而与化疗药物5-氟尿嘧啶(5-FU)联合应用, 获得了肿瘤的完全消退, 显著延长了动物的生存期[6]. 由于CAG启动子缺乏肿瘤靶向特异性, 5-FU又是系统给药, 不良反应大, 这些缺点将限制其今后的临床应用.
自杀基因胞嘧啶脱氨酶(cytosine deaminase, CD)能够自体内将无活性前药5-氟胞嘧啶(5-FC)代谢为有毒性产物5-FU[7]. 将CD基因靶向性表达于肿瘤组织, 使5-FC只在肿瘤组织中转化成5-FU, 从而可以显著提高5-FU的治疗效果, 减轻不良反应. 结合Survivin启动子高度的肿瘤组织和肿瘤血管的靶向特异性, 因而利用Survivin启动子介导的CD基因治疗, 能更特异性地诱导肿瘤组织细胞和肿瘤血管内皮细胞死亡(凋亡), 实现诱导凋亡和抗肿瘤血管生成的双重治疗, 从而显著提高治疗效果,降低不良反应. 本研究将首先构建Survivin启动子介导的含CD和Survivin突变体(Cys84Ala)的融合基因的真核表达载体, 验证重组载体在肿瘤细胞中有效表达融合蛋白, 为进一步研究Survivin启动子介导融合基因靶向治疗肿瘤奠定基础.
质粒pcDNA3-SurMut(pcDNA3-survivin-mutant Cys84Ala), pAM/SurP-EGFP(Survivin启动子介导的EGFP的腺相关病毒载体)由本课题组前期实验构建所保存[8]. JM109和E.coli DH5α感受态菌购自上海生工. 胎牛血清、DMEM培养基购自Gibco公司. DL2000 Marker、 限制性内切酶KpnⅠ、EcoRⅠ、BamHⅠ和XhoⅠ、T4 DNA连接酶、pMD-18T simple vector为宝生物工程(大连)有限公司产品. HotStar Taq PCR MaSterMix、SuperFect_Transfection_Reagent、质粒小量抽提试剂盒、凝胶回收试剂盒购自Qiagen公司. 无内毒素质粒抽提试剂盒为天根生化科技有限公司产品. BCA Protein Assay Kit为Pierce公司产品. Survivin (6E4)鼠抗购自Cell Signaling Technology公司. PVDF膜为Millipore 公司产品. 人胃腺癌低分化细胞株MKN45由本实验室传代培养.
1.2.1 Survivin启动子序列的测定: 以限制性内切酶KpnⅠ和BamHⅠ双酶切pAM/SurP-EGFP质粒, 琼脂糖凝胶回收纯化小片段, 与pMD-18T simple vector载体相连, 转化至感受态E.coli DH5α内. 筛选出阳性克隆, 经invitrogen公司测定, 测序结果与GenBank的Survivin启动子序列对照比较.
1.2.2 E.coli CD目的基因的获得: 以JM109细菌为模板, 据GenBank序列, 设计CD上游引物: 5'-CGGGATCCATGTCGAATAACGCTTTAC-3', 下划线为BamHⅠ酶切位点, 下游引物5'- CCGCTCGAGTCCACGTTTGTAATCGATGGCTT-3', 下划线为酶切位点XhoⅠ, 使扩增出来的CD基因的起始密码子为ATG, 终止密码子TGA改为编码甘氨酸的GGA. 高保真PCR扩增, PCR产物经凝胶电泳回收纯化后连接于pMD-18T simple vector载体, 得到重组质粒pMD18T-CD. 重组质粒转化E.coli DH5α感受态菌, 筛选阳性克隆, 对重组体中CD基因序列测定. 测序结果与GenBank的E.coli CD的cDNA序列对照比较. 小量抽提pMD18T-CD质粒, BamHⅠ/XhoⅠ双酶切, 酶切后分离并纯化小片段.
1.2.3 pMD18T-glySurMut载体的构建和鉴定: 以质粒pcDNA3-SurMut为模板, 应用Premier 5.0软件设计上下游引物, 上游 5'-CCGCTCGAGGGTGGCGGAGG TGGAGGAGGTGGCATGGGTGCCCCGACGTT-3', 下划线为酶切位点XhoⅠ, 下游 5'-CCGGAATTCTCAATCCATGGCAGCCAGCTGCT-3', 下划线为酶切位点EcoRⅠ, PCR扩增出5'端带有8个编码甘氨酸密码子的glySurMut基因. 10 g/L的琼脂糖凝胶电泳回收纯化PCR产物, 与pMD-18T simple vector载体连接, 转化, 挑选阳性克隆, 抽提质粒DNA, 采用双限制性内切酶XhoⅠ和EcoRⅠ酶切电泳、以pMD-18T通用引物DNA测序法对重组质粒进行鉴定. 凝胶回收双酶切后小片段.
1.2.4 pAM/SurP-CDglySurMut重组质粒的构建、克隆及鉴定: 将质粒pAM/SurP-EGFP以XhoⅠ和EcoRⅠ双酶切, 凝胶电泳回收大片段, 得到含有Survivin启动子的pAM/SurP片段, 以T4 DNA ligase连接经相同酶切(XhoⅠ和EcoRⅠ)并纯化的小片段glySurMut, 连接产物转化E.coli DH5α感受态菌, 蓝白筛选白色克隆, 抽提重组质粒pAM/SurP-glySurMut, 再次双酶切(BamH Ⅰ和XhoⅠ), 纯化回收大片的段线性pAM/SurP-glySurMut后连接于经相同酶切的CD基因片段, 转化感受态菌, 挑选阳性克隆并抽提质粒pAM/SurP-CDglySurMut.
采用PCR电泳、酶切电泳法及DNA测序法. CD基因的上游引物: 5'-CGGGATCCATGTCGAATAACGCTTTAC- 3', glySurMut的下游引物: 5'-CCGGAATTCTCAATCCATGGCAGCCAGCTGCT-3'. 重组质粒以BamHⅠ和EcoRⅠ双酶切电泳, 并以相同的酶切pcDNA3空载体, 分别凝胶回收前者的小片段和后者的大片段经T4 DNA连接酶连接, 转化感受态菌, 筛选阳性克隆, 以pcDNA3通用引物测序.
1.2.5 重组质粒pAM/SurP-CDglySurMut瞬时转染胃癌细胞: 人胃腺癌低分化细胞株MKN45在含100 mL/L胎牛血清的DMEM完全培养基中生长, 细胞培养条件为37 ℃, 50 mL/L CO2. 转染前18 h将胃癌细胞以1×105/孔浓度12孔板铺板. 转染时将pAM/SurP-CDglySurMut质粒DNA 1.5 μg和7.5 μL SuperFect® Transfection Reagent混合, 加入400 μL/孔完全培养液, 孵育3 h(按说明书操作). 3 h后洗涤细胞并更换新鲜完全培养液. 37 ℃ 50 mL/L CO2培养48 h. 48 h后收获所有贴壁和不贴壁细胞, 进行Western blot检测.
1.2.6 Western blot检测pAM/SurP-CDglySurMut的表达: 细胞蛋白的抽提采用RIPA裂解液, 浓度测定步骤按照BCA Protein Assay Kit操作说明进行. 取25-30 μg蛋白质, 进行变性聚丙烯酰胺凝胶垂直电泳, 将蛋白质转移至PVDF膜上. 先后用特异性的Survivin一抗和二抗孵育, ECL显影.
2.1.1 Survivin启动子序列的验证: Survivin启动子序列测定结果BLAST后, 证实长度为667 bp的基因序列与GenBank的完全一致.
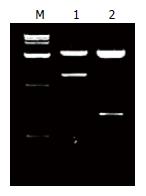
2.1.2 CD基因片段和glySurMut基因片段的扩增及鉴定: CD基因和glySurMut基因PCR产物经10 g/L琼脂糖凝胶电泳鉴定表明, CD基因片段约为1284 bp, glySurMut基因片段约为453 bp, 扩增的片段大小与预期相符(图1). 质粒pMD18T-CD和pMD18T-glySurMut分别双酶切后凝胶电泳各得到两条条带(图2), 其中大小约为1280 bp和450 bp的即为目的条带, 大小约为2700 bp为pMD18T载体. 测序结果示除因实验需要改变的序列外余序列均与GenBank的相符.
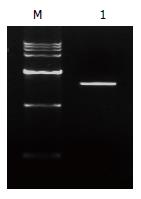
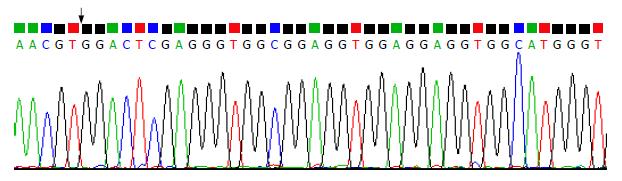
2.1.3 重组质粒pAM/SurP-CDglySurMut的构建及鉴定: 以初步构建的重组质粒pAM/SurP-CDglySurMut为模板, 用扩增CD基因的上游引物和扩glySurMut的下游引物组合起来进行用PCR鉴定CDglySurMut融合基因片段, 能特异地扩增出1.7 kb左右大小的条带(图3), 包含CD、SurMut及连接序列, 符合预期. 双酶切后凝胶电泳得到大小两片段, 其中小片段长约1730 bp(图4), 并且与pcDNA3连接后测序得到的序列为CD和glySurMut的拼接序列(图5), 表明重组质粒pAM/SurP-CDglySurM构建成功.
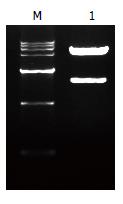
Western blot显示, 瞬时转染了重组质粒pAM/SurP-CDglySurMut的胃癌细胞MKN45, 用Survivin抗体能够检测到两条蛋白条带, 其中在相对分子质量约68 kDa处有特异性蛋白条带, 其大小与CDglySurMut基因产物相吻合; 相对分子质量约为16 kDa处的蛋白条带为内源性Survivin蛋白条带. 而转染pAM/SurP-EGFP质粒的胃癌细胞只呈现16 kDa处的单一条带(图6). 证明Survivin启动子能有效介导CDglySurMut融合基因在肿瘤细胞中表达.
肿瘤基因治疗已经成为当今医学生物学的研究热点之一, 提高肿瘤治疗的靶向特异性, 减少或避免治疗过程中对正常组织细胞的伤害是研究的关键所在.
Survivin基因是在1997年由Ambrosini et al[1]利用效应细胞蛋白酶受体-1(EPR-1)cDNA在人类基因组文库的杂交筛选中首次分离出, 该基因定位于17q25, 含4个外显子和3个内含子, Survivin基因编码产物是由142个氨基酸组成的蛋白, 分子质量为16.2 kDa. Survivin是目前发现特异性最强的凋亡抑制因子, 具有抑制细胞凋亡[9], 促进细胞转化并且参与细胞的有丝分裂[10]、血管的生成[11]和肿瘤细胞耐药性的产生[12]等功能. 近几年开展多种靶向Survivin基因的肿瘤治疗的研究. 已证明Survivin反义核苷酸[13]、显性负突变体[6,14]和siRNAs[15]等能够抑制内源性Survivin的表达和功能, 能够诱导肿瘤细胞凋亡. Grossman et al[14]研究显示Survivin Cys84Ala突变体能够诱导黑色素细胞凋亡, Tu et al[6]采用腺病毒载体介导的Survivin Cys84Ala突变体, 能够显著的诱导结肠癌细胞凋亡和细胞有丝分裂障碍, 并抑制肿瘤的血管生成和肿瘤的生长, 表明Survivin突变体(Cys84Ala)能够有效治疗肿瘤.
肿瘤内新生血管的形成在肿瘤的生长和发展中起着关键作用. 因此, 探讨既能诱导肿瘤细胞凋亡, 又能诱导肿瘤血管内皮细胞凋亡而抑制肿瘤血管的生成的方法, 实行诱导凋亡和抗血管生成的双靶向性治疗, 有望进一步提高肿瘤的治疗疗效. 研究发现Survivin在静息的血管内很少表达, 而在肿瘤的新生血管内大量表达[16], Survivin表达异常增高则促进VEGF诱导的内皮细胞增殖和三维毛细血管网的形成[17]. 进一步研究发现, 由Survivin启动子构建的基因治疗载体不仅具有肿瘤组织细胞和肿瘤内新生血管的靶向特异性, 并且能够有效介导目的基因的表达[5].
临床肿瘤治疗中化疗药物的使用仍是主要的治疗方法, 虽然化疗药物能有效地杀伤肿瘤细胞, 但是有很大的不良反应. 应用基因介导的酶解药物前体疗法(gene-dependent enzyme prodrug therapy, GDEPT)即自杀基因(suicide gene)疗法, 如单纯疱疹病毒Ⅰ型的胸苷激酶基因(HSV1-tk)/更昔洛韦(GCV)系统与胞嘧啶脱氨酶基因(EC-CD)/5-FC系统可明显减少化疗中对正常组织细胞的损害[18]. 新近应用CD自杀基因与其他基因构建的融合蛋白, 如A33scFV-CD、endostatin-CD等研究结果展示了含CD自杀基因的融合基因治疗肿瘤的良好疗效[19-20]. 我们先前的研究已证明, AAV介导Survivin突变体而与化疗药物5-FU联合应用, 显著提高了肿瘤的治疗效果, 显著延长了动物的生存期[6]. 研究构建的Survivin启动子介导的SurMut(Cys84Ala)和CD融合基因的表达载体, 能够在胃癌细胞中表达SurMut(Cys84Ala)和CD基因的融合蛋白, 为进一步研究该重组病毒载体双靶向特异性诱导肿瘤细胞凋亡和抗肿瘤血管生成的基因治疗奠定了实验基础.
肿瘤基因治疗已经成为当今医学生物学的研究热点之一, 提高肿瘤治疗的靶向特异性, 减少或避免治疗过程中对正常组织细胞的伤害是研究的关键所在. 应用肿瘤特异性启动子介导的肿瘤基因治疗, 是提高肿瘤治疗靶向性的有效手段之一.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科.
Survivin是一个具有高度肿瘤特异性的凋亡抑制基因, 其启动子具有较强的肿瘤特异性表达活性. 由Survivin启动子构建的基因治疗载体不仅具有肿瘤组织细胞和肿瘤内新生血管的靶向特异性, 并且能够有效介导目的基因的表达.
Survivin启动子介导的表达载体能在人结肠癌、宫颈癌和非小细胞肺癌等多种肿瘤细胞系中使目的基因Bik突变体有效表达, 而在人正常细胞中不表达或表达量极低.
本研究构建的表达载体不仅具有瘤特异性的Survivin启动子, 并且目的基因为自杀基因CD和Survivin突变体的融合基因, 为进一步研究该重组病毒载体双靶向特异性诱导肿瘤细胞凋亡和抗肿瘤血管生成的基因治疗奠定了实验基础.
本研究构建的载体不仅具有高度的肿瘤组织靶向性, 并且联合自杀基因的功能, 可明显减少化疗中对正常组织细胞的损害.
自杀基因(suicide gene)疗法: 来自原核或低等生物的"自杀"基因编码的酶类, 能使一些药物前体转化而获得对哺乳动物细胞的毒性, 并将这些基因导入肿瘤细胞, 再用相应药物前体, 可使肿瘤细胞因表达此类基因而"自杀".
本研究立题较好, 设计合理, 材料详实, 具有较好的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3:917-921. [PubMed] [DOI] |
| 2. | O'Connor DS, Grossman D, Plescia J, Li F, Zhang H, Villa A, Tognin S, Marchisio PC, Altieri DC. Regulation of apoptosis at cell division by p34cdc2 phosphorylation of survivin. Proc Natl Acad Sci USA. 2000;97:13103-13107. [PubMed] [DOI] |
| 3. | Adida C, Crotty PL, McGrath J, Berrebi D, Diebold J, Altieri DC. Developmentally regulated expression of the novel cancer anti-apoptosis gene survivin in human and mouse differentiation. Am J Pathol. 1998;152:43-49. [PubMed] [DOI] |
| 4. | Bao R, Connolly DC, Murphy M, Green J, Weinstein JK, Pisarcik DA, Hamilton TC. Activation of cancer-specific gene expression by the survivin promoter. J Natl Cancer Inst. 2002;94:522-528. [PubMed] |
| 5. | Chen JS, Liu JC, Shen L, Rau KM, Kuo HP, Li YM, Shi D, Lee YC, Chang KJ, Hung MC. Cancer-specific activation of the survivin promoter and its potential use in gene therapy. Cancer Gene Ther. 2004;11:740-747. [PubMed] [DOI] |
| 6. | Tu SP, Cui JT, Liston P, Huajiang X, Xu R, Lin MC, Zhu YB, Zou B, Ng SS, Jiang SH. Gene therapy for colon cancer by adeno-associated viral vector-mediated transfer of survivin Cys84Ala mutant. Gastroenterology. 2005;128:361-375. [PubMed] [DOI] |
| 7. | Lee KC, Hamstra DA, Bullarayasamudram S, Bhojani MS, Moffat BA, Dornfeld KJ, Ross BD, Rehemtulla A. Fusion of the HSV-1 tegument protein vp22 to cytosine deaminase confers enhanced bystander effect and increased therapeutic benefit. Gene Ther. 2006;13:127-137. [PubMed] [DOI] |
| 8. | Tu SP, Jiang XH, Lin MC, Cui JT, Yang Y, Lum CT, Zou B, Zhu YB, Jiang SH, Wong WM. Suppression of survivin expression inhibits in vivo tumorigenicity and angiogenesis in gastric cancer. Cancer Res. 2003;63:7724-7732. [PubMed] |
| 9. | Deveraux QL, Reed JC. IAP family proteins--suppressors of apoptosis. Genes Dev. 1999;13:239-252. [PubMed] [DOI] |
| 10. | Altieri DC. The case for survivin as a regulator of microtubule dynamics and cell-death decisions. Curr Opin Cell Biol. 2006;18:609-615. [PubMed] [DOI] |
| 11. | Tran J, Rak J, Sheehan C, Saibil SD, LaCasse E, Korneluk RG, Kerbel RS. Marked induction of the IAP family antiapoptotic proteins survivin and XIAP by VEGF in vascular endothelial cells. Biochem Biophys Res Commun. 1999;264:781-788. [PubMed] [DOI] |
| 12. | Giodini A, Kallio MJ, Wall NR, Gorbsky GJ, Tognin S, Marchisio PC, Symons M, Altieri DC. Regulation of microtubule stability and mitotic progression by survivin. Cancer Res. 2002;62:2462-2467. [PubMed] |
| 13. | Du ZX, Zhang HY, Gao da X, Wang HQ, Li YJ, Liu GL. Antisurvivin oligonucleotides inhibit growth and induce apoptosis in human medullary thyroid carcinoma cells. Exp Mol Med. 2006;38:230-240. [PubMed] |
| 14. | Grossman D, McNiff JM, Li F, Altieri DC. Expression and targeting of the apoptosis inhibitor, survivin, in human melanoma. J Invest Dermatol. 1999;113:1076-1081. [PubMed] [DOI] |
| 15. | Carvalho A, Carmena M, Sambade C, Earnshaw WC, Wheatley SP. Survivin is required for stable checkpoint activation in taxol-treated HeLa cells. J Cell Sci. 2003;116:2987-2998. [PubMed] [DOI] |
| 16. | O'Connor DS, Schechner JS, Adida C, Mesri M, Rothermel AL, Li F, Nath AK, Pober JS, Altieri DC. Control of apoptosis during angiogenesis by survivin expression in endothelial cells. Am J Pathol. 2000;156:393-398. [PubMed] |
| 17. | Mesri M, Morales-Ruiz M, Ackermann EJ, Bennett CF, Pober JS, Sessa WC, Altieri DC. Suppression of vascular endothelial growth factor-mediated endothelial cell protection by survivin targeting. Am J Pathol. 2001;158:1757-1765. [PubMed] |
| 18. | Xia K, Liang D, Tang A, Feng Y, Zhang J, Pan Q, Long Z, Dai H, Cai F, Wu L. A novel fusion suicide gene yeast CDglyTK plays a role in radio-gene therapy of nasopharyngeal carcinoma. Cancer Gene Ther. 2004;11:790-796. [PubMed] [DOI] |
| 19. | Deckert PM, Renner C, Cohen LS, Jungbluth A, Ritter G, Bertino JR, Old LJ, Welt S. A33scFv-cytosine deaminase: a recombinant protein construct for antibody-directed enzyme-prodrug therapy. Br J Cancer. 2003;88:937-939. [PubMed] [DOI] |
| 20. | Ou-Yang F, Lan KL, Chen CT, Liu JC, Weng CL, Chou CK, Xie X, Hung JY, Wei Y, Hortobagyi GN. Endostatin- cytosine deaminase fusion protein suppresses tumor growth by targeting neovascular endothelial cells. Cancer Res. 2006;66:378-384. [PubMed] [DOI] |