修回日期: 2008-12-02
接受日期: 2008-12-08
在线出版日期: 2009-01-08
目的: 探讨内质网应激(ERS)在2型糖尿病(T2DM)小鼠脂肪肝发生中的作用机制.
方法: 应用实时定量RT-PCR技术检测T2DM与非糖尿病小鼠肝脏ERS和脂代谢相关基因表达差异, 并进行血生化指标及肝脏形态学检测.
结果: 与同龄非T2DM小鼠相比T2DM小鼠表现为: (1)胰岛素抵抗、空腹血糖升高(30.76±4.52 vs 12.80±2.13, 14.73±2.74 vs4.61±1.12). (2)肝脏TG和FFA水平明显升高(P<0.01); 脂肪肝病变明显. (3)肝脏GRP78、XBP1、CHOP、EDEM1、GSK3β、apoB100、SREBP1c、ACCα及FAS的mRNA水平均显著上调(P<0.05). (4)血清TG、TC、LDL-C、FFA、ALT及AST显著升高(P<0.01). 血清apoB100水平先升高, 后下降(P<0.05).
结论: ERS参与调节肝脏脂质及apoB100的合成与代谢过程, 在T2DM小鼠脂肪肝发生过程中起着重要作用.
引文著录: 毛刘锋, 姜小伟, 秦艳, 董晓光, 李继锋, 周晓莹, 潘杰. 内质网应激对2型糖尿病小鼠脂肪肝发生的影响. 世界华人消化杂志 2009; 17(1): 4-10
Revised: December 2, 2008
Accepted: December 8, 2008
Published online: January 8, 2009
AIM: To investigate the roles of endoplasmic reticulum stress (ERS) in development of liver steatosis.
METHODS: The differential expressions of ERS and lipid metabolism related genes in the liver of T2DM and non-T2DM mice were analyzed using real-time quantitative RT-PCR. Serum total cholesterol (TC), triglyceride (TG), low-density lipoprotein cholesterol (LDL-C), free fatty acid (FFA), alanine amino transferase (ALT) and aspartate amino transferase (AST) levels were determined. The liver TG, FFA content and morphology were also analyzed.
RESULTS: Compared with non-T2DM, T2DM mice had manifestations: (1) Insulin Resistance, increased fasting blood glucose (increased 30.76 ± 4.52 vs 12.80 ± 2.13, 14.73 ± 2.74 vs 4.61 ± 1.12); (2) obviously elevated liver TG and FFA levels (P < 0.01); marked lesion of fatty liver was observed. (3) Up-regulated liver glucose regulated protein 78 (GRP78), X-box binding protein 1 (XBP1), C/EBP homologous protein (CHOP), mannosidase alpha-like 1 (EDEM1), glycogen synthase kinase3β (GSK3β), apolipoprotein100 (apoB100), sterol regulatory element binding proteins1c (SREBP1c), acetyl CoA carboxylase α (ACCα) and fatty acid synthase (FAS) mRNA levels (P < 0.05). (4) Significantly increased serum TG, TC, LDL-C, FFA, ALT and AST (P < 0.01). Serum apoB100 was first increased and then decreased (P < 0.05).
CONCLUSION: ERS plays a central role in the development of liver steatosis in the T2DM mouse through increased lipogenesis and decreased secretion of apoB100.
- Citation: Mao LF, Jiang XW, Qin Y, Dong XG, Li JF, Zhou XY, Pan J. Roles of endoplasmic reticulum stress in liver steatosis of type 2 diabetic mice. Shijie Huaren Xiaohua Zazhi 2009; 17(1): 4-10
- URL: https://www.wjgnet.com/1009-3079/full/v17/i1/4.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i1.4
脂肪肝是2型糖尿病(T2DM)的常见肝脏并发症[1-4], 然而, 其发生发展的分子机制尚未完全明确. 内质网应激(endoplasmic reticulum stress, ERS)是一种由于外界环境刺激而导致的错误折叠与未折叠蛋白质在内质网腔内聚集以及Ca2+平衡紊乱的状态[5-7]. 研究表明ERS在T2DM以及脂肪肝的形成过程中具有重要作用[8-10]. ERS可能通过影响脂代谢相关基因, 如固醇调节元件结合蛋白(SREBP1c)等的表达, 增加肝脏脂肪酸的合成和积聚[11]. 另外, ERS在肝载脂蛋白B100(apoB100)的合成和分泌过程中也具有重要的调节作用, 影响和制约着肝细胞合成和分泌极低密度脂蛋白(very low density lipoprotein, VLDL), 引起肝脏脂质积累[12-13]. 目前对ERS在T2DM脂肪肝发生中的作用机制尚未完全明了. 本实验通过高脂饲料喂养联合链脲佐菌素诱导, 在低密度脂蛋白受体基因突变小鼠的基础上成功建立T2DM模型, 本文针对ERS在T2DM模型小鼠脂肪肝形成中的作用机制进行了探讨.
低密度脂蛋白受体基因突变(LDLR-/-)小鼠(美国Jackson实验室提供), 于SPF级动物房饲养, 室温为20 ℃-22 ℃, 相对湿度为65%-75%, 保持12 h循环照明. 本小鼠实验严格按照山东师范大学动物管理与动物实验的有关管理章程进行, 符合动物实验的伦理要求. ♂小鼠出生后第22天断乳, 随机分为三组: 组1小鼠饲喂高脂饲料(含20%脂肪、20%蔗糖和1.25%胆固醇); 组2、3为对照组小鼠, 饲喂标准饲料(含4%脂肪和0.075%胆固醇); 实验过程中三组小鼠均令其自由进食水. 组1(43只)参照传统的方法[14-15]建立T2DM模型, 小鼠断乳后食用高脂饲料3 wk, 禁食6 h, 一次性ip链脲佐菌素(STZ)(100 mg/kg, Sigma)之后, 继续喂养高脂饲料; 于10周龄时禁食6 h, 测量血糖(GLU)水平, 进行葡萄糖耐量试验, 以确定T2DM建模是否成功. 其中88%(38只)为建模成功小鼠, 简称T2DM小鼠. 组2(38只)小鼠食用标准饲料3 wk后, 采用同样方法注射安慰剂(100 mg/kg, pH4.4的柠檬酸-柠檬酸钠缓冲液), 继续喂养标准饲料, 该组小鼠简称NC小鼠. 组3(38只)小鼠于整个实验中, 持续食用标准饲料, 不做任何药物注射, 简称NT小鼠.
1.2.1 胰岛素抵抗指数(IR)及血生化指标: 分别令10、14和18周龄的三组小鼠禁食6 h后, 采集静脉血(n≥10), 采用血糖仪测GLU水平; COD-PAP和GPO-PAP酶学法测定总胆固醇(TC)、甘油三脂(TG)、低密度脂蛋白胆固醇(LDL-C)含量; 免疫比浊法测定血清apoB100; 速率法测定丙氨酸氨基转移酶(ALT)以及天门冬氨酸氨基转移酶(AST)含量; 放免法测定胰岛素(INS)水平; 酶比色法测定游离脂肪酸(FFA)含量. 用稳态模式评估法(HOMA)[16]中的HOMA-IR公式计算IR指数, 即HOMA-IR = (GLU×INS)/22.5.
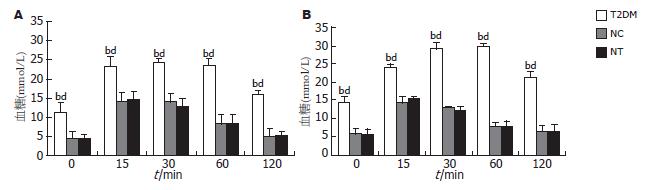
1.2.2 葡萄糖耐量试验: 参照Nakatani et al[17]的方法, 三组小鼠分别于10和18周龄时禁食6 h后, ip 200 g/L葡萄糖溶液(2 g/kg体质量), 于注射后0、15、30、60及120 min, 测定小鼠GLU水平.
1.2.3 肝脏FFA和TG的测定: 取新鲜肝脏组织, 用9 g/L的生理盐水4℃下制备10%的肝匀浆, 3000 r/min离心15 min后取上清, 分别用酶比色法测定FFA含量, COD-PAP法测定TG含量.
1.2.4 肝组织形态学观察: 取同一部位小鼠肝组织, 40 g/L甲醛溶液中固定48 h后制备冰冻切片, 油红O染色, 苏木精复染, 光镜观察、拍照.
1.2.5 肝组织ERS相关基因mRNA表达的测定: 分别取10和18周龄的组1与组2小鼠肝组织(n≥10), 用TRIzol试剂(BioFlux, Japan)抽提总RNA, DNaseⅠ(TaKaRa, Japan)处理后用M-MLV反转录酶(TaKaRa, Japan)进行反转录. 应用DNA Star 6.0软件, 根据GenBank中小鼠的靶基因序列设计PCR引物(表1). 分别检测上述两组小鼠肝脏葡萄糖调节蛋白78(GRP78)、X盒结合蛋白1(XBP1)、C/EBP同源蛋白(CHOP)、甘露糖苷酶1样蛋白(EDEM1)、糖原合酶激酶(GSK3β)、apoB100、SREBP1c、乙酰辅酶A羧化酶α(ACCα)以及脂肪酸合酶(FAS)的mRNA表达水平. 使用Rotor-Gene 3000 Real-time PCR仪(Corbett Research)及SybergreenⅠ试剂最适条件下扩增目的基因及内参. 将每个目的基因的拷贝数与其相对应的β-肌动蛋白基因的拷贝数相除, 计算出目的基因的相对表达量.
| 基因号 | 基因 | 引物序列(5'-3') | 产物大小(bp) |
| NM007393 | β-肌动蛋白 | CCTCTATGCCAACACAGTGC | 211 |
| GTACTCCTGCTTGCTGATCC | |||
| NM022310 | 葡萄糖调节蛋白 | ATCAGGGCAACCGCATCA | 71 |
| 78(GRP78) | CGCATCGCCAATCAGACG | ||
| NM013842 | X盒结合蛋白 | TGGGCATTCTGGACAAGTT | 124 |
| 1(XBP1) | GAAAGGGAGGCTGGTAAGG | ||
| NM007837 | C/EBP同源蛋白 | CAGCGACAGAGCCAGAATAAC | 148 |
| (CHOP) | ACCGTCTCCAAGGTGAAAGG | ||
| NM138677 | 内质网甘露糖苷酶 | CCAGATGGTTGGCTTGATT | 141 |
| 1样蛋白(EDEM1) | AGAGCTGGACAGAAACTTCG | ||
| NM019827 | 糖原合酶激酶3β | CCATCCTTATCCCTCCACAT | 93 |
| (GSK3β) | CACGGTCTCCAGCATTAGTAT | ||
| NM009693 | 载脂蛋白B100 | TCGAGCACAGATGACCAGAGT | 201 |
| (apoB100) | CTTAGAAGCCTTGGGCACAT | ||
| NM011480 | 固醇调节元件结合 | TGGCTTGGTGATGCTATGTT | 257 |
| 蛋白1c(SREBP1c) | TAAGGGGTTGGGAGTAGAGG | ||
| NM133360 | 乙酰辅酶A羧化酶 | TGGCGTCCGCTCTGTGATA | 140 |
| α(ACCα) | TGGGTGAGATGTGCTGGGTC | ||
| NM007988 | 脂肪酸合酶(FAS) | ACCCAAGCGGTCTGGAAAG | 212 |
| CGGATGCCTCTGAACCACTC |
统计学处理 采用SPSS13.0软件进行统计分析, 所有数据采用mean±SD表示. 组间比较采用独立样本的t检验, 以P<0.05为有统计学上显著差异, P<0.01为有极显著差异.
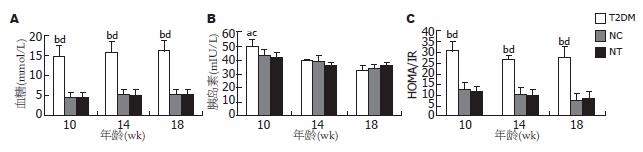
三组小鼠于10周龄时检测血清GLU和INS水平, 并计算IR指数(图1), 进行葡萄糖耐量试验(图2). 结果表明, 组1小鼠中88%表现为GLU升高(组1 vs 组2: 14.73±2.74 vs 4.61±1.12 mmol/L)、葡萄糖耐量异常以及IR加重(组1 vs 组2: 30.76±4.52 vs 12.80±2.13). 因此, 这些小鼠作为T2DM模型用于以下实验. 该组小鼠血清TC、TG、LDL-C和FFA含量于10周龄时较非T2DM(NC和NT)小鼠明显升高, 并持续升高至18周龄(P<0.01, 表2), NC与NT组间无差异. T2DM小鼠血清apoB100含量在10周龄时明显高于同龄非T2DM小鼠(P<0.01), 18周龄时低于非T2DM小鼠(P<0.05). 血清ALT及AST分别从10周龄和14周龄时显著升高(P<0.01, 表2).
| 项目 | 分组 | 年龄(wk) | ||
| 10 | 14 | 18 | ||
| TC(mmol/L) | T2DM | 55.23±4.18bd | 54.73±6.08bd | 59.65±4.73bd |
| NC | 4.32±2.35 | 5.39±0.97 | 5.33±0.49 | |
| NT | 4.43±1.32 | 5.51±1.02 | 5.42±0.85 | |
| TG(mmol/L) | T2DM | 10.97±3.22bd | 11.74±0.37bd | 12.96±1.43bd |
| NC | 1.94±0.12 | 1.65±0.27 | 1.61±0.07 | |
| NT | 1.89±0.26 | 1.70±0.56 | 1.72±0.13 | |
| LDL-C(mmol/L) | T2DM | 47.21±3.90bd | 49.47±6.10bd | 49.81±2.44bd |
| NC | 3.72±0.22 | 3.13±0.54 | 3.24±0.19 | |
| NT | 3.56±1.56 | 3.56±0.54 | 3.35±0.25 | |
| FFA(mmol/L) | T2DM | 9.51±4.04bd | 9.94±1.71bd | 10.92±1.08bd |
| NC | 1.70±0.05 | 1.52±0.15 | 1.32±0.35 | |
| NT | 1.57±0.11 | 1.57±0.23 | 1.42±0.26 | |
| apoB100(g/L) | T2DM | 0.44±0.15bd | 0.22±0.05 | 0.18±0.03ac |
| NC | 0.20±0.01 | 0.20±0.03 | 0.25±0.02 | |
| NT | 0.19±0.01 | 0.21±0.02 | 0.24±0.03 | |
| ALT(IU/L) | T2DM | 87.32±11.08bd | 102.11±12.11bd | 130.21±4.52bd |
| NC | 42.50±3.08 | 46.30±2.05 | 51.51±6.52 | |
| NT | 40.25±3.26 | 45.85±1.26 | 53.56±5.36 | |
| AST(IU/L) | T2DM | 120.11±9.90 | 145.30±5.21bd | 206.50±24.11bd |
| NC | 117.21±11.21 | 102.31±12.41 | 138.30±17.42 | |
| NT | 114.26±8.59 | 110.56±10.26 | 129.59±12.97 | |
与非糖尿病小鼠组(NC和NT)相比, T2DM组小鼠肝脏TG和FFA, 10周龄时明显升高, 持续升高至18周龄(P<0.01, 表3).
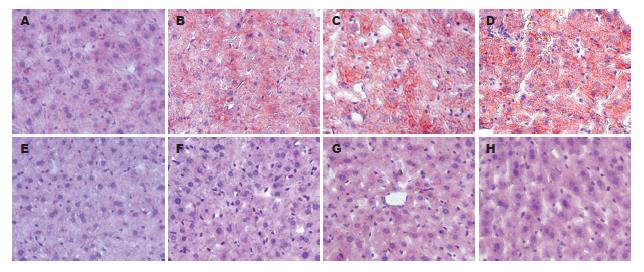
T2DM组小鼠10周龄时肝细胞质内出现大小不等的脂滴, 呈现明显的肝脂肪变性. 14和18周龄时病变加重, 并伴有局部炎症细胞浸润. 各年龄段的NC小鼠肝细胞内均未观察到明显的脂质沉积(图3, 因NC与NT组间无差异, 故省略NT组检测数据, 下同).
与NC小鼠相比, T2DM组小鼠10周龄时肝脏ERS相关因子GRP78、XBP1和CHOP表达水平明显升高, 并持续到18周龄(P<0.05). SREBP1c、ACCα、FAS和apoB100的表达水平在10和18周龄时较NC小鼠明显升高(P<0.01). 然而, T2DM组小鼠apoB100水平在18周龄时较10周龄有所降低. T2DM组小鼠肝脏GSK3β及内质网相关性降解基因EDEM1表达水平在18周龄时, 较NC小鼠显著升高(P<0.05, 表4).
| 基因 | T2DM组 | NC组 | ||
| 10周龄 | 18周龄 | 10周龄 | 18周龄 | |
| GRP78 | (5.17±0.22)E-02b | (5.89±0.34)E-02b | (1.75±0.10)E-02 | (1.44±0.13)E-02 |
| XBP1 | (4.30±0.42)E-01a | (5.50±0.46)E-01a | (3.13±0.12)E-01 | (4.45±0.13)E-01 |
| CHOP | (9.98±0.45)E-03b | (3.71±0.15)E-02b | (3.72±0.22)E-03 | (1.95±0.13)E-02 |
| EDEM1 | (1.10±0.08)E-01 | (2.34±0.10)E-01a | (1.31±0.11)E-01 | (1.87±0.10)E-01 |
| GSK3β | (2.30±0.24)E-02 | (3.53±0.20)E-02a | (2.07±0.22)E-02 | (3.02±0.21)E-02 |
| apoB100 | (4.68±0.31)E-02b | (3.13±0.30)E-02a | (3.33±0.21)E-02 | (2.34±0.12)E-02 |
| SREBP1c | (6.69±0.41)E-02b | (5.94±0.31)E-02b | (3.56±0.32)E-02 | (4.23±0.33)E-02 |
| ACCα | (1.41±0.12)E-02b | (1.48±0.13)E-02b | (8.55±0.32)E-03 | (8.21±0.41)E-03 |
| FAS | (9.26±0.72)E-04b | (1.21±0.13)E-03b | (3.27±0.55)E-04 | (6.39±0.62)E-04 |
研究表明, 高脂饮食喂养的LDLR-/-小鼠容易诱发T2DM和IR[18]. 本实验通过高脂饲料喂养联合STZ诱导, 在LDLR-/-小鼠的基础上成功建立了T2DM模型. 该小鼠模型表现出明显的高GLU和IR, 同时表现出明显的脂肪肝病变. ERS是T2DM在细胞和分子水平的一个重要特征[8,19-20]. 本实验显示T2DM小鼠肝脏ERS相关因子GRP78、XBP1和CHOP的mRNA水平较非T2DM小鼠升高, 且与脂肪肝的病变趋势一致. 这说明ERS在T2DM脂肪肝的形成过程中具有重要的作用.
在脂肪肝的形成和发展过程中常常伴随着肝脏中脂肪酸合成增加及VLDL分泌的减少[13,21-22]. SREBP1可引起与胆固醇/三酰甘油合成和摄取相关基因表达的增加, 导致肝细胞内胆固醇和脂肪酸的积聚[23-25]. 本实验中, T2DM小鼠肝脏SREBP1c较非T2DM小鼠表达增加, 同时脂肪酸合成基因FAS和ACCα的表达也显著增高, 表明肝脏内脂肪酸合成增加. 研究表明同型半胱氨酸诱导产生的ERS可以激活SREBP1的表达进而影响脂质的代谢[26]. 同时ERS可通过JNK(c-JUN NH2 terminal kinase)途径激活GSK3β的表达, 后者在IR及激活SREBP1c表达的过程中具有重要作用[11]. 本实验中T2DM小鼠GSK3β和SREBP1c的表达上调, 表明ERS参与了调控脂代谢相关基因的表达, 增加了肝细胞内脂质的积累.
ApoB100在富含TG的脂蛋白如VLDL的合成和分泌中发挥重要作用. 本实验中18周龄T2DM小鼠肝脏apoB100 mRNA的表达水平较10周龄时降低, 这可能是因为在10周龄时引发的ERS通过上调apoB100的表达来应对肝脏内脂质的积累, 而在18周龄时因为未折叠的apoB100蛋白在内质网内大量积聚, 反馈阻遏了apoB100基因的表达. 关于ERS对apoB100和TG合成和分泌的影响有不同的报道[13,27-29]. 高同型半胱氨酸血症常常伴随着脂肪肝的产生, 然而在小鼠模型中高同型半胱氨酸血症所引发ERS却伴随着TG分泌的增多[27]. 用衣霉素、二硫苏糖醇或葡萄糖胺培养细胞所引发的ERS可以使肝细胞中apoB100分泌减少[28-29]. Ota et al[13]发现用低剂量饱和脂肪酸处理的肝细胞出现ERS相关基因的表达和apoB100分泌增加, 但是随着饱和脂肪酸剂量的增加和处理时间的延长, 肝细胞出现ERS过度反应并伴随apoB100和TG的分泌减少. 本实验显示, 与基因表达水平一致, T2DM小鼠血清apoB100的含量在10周龄时增加, 而在18周龄时显著降低, 表明T2DM小鼠在脂肪肝的形成过程中存在apoB100蛋白合成和分泌的减少, 而ERS在这一过程中具有重要的调节作用.
这种apoB100分泌的减少, 可能是由于非折叠的apoB100蛋白在内质网内大量积聚, 降解增多的结果, 而这是通过ERS所参与的泛素化蛋白质降解途径实现的[12,29]. Qiu et al[29]发现用葡萄糖胺培养肝细胞所引发的apoB100分泌的减少与GRP78的含量呈正相关, 同时可被蛋白酶体抑制剂所阻止, 说明GRP78在内质网质量控制和蛋白酶体降解途径中影响着apoB100非折叠蛋白的降解. EDEM1是一种重要的内质网相关性降解途径的标志分子[30-31]. 本实验中, T2DM小鼠在18周龄时肝脏GRP78和EDEM1 mRNA表达水平均显著增加, 这表明肝脏内质网相关性降解增强, 从而加速内质网内累积的apoB100等非折叠蛋白的降解. 这也说明ERS在降低T2DM小鼠肝脏apoB100和VLDL合成和分泌、增加脂质积累方面具有重要作用, 加速了脂肪肝的形成.
在T2DM发生过程中常常伴随着脂代谢异常及肝细胞内脂质的累积, 从而引发ERS. 本实验中T2DM小鼠肝脏ERS相关及脂肪酸合成基因的表达明显上调. 在T2DM初期ERS通过增加apoB100等的合成和分泌来应对肝脏内不断增加的脂质积累, 从而保护肝脏. 但随着T2DM的发展及肝脏脂质的积累, 将引发ERS过度反应. 同时通过泛素化途径参与的内质网相关性降解[12], 加速内质网内未折叠apoB100蛋白的降解, 导致apoB100水平降低, 加重肝脏脂质的积累.
总之, ERS通过参与调节肝脏脂质及apoB100等的合成与代谢过程, 在T2DM小鼠脂肪肝形成和发展过程中起着重要作用. 因此, 通过调控ERS反应的过程和程度, 可能为治疗T2DM脂肪肝相关疾病提供新的策略.
本实验在山东省动物抗性生物学重点实验室完成. 尹苗副教授和任国诚讲师在实验中给予了指导和帮助, 张晾博士生、曲学彬和王岩硕士生在实验过程中提供了帮助和支持, 在此表示衷心感谢.
脂肪肝是2型糖尿病(T2DM)的常见肝脏并发症. 研究表明内质网应激(ERS)在T2DM和脂肪肝的形成过程中具有重要作用. 然而目前对ERS在T2DM脂肪肝发生中的作用机制尚未完全明了. 本文就ERS在T2DM小鼠脂肪肝形成中的作用机制进行了探讨, 将为T2DM脂肪肝及其相关疾病治疗策略的制定提供有参考价值的实验数据.
曹志成, 英国生物医学科学研究所院士, 伊利沙伯医院临床肿瘤科
目前关于ERS在脂肪肝发生中的作用机制的研究多集中在ERS对体外培养的肝脏细胞apoB100和TG分泌的影响方面, 而针对ERS与T2DM脂肪肝形成和发展相关性的研究报道较少, 具体的内在机制尚不清楚. 肝脏脂质的合成和积累在脂肪肝的形成中具有重要的作用, 而关于ERS对肝脏脂代谢的影响报道也不多见.
Ozcan et al报道ERS在T2DM和脂肪肝的形成过程中具有重要作用, 利用ERS阻遏试剂对改善T2DM小鼠胰岛素抵抗状态及减轻脂肪肝病变具有重要的作用; Ota et al报道用低剂量饱和脂肪酸处理的肝细胞出现ERS相关基因表达和apoB100分泌增加, 但随着饱和脂肪酸剂量的增加和处理时间的延长, 肝细胞出现ERS过度反应并伴随apoB100和TG的分泌减少.
本实验通过高脂饲料喂养联合链脲佐菌素诱导, 成功建立了低密度脂蛋白受体基因突变T2DM小鼠模型. 应用实时定量RT-PCR技术对肝脏ERS及脂代谢相关基因的表达进行分析, 研究了ERS在调节肝脏脂质及apoB100的合成与代谢过程中的作用, 从而探讨了ERS在T2DM小鼠脂肪肝发生中的作用机制.
本研究应用T2DM小鼠模型, 研究了ERS与脂肪肝之间的关系. 研究结果将有助于进一步了解ERS在T2DM脂肪肝形成和发展中的作用机制. 通过调控ERS反应的过程和程度, 将会为T2DM 脂肪肝及其相关疾病提供新的治疗策略.
内质网应激(ERS): 是一种由于外界环境刺激而导致的错误折叠与未折叠蛋白质在内质网腔内聚集以及Ca2+平衡紊乱的状态. 适度的ERS反应有助于保护细胞, 维持生存. 但ERS反应过强则可引起细胞功能障碍, 乃至细胞凋亡, 促进疾病的发生发展.
本文探讨内质网应激对2型糖尿病小鼠脂肪肝发生的影响, 通过调控ERS反应的过程和程度, 可能为治疗T2DM脂肪肝相关疾病提供新的策略.
编辑: 史景红 电编:吴鹏朕
| 1. | Petersen KF, Dufour S, Befroy D, Lehrke M, Hendler RE, Shulman GI. Reversal of nonalcoholic hepatic steatosis, hepatic insulin resistance, and hyperglycemia by moderate weight reduction in patients with type 2 diabetes. Diabetes. 2005;54:603-608. [PubMed] [DOI] |
| 2. | Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002;346:1221-1231. [PubMed] [DOI] |
| 4. | Samuel VT, Liu ZX, Qu X, Elder BD, Bilz S, Befroy D, Romanelli AJ, Shulman GI. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease. J Biol Chem. 2004;279:32345-32353. [PubMed] [DOI] |
| 6. | Lai E, Teodoro T, Volchuk A. Endoplasmic reticulum stress: signaling the unfolded protein response. Physiology (Bethesda). 2007;22:193-201. [PubMed] [DOI] |
| 7. | Araki E, Oyadomari S, Mori M. Endoplasmic reticulum stress and diabetes mellitus. Intern Med. 2003;42:7-14. [PubMed] [DOI] |
| 8. | Ozcan U, Cao Q, Yilmaz E, Lee AH, Iwakoshi NN, Ozdelen E, Tuncman G, Görgün C, Glimcher LH, Hotamisligil GS. Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes. Science. 2004;306:457-461. [PubMed] [DOI] |
| 9. | Ozawa K, Miyazaki M, Matsuhisa M, Takano K, Nakatani Y, Hatazaki M, Tamatani T, Yamagata K, Miyagawa J, Kitao Y. The endoplasmic reticulum chaperone improves insulin resistance in type 2 diabetes. Diabetes. 2005;54:657-663. [PubMed] [DOI] |
| 10. | Ozcan U, Yilmaz E, Ozcan L, Furuhashi M, Vaillancourt E, Smith RO, Görgün CZ, Hotamisligil GS. Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes. Science. 2006;313:1137-1140. [PubMed] [DOI] |
| 11. | Kim AJ, Shi Y, Austin RC, Werstuck GH. Valproate protects cells from ER stress-induced lipid accumulation and apoptosis by inhibiting glycogen synthase kinase-3. J Cell Sci. 2005;118:89-99. [PubMed] [DOI] |
| 12. | Qiu W, Kohen-Avramoglu R, Mhapsekar S, Tsai J, Austin RC, Adeli K. Glucosamine-induced endoplasmic reticulum stress promotes ApoB100 degradation: evidence for Grp78-mediated targeting to proteasomal degradation. Arterioscler Thromb Vasc Biol. 2005;25:571-577. [PubMed] [DOI] |
| 13. | Ota T, Gayet C, Ginsberg HN. Inhibition of apolipoprotein B100 secretion by lipid-induced hepatic endoplasmic reticulum stress in rodents. J Clin Invest. 2008;118:316-332. [PubMed] [DOI] |
| 14. | Sawant SP, Dnyanmote AV, Mitra MS, Chilakapati J, Warbritton A, Latendresse JR, Mehendale HM. Protective effect of type 2 diabetes on acetaminophen-induced hepatotoxicity in male Swiss-Webster mice. J Pharmacol Exp Ther. 2006;316:507-519. [PubMed] [DOI] |
| 15. | Mu J, Woods J, Zhou YP, Roy RS, Li Z, Zycband E, Feng Y, Zhu L, Li C, Howard AD. Chronic inhibition of dipeptidyl peptidase-4 with a sitagliptin analog preserves pancreatic beta-cell mass and function in a rodent model of type 2 diabetes. Diabetes. 2006;55:1695-1704. [PubMed] [DOI] |
| 16. | Bonora E, Formentini G, Calcaterra F, Lombardi S, Marini F, Zenari L, Saggiani F, Poli M, Perbellini S, Raffaelli A. HOMA-estimated insulin resistance is an independent predictor of cardiovascular disease in type 2 diabetic subjects: prospective data from the Verona Diabetes Complications Study. Diabetes Care. 2002;25:1135-1141. [PubMed] [DOI] |
| 17. | Nakatani Y, Kaneto H, Kawamori D, Yoshiuchi K, Hatazaki M, Matsuoka TA, Ozawa K, Ogawa S, Hori M, Yamasaki Y. Involvement of endoplasmic reticulum stress in insulin resistance and diabetes. J Biol Chem. 2005;280:847-851. [PubMed] |
| 18. | Schreyer SA, Vick C, Lystig TC, Mystkowski P, LeBoeuf RC. LDL receptor but not apolipoprotein E deficiency increases diet-induced obesity and diabetes in mice. Am J Physiol Endocrinol Metab. 2002;282:E207-E214. [PubMed] |
| 19. | Michael MD, Kulkarni RN, Postic C, Previs SF, Shulman GI, Magnuson MA, Kahn CR. Loss of insulin signaling in hepatocytes leads to severe insulin resistance and progressive hepatic dysfunction. Mol Cell. 2000;6:87-97. [PubMed] [DOI] |
| 20. | Kaneto H, Matsuoka TA, Nakatani Y, Kawamori D, Miyatsuka T, Matsuhisa M, Yamasaki Y. Oxidative stress, ER stress, and the JNK pathway in type 2 diabetes. J Mol Med. 2005;83:429-439. [PubMed] [DOI] |
| 21. | 陆 金来, 陈 金联, 陈 明祥, 洪 静, 陈 维雄, 朱 金水, 陈 尼维. 肝脏脂肪酸在高脂饮食大鼠非酒精性脂肪性肝病模型中的 代谢. 世界华人消化杂志. 2008;16:1728-1733. [DOI] |
| 22. | Wang D, Wei Y, Pagliassotti MJ. Saturated fatty acids promote endoplasmic reticulum stress and liver injury in rats with hepatic steatosis. Endocrinology. 2006;147:943-951. [PubMed] [DOI] |
| 23. | Yahagi N, Shimano H, Hasty AH, Matsuzaka T, Ide T, Yoshikawa T, Amemiya-Kudo M, Tomita S, Okazaki H, Tamura Y. Absence of sterol regulatory element- binding protein-1 (SREBP-1) ameliorates fatty livers but not obesity or insulin resistance in Lep(ob)/Lep(ob) mice. J Biol Chem. 2002;277:19353-19357. [PubMed] [DOI] |
| 24. | Ahmed MH, Byrne CD. Modulation of sterol regulatory element binding proteins (SREBPs) as potential treatments for non-alcoholic fatty liver disease (NAFLD). Drug Discov Today. 2007;12:740-747. [PubMed] [DOI] |
| 25. | Raghow R, Yellaturu C, Deng X, Park EA, Elam MB. SREBPs: the crossroads of physiological and pathological lipid homeostasis. Trends Endocrinol Metab. 2008;19:65-73. [PubMed] [DOI] |
| 26. | Kokame K, Kato H, Miyata T. Homocysteine-respondent genes in vascular endothelial cells identified by differential display analysis. GRP78/BiP and novel genes. J Biol Chem. 1996;271:29659-29665. [PubMed] [DOI] |
| 27. | Werstuck GH, Lentz SR, Dayal S, Hossain GS, Sood SK, Shi YY, Zhou J, Maeda N, Krisans SK, Malinow MR. Homocysteine-induced endoplasmic reticulum stress causes dysregulation of the cholesterol and triglyceride biosynthetic pathways. J Clin Invest. 2001;107:1263-1273. [PubMed] [DOI] |
| 28. | Qiu W, Kohen-Avramoglu R, Rashid-Kolvear F, Au CS, Chong TM, Lewis GF, Trinh DK, Austin RC, Urade R, Adeli K. Overexpression of the endoplasmic reticulum 60 protein ER-60 downregulates apoB100 secretion by inducing its intracellular degradation via a nonproteasomal pathway: evidence for an ER-60-mediated and pCMB-sensitive intracellular degradative pathway. Biochemistry. 2004;43:4819-4831. [PubMed] [DOI] |
| 29. | Qiu W, Avramoglu RK, Rutledge AC, Tsai J, Adeli K. Mechanisms of glucosamine-induced suppression of the hepatic assembly and secretion of apolipoprotein B-100-containing lipoproteins. J Lipid Res. 2006;47:1749-1761. [PubMed] [DOI] |
| 30. | Sundar Rajan S, Srinivasan V, Balasubramanyam M, Tatu U. Endoplasmic reticulum (ER) stress & diabetes. Indian J Med Res. 2007;125:411-424. [PubMed] |
| 31. | Marciniak SJ, Ron D. Endoplasmic reticulum stress signaling in disease. Physiol Rev. 2006;86:1133-1149. [PubMed] [DOI] |