修回日期: 2008-12-05
接受日期: 2008-12-15
在线出版日期: 2009-01-08
目的: 探讨植物药洪天肝康防治肝硬化的作用机制.
方法: 采用200 mL/L CCl4腹腔注射制备小鼠肝硬化模型(模型组), 于模型制备的同时, 给予洪天肝康灌服(预防组). 造模150 d后添加洪天肝康灌服(治疗组). 取各组的肝、脾组织, 采用HE染色观察肝硬化程度及肝、脾组织的形态学变化; 免疫组织化学方法标记TGF-β1、IFN-γ、IgG和CD3, 并用图像分析仪进行定量分析.
结果: 模型组小鼠的肝脏及脾脏TGF-β1的表达较对照组明显增高, 预防组及治疗组肝脏与脾脏中TGF-β1的表达均较模型组减少(F = 80.155, 120.850; 均P<0.05); IFN-γ和IgG在肝脏及脾脏的表达以治疗组最为明显, 预防组次之, 模型组极少出现(F = 53.584, 118.240, 85.075, 105.566, 均P<0.05); 预防组及治疗组CD3在肝脏及脾脏的表达明显增高, 与模型组相比有统计学意义(F = 42.969, 69.775, 均P<0.05).
结论: 植物药洪天肝康对肝硬化模型小鼠机体进行动态平衡的整体调节后, 可增强机体的免疫防御功能, 从有效控制肝纤维化产生的角度, 有效地防治肝硬化.
引文著录: 洪艳, 杨锐华, 许晴, 贾洪章, 史小林. 植物药洪天肝康防治肝硬化的作用机制. 世界华人消化杂志 2009; 17(1): 17-23
Revised: December 5, 2008
Accepted: December 15, 2008
Published online: January 8, 2009
AIM: To investigate the mechanism underlying preventing and treating hepatic cirrhosis with Hong Tian Gan Kang (HTGK) in mice.
METHODS: Sixty mice were divided randomly into 4 groups: normal control group, model control group, prevention group and treatment group. Except the mice in normal control group, all mice were given injection of CCl4 into abdominal cavity that had been proved to induce experimental hepatic cirrhosis. In prevention group, mice were also given HTGK simultaneously by intragastric administration for 180 days, whereas mice in treatment group were given HTGK 150 days after modeling. Liver tissue and spleen tissue were made into sections stained with HE to evaluate the extent of liver cirrhosis and morphologic changes and to detect the expression of TGF-β1, IFN-γ, IgG, CD3 using immunohistochemistry.
RESULTS: Expression level of TGF-β1 in liver and spleen was markedly higher in model group than in control, prevention and treatment groups (F = 80.155, 120.850, both P < 0.05). The expression of IFN-γ and IgG was most obvious in treatment group, second in prevention group and least in model group (F = 53.584, 118.240, 85.075, 105.566, all P < 0.05). Compared with model group, expression levels of CD3 in prevention and treatment groups were significantly increased (F = 42.969, 69.775, both P < 0.05).
CONCLUSION: HTGK can improve the function of immune system so that it can prevent and cure hepatic cirrhosis effectively.
- Citation: Hong Y, Yang RH, Xu Q, Jia HZ, Shi XL. Prevention and treatment of hepatic cirrhosis with herbal medicine Hongtian Gankang. Shijie Huaren Xiaohua Zazhi 2009; 17(1): 17-23
- URL: https://www.wjgnet.com/1009-3079/full/v17/i1/17.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i1.17
转化生长因子β1(transforming growth factor-β1, TGF-β1)是组织纤维化的促进因子, 近年的研究表明TGF-β1还是重要的免疫抑制因子. γ干扰素(interferon gamma, IFN-γ)是肝纤维化的主要抑制因子, 同时也是重要的免疫调节因子. 目前认为肝纤维化的形成与机体免疫功能间有密切的相关性. 我们将应用免疫组织化学方法, 对正常小鼠、肝硬化小鼠及应用植物药洪天肝康(Hong Tian Gan Kang, HTGK)预防与治疗小鼠肝硬化的各实验组进行肝和脾组织中TGF-β1、IFN-γ、免疫球蛋白G(immunoglobulin G, IgG)、细胞分化抗原3(cell differentiation antigen 3, CD3)的标记, 旨在探讨HTGK以增强机体免疫系统功能的角度, 达到抗肝硬化的作用机制, 实验结果将为植物药的临床应用提供有意义的实验依据.
成年ICR小鼠100只, 体质量20-30 g, 购于首都医科大学实验动物部, 标准饲料, 自由饮水. 但造模过程中共有22只小鼠死亡, 故本实验只选取60只小鼠, 随机分成4组, 对照组(5只)、模型组(20只)、预防组(20只)及治疗组(15只). 200 mL/L CCl4橄榄油溶液, HTGK是应用现代工艺提取黄芪、半枝莲、白芍等纯植物原料中的皂甙、黄酮等有效活性成分, 应用益气解毒, 扶正祛邪的中医理论维持机体的动态平衡, 最终达到防治肝硬化的目的. 兔抗鼠TGF-β1抗血清、兔抗鼠IFN-γ和兔抗鼠CD3抗血清由武汉博士德生物工程有限公司提供. 兔抗人IgG抗血清及生物素抗兔IgG及SP复合物由北京中杉金桥生物工程有限公司提供.
1.2.1 给药及造模: 模型组小鼠按0.01 mL/kg ip 200 mL/L CCl4橄榄油溶液, 5 d 1次, 预防组在ip 200 mL/L CCl4橄榄油溶液的同时灌服HTGK每天2次, 每次0.02 mg, 治疗组于模型组ip橄榄油溶液150 d后开始灌服HTGK, 同时继续给予ip CCl4, 剂量同预防组, 对照组于同一时间灌服等量蒸馏水.
1.2.2 取材及标本制作: 模型组、预防组于造模第60、120、150、180 d, 治疗组于治疗30、60、90 d分别处死小鼠(各时间点5只), 对照组与模型组相同时间处死, 每次1只, 取肝、脾组织, Bouin液固定, 常规石蜡包埋, 制成4 µm厚的连续间断切片, 每张切片至少贴3个标本. 标本间隔40 µm.
1.2.3 指标观察: HE染色观察肝、脾组织的组织病理学的改变. 应用免疫组织化学SP法标记TGF-β1、IFN-γ、IgG、CD3. 切片常规脱蜡至水, 柠檬酸钠缓冲液热抗原修复, 30 g/L H2O2封闭内源性过氧化物酶, 50 mL/L BSA溶液封闭, 依次滴加兔抗鼠TGF-β1抗血清、IFN-γ和CD3抗血清(工作浓度1:100), 兔抗人IgG抗血清, 生物素抗兔IgG及SP复合物, DAB显色. 阴性对照以PBS代替TGF-β1抗血清.
随机选取第60、120、150、180 d模型组和预防组, 30、60、90 d治疗组小鼠肝脾切片, 各时间点每只动物1张, 对照组每只动物1张, 在40×物镜下, 每个标本随机选取5个视野, 用图像分析系统检测免疫反应阳性细胞的平均吸光度(A).
统计学处理 所得数据用SPSS11.0统计软件进行单因素方差分析及其相关性分析.
2.1.1 肝组织: 对照组结构正常, 肝细胞索沿中央静脉呈放射状排列, 肝细胞质丰富, 核圆形, 蓝染. 模型组60 d, 正常的肝小叶结构消失, 肝血窦不规则狭窄, 肝细胞排列紊乱, 肝细胞变性坏死, 核固缩或溶解. 炎性细胞浸润明显, 纤维组织增生. 随模型时间的延长, 肝脏病变进一步进展, 肝细胞灶性坏死, 纤维组织呈条索样增生, 纤维间隔内可见慢性炎性细胞浸润. 预防组肝细胞空泡变性、坏死, 纤维组织增生较模型组减轻, 仅汇管区有少量的纤维组织增生. 治疗组30 d, 门管区周围肝细胞广泛空泡变性或脂肪变性, 核固缩, 中央静脉周围可见形态趋于正常的肝细胞. 治疗组60 d和90 d, 变性坏死的肝细胞明显减少, 取而代之的是大量形态近似正常的肝细胞, 门管区可见较多纤维组织.
2.1.2 脾组织: 对照组红髓、白髓结构正常, 模型组红髓内可见较多含铁血黄素沉着, 纤维组织明显增生. 白髓内淋巴小结结构不典型, 可见较多变性坏死的淋巴细胞, 预防组病变较模型组明显减轻, 红髓内纤维组织增生程度较轻. 治疗组脾脏淋巴组织增多, 可见淋巴小结和生发中心, 红髓内含铁血黄素及纤维组织均明显减少.
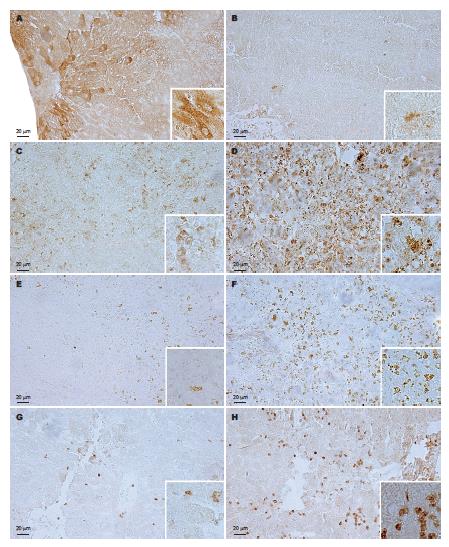
免疫阳性反应物存在于胞质或管腔内, 呈棕黄色或棕褐色颗粒状, 阴性对照未见免疫反应物表达.
2.2.1 各组小鼠TGF-β1免疫反应平均吸光度: 表1显示不同时间段各组小鼠肝脏和脾脏内TGF-β1免疫反应平均吸光度的变化.
| 分组 | 60 d | 120 d | 150 d | 180 d | 治疗30 d | 治疗60 d | 治疗90 d |
| 模型组 | |||||||
| 肝 | 0.24±0.029d | 0.23±0.030d | 0.24±0.032d | 0.25±0.039d | - | - | - |
| 脾 | 0.25±0.027d | 0.31±0.026d | 0.32±0.034d | 0.33±0.028d | - | - | - |
| 预防组 | |||||||
| 肝 | 0.19±0.020a | 0.19±0.020a | 0.19±0.030a | 0.18±0.030a | - | - | - |
| 脾 | 0.23±0.023a | 0.22±0.027a | 0.23±0.026a | 0.20±0.020a | - | - | - |
| 治疗组 | |||||||
| 肝 | - | - | - | - | 0.16±0.028 | 0.15±0.029 | 0.14±0.021 |
| 脾 | - | - | - | - | 0.21±0.021 | 0.21±0.022 | 0.19±0.030 |
| 对照组 | |||||||
| 肝 | 0.14±0.017 | - | - | - | - | - | - |
| 脾 | 0.18±0.021 | - | - | - | - | - | - |
肝脏正常对照组中TGF-β1偶见表达, 模型组TGF-β1阳性细胞数较对照组明显增多, 且主要分布于被膜下、门管区、中央静脉旁等非实质肝细胞内, 少数表达于肝细胞(图1A); 脾脏正常对照组TGF-β1主要表达于淋巴细胞内, 模型组TGF-β1阳性细胞的数量较正常组增多. 肝脏与脾脏预防组及治疗组中TGF-β1阳性细胞的数量均较模型组减少(图1B).
2.2.2 各组小鼠IFN-γ免疫反应平均吸光度: 表2显示不同时间段各组小鼠肝脏和脾脏内IFN-γ免疫反应平均吸光度的变化.
| 分组 | 60 d | 120 d | 150 d | 180 d | 治疗30 d | 治疗60 d | 治疗90 d |
| 模型组 | |||||||
| 肝 | 0.20±0.017a | 0.21±0.023a | 0.20±0.020a | 0.21±0.024a | - | - | - |
| 脾 | 0.22±0.021a | 0.23±0.023a | 0.17±0.030a | 0.18±0.022a | - | - | - |
| 预防组 | |||||||
| 肝 | 0.23±0.002 | 0.25±0.032 | 0.24±0.031 | 0.24±0.024 | - | - | - |
| 脾 | 0.23±0.025 | 0.29±0.033 | 0.31±0.035 | 0.32±0.032 | |||
| 治疗组 | |||||||
| 肝 | - | - | - | - | 0.24±0.019 | 0.26±0.026 | 0.26±0.026 |
| 脾 | - | - | - | - | 0.23±0.029 | 0.31±0.031 | 0.31±0.032 |
| 对照组 | |||||||
| 肝 | 0.17±0.019 | - | - | - | - | - | - |
| 脾 | 0.30±0.028 | - | - | - | - | - | - |
肝脏对照组IFN-γ在细胞内有少量表达; 模型组IFN-γ表达较对照组增多, 主要分布于肝小叶周边及门管区的间质细胞内, 少量分布于肝细胞, 治疗组IFN-γ阳性细胞明显增多, 除门管区间质细胞, 肝细胞内也有较多表达. 预防组各时间点IFN-γ的表达未见明显增高. 脾脏对照组IFN-γ主要表达于淋巴细胞及NK细胞, 数量较多. 模型组各时间点IFN-γ的表达均明显降低(图1C), 预防组60 d及治疗组30 d IFN-γ的表达与模型组相似, 但随时间延长, 两组IFN-γ的表达均显著增高(图1D).
2.2.3 各组小鼠IgG免疫反应平均吸光度: 表3显示不同时间段各组小鼠肝脏和脾脏内IFN-γ免疫反应平均吸光度的变化.
| 分组 | 60 d | 120 d | 150 d | 180 d | 治疗30 d | 治疗60 d | 治疗90 d |
| 模型组 | |||||||
| 肝 | 0.14±0.028a | 0.15±0.028a | 0.14±0.023a | 0.15±0.025a | - | - | - |
| 脾 | 0.16±0.025a | 0.15±0.027a | 0.15±0.025a | 0.16±0.022a | - | - | - |
| 预防组 | |||||||
| 肝 | 0.15±0.027 | 0.20±0.022 | 0.21±0.028 | 0.22±0.028 | - | - | - |
| 脾 | 0.15±0.021 | 0.18±0.034 | 0.21±0.028 | 0.21±0.028 | - | - | - |
| 治疗组 | |||||||
| 肝 | - | - | - | - | 0.23±0.026c | 0.26±0.031c | 0.26±0.025c |
| 脾 | - | - | - | - | 0.28±0.024c | 0.27±0.028c | 0.25±0.029c |
| 对照组 | |||||||
| 肝 | 0.13±0.031 | - | - | - | - | - | - |
| 脾 | 0.16±0.027 | - | - | - | - | - | - |
肝脏对照组少有IgG的表达, 模型组IgG呈现出弱阳性, 预防组及治疗组IgG的表达增多, 并以治疗组最为明显, 主要分布于肝血窦、小叶间静脉等血管腔内, 还可见少量分布于小叶周边的IgG免疫反应阳性细胞. 脾脏对照组内有较多IgG的表达, 主要出现在脾血窦腔内, 少数定位于浆细胞胞质内, 模型组IgG的表达明显减弱(图1E), 预防组和治疗组则显著增高(图1F), 尤以治疗组为甚.
2.2.4 各组小鼠CD3免疫反应平均吸光度: 表4显示不同时间段各组小鼠肝脏和脾脏内IFN-γ免疫反应平均吸光度的变化.
| 分组 | 60 d | 120 d | 150 d | 180 d | 治疗30 d | 治疗60 d | 治疗90 d |
| 模型组 | |||||||
| 肝 | 0.16±0.017 | 0.18±0.015a | 0.18±0.017a | 0.19±0.021a | - | - | - |
| 脾 | 0.18±0.015 | 0.16±0.015a | 0.16±0.016a | 0.15±0.011a | - | - | - |
| 预防组 | |||||||
| 肝 | 0.21±0.014c | 0.23±0.016c | 0.22±0.034c | 0.24±0.033c | - | - | - |
| 脾 | 0.22±0.017c | 0.24±0.017c | 0.23±0.018c | 0.24±0.031c | - | - | - |
| 治疗组 | |||||||
| 肝 | - | - | - | - | 0.21±0.028c | 0.22±0.020c | 0.23±0.041c |
| 脾 | - | - | - | - | 0.26±0.015c | 0.25±0.018c | 0.26±0.021c |
| 对照组 | |||||||
| 肝 | 0.16±0.020 | - | - | - | - | - | - |
| 脾 | 0.18±0.016 | - | - | - | - | - | - |
肝脏对照组很少有CD3的表达, 模型组CD3的表达增多, 主要分布于小叶周边间质细胞内(图1G). 预防组与治疗组CD3的表达增多明显(图1H), 主要表达于淋巴细胞及间质细胞. 正常脾脏CD3主要表达于淋巴细胞, 模型组CD3阳性细胞较对照组明显减少, 而预防组与治疗组较模型组明显增多.
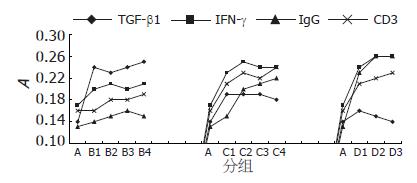
2.2.5 调控因子间的相关性: 各组肝脾组织内TGF-β1的表达均与IFN-γ、IgG及CD3呈负相关关系(P<0.05). 肝脏内IFN-γ与IgG、CD3的表达成正相关关系(P<0.05, 图2).
肝纤维化是多种慢性肝病向肝硬化发展的必经阶段, 主要表现为细胞外基质的过度沉积. 造成肝纤维化形成的因素很多, 至今尚未完全阐明. 有资料表明, 肝纤维化的形成与机体免疫功能间密切相关. TGF-β1是重要的免疫抑制因子, 在脾脏内由Th3细胞分泌, 其作用主要表现在抑制T细胞增殖、抑制NK细胞对激活的肝星状细胞的细胞毒作用, 限制细胞毒性T细胞的反应, 抑制IL-2、IFN-γ的产生等[1-3]. IFN-γ属Th1源性细胞因子, 可通过抑制肝星状细胞的激活和阻断TGF-β1的信号转导, 减少细胞外基质的合成, 抑制肝纤维化[4-6]. 联合应用IFN-γ和血管紧张素转化酶抑制剂几乎可完全阻抑肝纤维化的发展[7].
本实验结果显示, CCl4中毒引起肝纤维化小鼠肝脾组织内TGF-β1的表达均较正常对照组明显增高, IFN-γ在肝脏的表达增高, 在脾脏则表达降低, IgG在肝脏及脾脏的表达均明显减少, CD3在肝脏的表达增加, 脾脏的表达减少. TGF-β1的表达与IFN-γ、IgG呈负相关关系. 肝脏内IFN-γ与IgG、CD3的表达呈正相关. 这与以往的研究结果相似[8], 说明脾脏内Th3细胞增多, 抑制Th1/Th2细胞的活化增生, 从而导致机体免疫功能低下. 提示脾脏可能通过TGF-β1的表达促进肝纤维化的形成; 汪谦 et al研究也表明脾脏在肝硬化过程中促进TGF-β1的表达[9]. IFN-γ在肝脏的表达增高与潘海波 et al[10]的报道一致, 说明由于肝内细胞外基质的沉积增多, 刺激机体促进IFN-γ分泌增多, 从而制衡肝纤维化的发展. IFN-γ在脾脏的表达降低表明Th1细胞因子含量减少, 提示Th2细胞因子优势表达; Th1/Th2细胞及其细胞因子网络的调节对维持机体正常的免疫功能至关重要. Th1细胞主要引起T淋巴细胞介导的细胞毒作用(CTL)和细胞免疫, Th2细胞主要功能为促进体液免疫反应, 研究证实, Th1/Th2细胞能相互拮抗, Th1细胞通过分泌IFN-γ抑制Th2极化, Th2细胞也能通过分泌IL-4限制Th1型反应[11-12]. Th1/Th2细胞的失衡导致细胞免疫功能低下, 促进肝纤维化的形成[13]. Th2细胞因子能增强前胶原1, 3及基质金属蛋白酶2(MMP2)、MMP9和金属蛋白酶组织抑制剂(TIMPs)的基因转录, 进一步促进肝纤维化的发展[14].
中医学是以阴阳五行、脏腑经络理论为构架, 反应人与环境关系的整体论. 即以调整机体的整体状态, 而达到治疗某种疾病的目的. 肝纤维化病机关健为: 湿热疫毒残留难尽是启动因子和持续因素, 正气虚弱是内因和转归, 淤血阻络是病理基础, 肝病传脾是必然演变过程. 因此在肝纤维化的治疗上中医强调"顾正气"和"攻补兼施"[15]. HTGK属纯植物药, 运用益气解毒, 扶正祛邪的中医理论, 以现代工艺提取黄芪、半枝莲、白芍等纯植物原料中的皂甙、黄酮等有效的活性成分, 来维持机体的动态平衡. 本实验结果显示治疗组与预防组肝纤维化程度减轻, 表明HTGK具有明确的抗纤维化作用. 结果证实经HTGK预防和治疗后肝脾组织内TGF-β1的表达明显减少, IFN-γ的表达明显增多, IgG与CD3的表达均明显增高. TGF-β1与IFN-γ、IgG和CD3呈负相关关系, 说明Th1细胞数量增多, Th3细胞数量减少, TGF-β1的免疫抑制作用降低, Th1/Th2细胞的失衡状态得到改善, 细胞免疫和体液免疫功能均明显增强. 提示HTGK抗纤维化作用的机制可能是通过促进IFN-γ的分泌, 抑制TGF-β1的表达, 恢复Th1/Th2细胞因子网络的平衡状态, 从而达到防治肝硬化的目的.
转化生长因子β1是组织纤维化的促进因子, 近年的研究表明TGF-β1还是重要的免疫抑制因子. γ干扰素是肝纤维化的主要抑制因子, 同时也是重要的免疫调节因子. 但有关上述两种细胞因子对肝硬化时免疫功能的影响报道甚少.
唐文富, 副主任医师, 四川大学华西医院中西医结合科
影响肝纤维化形成的因素很多, 至今尚未完全阐明. 目前认为免疫因素在肝纤维化的形成及进展过程中起重要作用, 但其具体机制尚不明确.
Gressner et al研究表明肝纤维化小鼠肝脾组织内TGF-β1的表达均明显增高, IFN-γ在则在肝脏的表达增高, 汪谦et al研究证实脾脏促进了肝硬化的形成, 其主要方式是影响了多种细胞因子的产生, 尤其是促进TGF-β1的表达.
本文的相关工作为免疫因素对肝硬化形成及HTGK对其作用的相关机制研究提供了实验依据和方向, 极具研究价值和前景, 并为肝硬化的预防、治疗提供理论依据.
本文具有较强科学性和可读性, 并创新性的探索中药制剂防治肝硬化的机制, 值得鼓励, 但中医理论和中药方剂的理论与解释稍差.
编辑: 李军亮 电编:何基才
| 1. | Fantini MC, Becker C, Tubbe I, Nikolaev A, Lehr HA, Galle P, Neurath MF. Transforming growth factor beta induced FoxP3+ regulatory T cells suppress Th1 mediated experimental colitis. Gut. 2006;55:671-680. [PubMed] [DOI] |
| 2. | Roncarolo MG, Gregori S, Battaglia M, Bacchetta R, Fleischhauer K, Levings MK. Interleukin-10-secreting type 1 regulatory T cells in rodents and humans. Immunol Rev. 2006;212:28-50. [PubMed] [DOI] |
| 3. | Levings MK, Bacchetta R, Schulz U, Roncarolo MG. The role of IL-10 and TGF-beta in the differentiation and effector function of T regulatory cells. Int Arch Allergy Immunol. 2002;129:263-276. [PubMed] [DOI] |
| 4. | Weng HL, Cai WM, Liu RH. Animal experiment and clinical study of effect of gamma-interferon on hepatic fibrosis. World J Gastroenterol. 2001;7:42-48. [PubMed] |
| 5. | Weng HL, Wang BE, Jia JD, Wu WF, Xian JZ, Mertens PR, Cai WM, Dooley S. Effect of interferon-gamma on hepatic fibrosis in chronic hepatitis B virus infection: a randomized controlled study. Clin Gastroenterol Hepatol. 2005;3:819-828. [PubMed] [DOI] |
| 6. | Song E, Chen J, Wang K, Zhang H, Su F, Wang M, Heemann U. Intrasplenic transplantation of syngenic hepatocytes modified by IFN-gamma gene ameliorates hepatic fibrosis in rats. Transpl Int. 2002;15:472-478. [PubMed] [DOI] |
| 7. | Yoshiji H, Kuriyama S, Noguchi R, Yoshii J, Ikenaka Y, Yanase K, Namisaki T, Kitade M, Yamazaki M, Tsujinoue H. Combination of interferon-beta and angiotensin-converting enzyme inhibitor, perindopril, attenuates the murine liver fibrosis development. Liver Int. 2005;25:153-161. [PubMed] [DOI] |
| 8. | Dong Y, Xi H, Yu Y, Wang Q, Jiang K, Li L. Effects of oxymatrine on the serum levels of T helper cell 1 and 2 cytokines and the expression of the S gene in hepatitis B virus S gene transgenic mice: a study on the anti-hepatitis B virus mechanism of oxymatrine. J Gastroenterol Hepatol. 2002;17:1299-1306. [PubMed] [DOI] |
| 11. | Jiang R, Feng X, Guo Y, Lu Q, Hou J, Luo K, Fu N. T helper cells in patients with chronic hepatitis B virus infection. Chin Med J (Engl). 2002;115:422-424. [PubMed] |
| 12. | Dong C, Flavell RA. Th1 and Th2 cells. Curr Opin Hematol. 2001;8:47-51. [PubMed] [DOI] |
| 13. | Sakaguchi E, Kayano K, Segawa M, Aoyagi M, Sakaida I, Okita K. [Th1/Th2 imbalance in HCV-related liver cirrhosis]. Nippon Rinsho. 2001;59:1259-1263. [PubMed] |
| 14. | Sandler NG, Mentink-Kane MM, Cheever AW, Wynn TA. Global gene expression profiles during acute pathogen-induced pulmonary inflammation reveal divergent roles for Th1 and Th2 responses in tissue repair. J Immunol. 2003;171:3655-3667. [PubMed] |
| 15. | 白 宇宁, 刘 绍能, 姚 乃礼. 中医药抗肝纤维化的研究概况. 中国中医基础医学杂志. 2001;7:74-77. |