修回日期: 2008-02-14
接受日期: 2008-03-08
在线出版日期: 2008-03-28
目的: 探讨Genistein-磁性纳米微粒(Genistein-magnetic-nanoparticles, GEN-M-NPs)对胃癌细胞株SGC-7901生长及凋亡的影响.
方法: 利用化学共沉淀法制备GEN-M-NPs, 透射电镜观察纳米微粒的形态, 高效液相法测定包封率. 以胃癌细胞株SGC-7901为实验对象, 用四甲基偶氮唑蓝(MTT)比色法观察GEN-M-NPs和Genistein对其增殖活性的影响, 采用流式细胞术检测细胞凋亡率, 琼脂糖凝胶电泳观察DNA片段化改变情况.
结果: GEN-M-NPs呈球形, 粒径约105 nm, 分布均匀, 包封率约为10.3%. GEN-M-NPs对SGC-7901细胞生长有明显抑制作用, 且呈剂量和时间依赖性(P<0.05). 与单药Genistein作用组相比, GEN-M-NPs具有缓释性(86.04% vs 67.11%, P<0.05). 流式细胞仪检测不同浓度GEN-M-NPs作用72 h后的细胞凋亡率分别是5.62%±2.04%(10 μmol/L)、13.46%±2.02%(20 μmol/L)、26.40%±3.84%(40 μmol/L)、37.34%±4.68%(80 μmol/L)、49.43%±8.29%(100 μmol/L), 阴性对照组的凋亡率为2.60%±1.34%. DNA凝胶电泳结果显示40 μmol/L组作用24 h可见明显的凋亡细胞形成的梯状条带.
结论: GEN-M-NPs在体外能有效地抑制胃癌细胞增殖并诱导细胞凋亡, 与Genistein相比, 有缓释性.
引文著录: 李东朋, 司华艳, 赵玉元, 张浩力, 廖君左. Genistein-磁性纳米微粒对胃癌细胞株SGC-7901生长及凋亡的影响. 世界华人消化杂志 2008; 16(9): 998-1003
Revised: February 14, 2008
Accepted: March 8, 2008
Published online: March 28, 2008
AIM: To observe the effects of different concentrations of genistein-magnetic-nanoparticles (GEN-M-NPs) on the growth and apoptosis of gastric cancer cell line SGC-7901.
METHODS: GEN-M-NPs were prepared by chemical co-precipitation. Morphology of GEN-M-NPs was observed under a transmission electron microscope. Encapsulating efficiency of genistein was determined by high-performance liquid chromatography. After SGC-7901 cells were treated with various concentrations of GEN-M-NPs and genistein, their anti-tumor effects were determined by methyl thiazolyl tetrazolium (MTT) assay. Apoptosis rate was quantified by flow cytometry and DNA fragmentation was evaluated by agarose gel electrophoresis.
RESULTS: GEN-M-NPs were round or elliptical in shape with a diameter of about 105 nm. Their encapsulating efficiency was about 10.3%. The proliferation of SGC-7901 cells in vitro was significantly inhibited by GEN-M-NPs in a time- and dose-dependent manner (P < 0.05). The release of GEN-M-NPs was slower than that of genistein (86.04% vs 67.11%, P < 0.05). After treatment with various concentrations of GEN-M-NPs for 72 h, the apoptosis rate for GEN-M-NPs and negative control groups was 5.62% ± 2.04% (10 μmol/L), 13.46% ± 2.02% (20 μmol/L), 26.40% ± 3.84% (40 μmol/L), 37.34% ± 4.68%(80 μmol/L), 49.43% ± 8.29% (100 μmol/L), and 2.60% ± 1.34% (control), respectively. Agarose gel electrophoresis showed typical apoptotic DNA ladders 24 h after treatment with 40 μmol/L GEN-M-NPs.
CONCLUSION: GEN-M-NPs can effectively inhibit the growth and apoptosis of SGC-7901 cells.
- Citation: Li DP, Si HY, Zhao YY, Zhang HL, Liao JZ. Effect of genistein-magnetic-nanoparticles on the growth and apoptosis of gastric cancer cell line SGC-7901. Shijie Huaren Xiaohua Zazhi 2008; 16(9): 998-1003
- URL: https://www.wjgnet.com/1009-3079/full/v16/i9/998.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i9.998
胃癌(gastric carcinoma)是严重危害人类健康的最常见的恶性肿瘤之一. 在我国胃癌仍高居各种恶性肿瘤之首, 每年新确诊患者达30多万, 约占全球的1/3; 大约死亡26万/年, 占所有恶性肿瘤死亡的23.24%, 死亡率接近25/10万[1]. 其中进展期胃癌(advanced gastric cancer, AGC)占整个胃癌发病率的60%-80%, 多伴有淋巴、血行及(或)腹膜转移, 或直接浸润扩散. 超过2/3确诊胃癌的患者不可手术切除, 即使可行手术切除其复发率也相当高[2]. 因而化疗就显得格外重要, 但化疗药物面临毒性高、靶向性低、缓解率低窘境, 寻找新的化疗药物一直受人们所关注. 5, 7, 4'-三羟基异黄酮(Genistein)是一种天然的异黄酮类植物雌激素在大豆中广泛存在, 具有很弱的雌激素活性. 大量研究表明Genistein在肿瘤的发生, 发展, 转移阶段存在多重抑制效应, 对多种肿瘤具有化学治疗和化学预防作用[3]. Genistein在体内代谢快、对肿瘤组织缺乏靶向性、不能在局部达到有效的药物浓度、水溶性差等, 极大的限制了其潜在的临床应用前景[4]. 本实验采用纳米技术制备具有靶向性, 缓释性的Genistein-磁性纳米微粒(Genistein-magnetic-nanoparticles, GEN-M-NPs), 体外实验观察其对胃癌细胞的生长和凋亡的影响, 以评价其在胃癌化疗中的应用前景.
Genistein(美国Sigma公司, 纯度≥98%), 小牛血清(杭州四季青公司), RPMI 1640培养基(Gibco公司), 四甲基偶氮唑蓝(MTT)(美国Sigma公司); Annexin V/PI试剂盒(北京博奥森生物技术公司), DNA ladder试剂盒(Oncogene公司). 人胃腺癌细胞株SGC-7901(郑州大学第一附属医院丁月超惠赠)用含100 mL/L的小牛血清的RPMI 1640培养液培养, 生长于37℃、50 mL/L CO2及饱和湿度孵箱中, 待细胞长至单层后, 以2.5 g/L的胰蛋白酶消化贴壁细胞, 选用对数生长期细胞用于实验.
1.2.1 磁性纳米微球的制备及其表征: GEN-M-NPs采用化学共沉淀法自制. 取GEN-M-NPs水溶液滴与铜网支持膜上, 多余液体用滤纸吸去, 以磷钨酸负染法拍透射电镜照片, 观察其形态. 高效液相法测量Genistein的含量, 计算包封率, 激光粒度分析仪分析粒径分布(制作及检测工作在兰州大学功能有机分子化学国家重点实验室完成).
1.2.2 药物溶液制备及细胞分组: 实验设药物组、药物纳米微粒组、空载纳米微粒组和对照组, 实验时各组加入相应的处理液. 药物组的处理液是二甲基亚砜(DMSO)溶解含Genistein的RPMI 1640稀释液(DMSO终浓度小于1 mL/L), 药物纳米微粒组的GEN-M-NPs和空载纳米微粒组的空载磁性纳米微粒是用RPMI 1640溶解的分散液. 阴性对照组用含DMSO的RPMI 1640培养液.
1.2.3 MTT法测定细胞存活率: 选取对数生长期的SGC-7901细胞, 分别以4×103/孔接种于96孔培养板上, 每孔200 μL, 培养24 h待细胞贴壁后更换培养液, 培养液中分别加入相应的处理液. 药物组和药物纳米微粒组按每孔Genistein的终浓度分设5个浓度亚组(10、20、40、80、100 μmol/L), 空载纳米微粒组的每孔磁性纳米微粒含量与100 μmol/L药物纳米微粒组相同, 对照组加入含DMSO的RPMI 1640. 培养24, 48, 72 h后, 每孔加入20 μL(5 g/L)MTT溶液, 继续孵育4 h后, 弃上清, 加入100 μL DMSO终止反应. 微震荡后, 于酶标仪波长490 nm处测得吸光度A值. 实验重复4次. 对照组细胞存活率记为100%, 实验组细胞存活率按公式计算: 细胞存活率 = (实验组A值/对照组A值)×100%, 即吸光值越大, 存活率越高.
1.2.4 细胞生长的形态学观察: 将细胞消化传代接种于6孔培养板上(1×106/孔), 置于饱和湿度、37℃、50 mL/L的CO2孵箱中, 待细胞进入对数生长期后按照对照组与药物纳米微粒组进行药物处理. 加药后于24、48、72 h用相差显微镜观察细胞形态.
1.2.5 流式细胞仪检测细胞凋亡率: 72 h后, 收集不同浓度亚组的药物纳米微粒作用的SGC-7901细胞, PBS洗涤2次后, 加入200 μL的结合缓冲液悬浮细胞, 依次加入10 μL Annexin-FITC和5 μL的PI, 混匀. 室温避光反应15 min, 上流式细胞仪检测各组细胞的凋亡百分率.
1.2.6 琼脂糖凝胶电泳DNA片段检测: 取40 μmol/L GEN-M-NPs作用不同时间点(0、24、48、72 h)的细胞约1×106细胞, 加入DNA提取液, 按照DNA试剂盒说明书提取. 获取沉淀DNA, 分别溶于50 μL重悬缓冲液, 各取10 μL加电泳缓冲液, 同时取DNA标准品分别上样, 于200 g/L琼脂糖凝胶电泳(2 V/cm×2 h)成像.
统计学处理 实验数据均采用mean±SD表示, 采用SPSS12.0统计软件分析结果. 药物组, 药物纳米微粒组与对照组比较, 时间、剂量关系采用析因设计的方差分析, 组间两两比较采用LSD法. 凋亡率的比较先进行数据转换, 让数据变成正态, 再进行单因素方差分析. 以P<0.05表示差异有统计学意义.
透射电镜结果表明所制备的微粒颗粒分布均匀, 平均粒径约105 nm(图1), 根据高效液相法检测结果计算出包封率为10.3%.
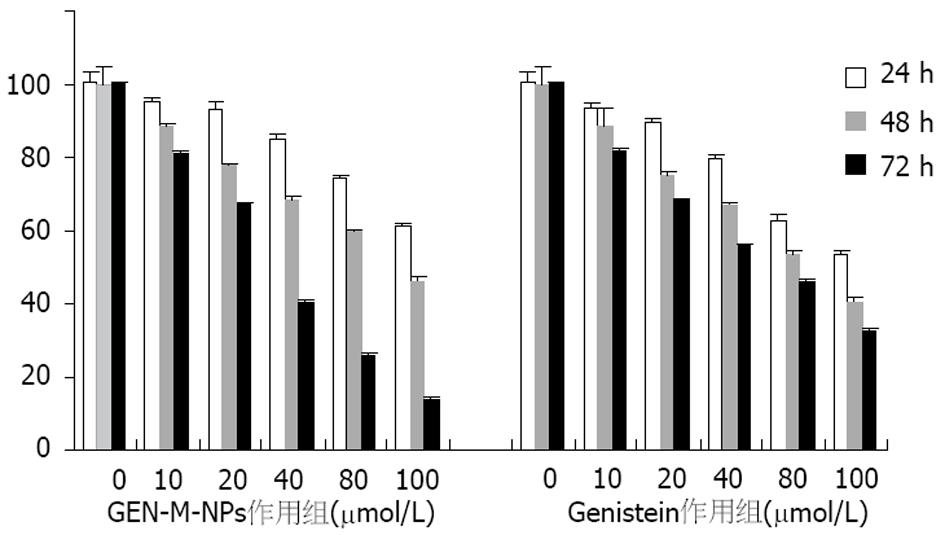
将SGC-7901细胞经不同浓度不同时间处理后, GEN-M-NPs作用组呈现出明显的细胞抑制作用, 且随时间的延长和浓度的增加抑制作用更明显, 药物浓度与作用时间之间有明显的交互作用(P<0.01, 图2). 作用24 h相同浓度下, GEN-M-NPs各浓度组抑制率小于单药Genistein组(P<0.01), 随着时间的延长, 48 h时两者的抑制率逐渐接近; 72 h时GEN-M-NPs最高浓度组的抑制率为86.04%, 原药组为67.11%, 差异具有显著性(t = 46.22, P<0.01). 另外, 空载磁性纳米微粒组对SGC-7901细胞增殖无抑制作用, 与对照组无差异(P>0.05).
形态学观察可见, 对照组SGC-7901细胞生长良好, 呈多角形或梭形贴壁生长, 透明度大, 折光度强. 在GEN-M-NPs作用下, 细胞出现形态变化, 具体表现为细胞间隙增宽, 细胞变圆形, 细胞出现空泡、伪足回缩, 成凋亡征象. 这种变化随时间延长和药物浓度增加而更加显著, 并且漂浮在培养液中的细胞逐渐增多.
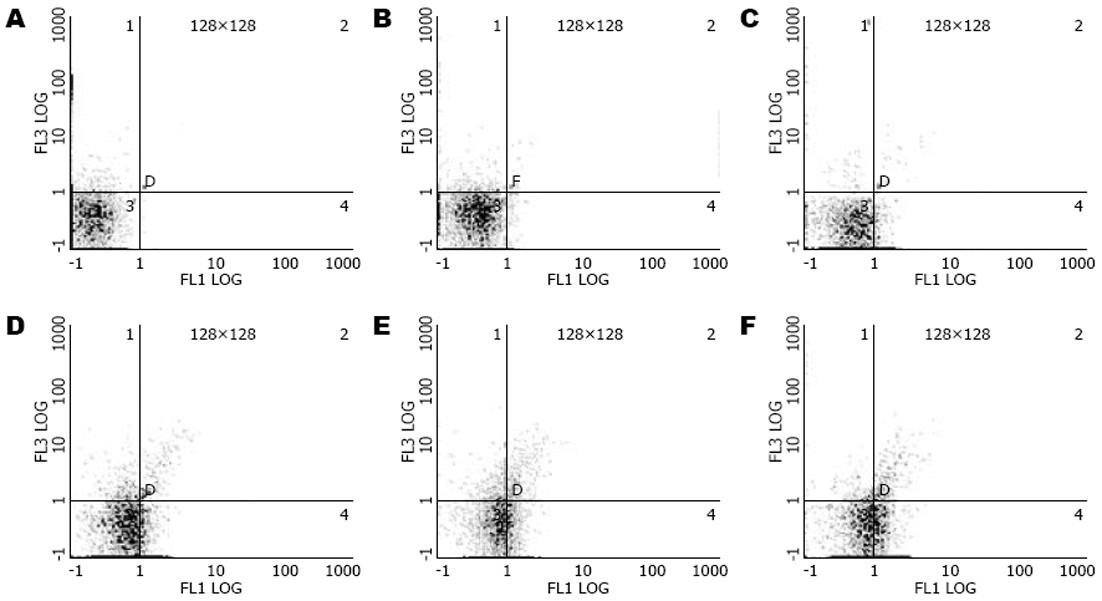
多次检测药物处理后的细胞凋亡率, 10, 20, 40, 80, 100 μmol/L GEN-M-NPs作用72 h后, SGC-7901细胞的凋亡率分别为5.62%±2.04%、13.46%±2.02%、26.40%±3.84%、37.34%±4.68%、49.43%±8.29%, 除10 μmol/L作用组外其余各实验组与阴性对照组2.60%±1.34%相比, 差异具有统计学意义(F = 86.57, P<0.05, 图3).
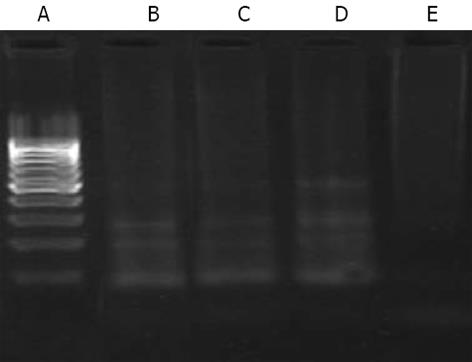
SGC-7901细胞经40 μmol/L GEN-M-NPs作用后, 0时间点组细胞提取的DNA经琼脂糖凝胶电泳后没有条带出现, 24、48、72 h组可见到典型的DNA梯形条带, 作用时间越长, 条带越明显(图4), 提示凋亡随用作用时间而增加.
肿瘤化疗是肿瘤治疗中的一个重要方面. 目前临床使用的抗癌药物均有不同程度的毒副作用, 即药物在杀伤肿瘤细胞的同时, 对某些正常的组织也有一定的损害. 药物对肿瘤细胞和正常细胞尚缺乏理想的选择作用, 成为化学治疗限制剂量使用的阻碍. 纳米技术的出现为解决化疗药物选择性差提供了新的思路, 由药物和磁性纳米载体组成的磁靶向给药系统(magnetic targeted drugs system, MTDDS), 可以使药物在外磁场的引导下通过静脉、动脉导管、口服给药或直接注射等途径选择性的到达并定位于肿瘤靶区, 并且以受控的方式释放, 然后在肿瘤组织的细胞或亚细胞水平发挥药效作用, 提高了局部的药物浓度, 降低全身毒副作用[5-7]. 在各种载体中, 壳聚糖具有无毒、生物相容性和生物可降解性, 可控制药物的释放, 提高药物生物利用率、改变药物对生物膜的通透性等优点, 是一种具有广阔前景的新型药物载体[8].
Genistein具有广泛的生物学效应. 近年来研究表明, Genistein通过调节雌激素受体、增强抗氧化酶活性、诱导细胞分化、促进细胞凋亡、抑制细胞代谢关键酶活性、阻止某些因子的作用抑制包括胃癌细胞在内的多种肿瘤细胞的生长及抑制血管生成[9-10]. 为了进一步提高Genistein的抗肿瘤作用并降低其毒副作用, 许多学者开始探讨Genistein的衍生物及新剂型[11-12]. 本实验采用纳米技术制备的GNE-M-NPs是利用磁场下具有超顺磁性的氧化铁为磁性内核, 壳聚糖为骨架载体, 负载Genistein的磁靶向给药系统. 理想的靶向给药系统应具备定位蓄积、控制释药的特性, 但纳米粒由于其粒度小, 易被肝、脾、骨髓等网状内皮系统的巨噬细胞吞噬, 被动的靶向于此类器官中, 而磁靶向给药系统可以主动靶向到肿瘤组织, 避免在身体其他部位的蓄积[13]. 制备GNE-M-NPs目的是在外加磁场的作用下, 使Genistein通过血管时避免网状内皮系统的吞噬, 选择性地到达并定位于肿瘤靶区, 避免其全身分布; 加之肿瘤组织与正常组织结构上的差别, 瘤区血管快速增生, 血供丰富, 血流量大, 可对Genistein产生"虹吸作用"; 瘤区血管迂曲紊乱且粗细不均, GNE-M-NPs易于停留, 这就增加了Genistein与肿瘤血管壁的接触时间, 再者肿瘤组织血管的通透性又较正常血管大, 位于血管腔外围Genistein与管壁接触迅速越过血管内皮细胞, 更容易达到肿瘤细胞; 此外GNE-M-NPs在被磁化时相互聚集, 可沿血管纵向排列形成短圆柱链, 引起肿瘤组织的血管栓塞, 造成肿瘤组织缺血、缺氧和增加其他化疗药物的敏感性. 在非磁区, 纳米粒呈单个分散存在, 因其直径比毛细血管直径小, 一般不会造成栓塞. GNE-M-NPs本身具有的特性以及外磁场的作用可使其发挥最佳的抗癌效果. 我们着重探讨GNE-M-NPs和单药Genistein, 在体外对胃癌细胞生长的抑制作用有无差异及诱导凋亡作用.
本实验MTT结果显示Genistein对人胃癌细胞株SGC-7901生长抑制作用呈剂量、时间依赖关系, 这与国内外报道Genistein抑制其他肿瘤细胞增殖情况一致[14-16]. MTT试验中还发现GEN-M-NPs对于SGC-7901细胞呈现较强的抑制作用, 24 h时, GEN-M-NPs作用组细胞存活率高于Genistein单药组. 作用48 h后, 两种药物的存活率逐渐接近, 72 h时GEN-M-NPs组存活率低于Genistein单药组, 尤以高浓度明显.这主要是由于纳米微球具有缓释性, 短时间内药物不易从磁性载体中释放出来, 故抑制作用相对较弱, 但随时间的延长, 药物释放量逐步加大, 抑制效果增强. 但是关于纳米微球的体外药效作用, 多数学者报道的结果显示两者在体外的细胞毒性差异无统计学意义[17]. 造成这种药效差别的原因可能与壳聚糖纳米微粒与细胞吞噬能力有关. 壳聚糖是一种碱性多糖, 肿瘤细胞具有比正常细胞表面更多的负电荷, 使壳聚糖更容易吸附在肿瘤细胞表面, 而纳米微粒可以改变细胞膜转运机制, 增加药物对生物膜的通透性, 再者肿瘤细胞生长旺盛, 易于吞噬纳米颗粒, 因此更多的药物在细胞内释放, 更加有效地发挥了抗肿瘤活性.
细胞凋亡是进化上高度保守的细胞自杀的主动细胞学事件, 是细胞的自稳平衡机制和对内外刺激的一种应答反应. 许多化疗药物通过诱导细胞凋亡来抑制肿瘤细胞的生长. 因此诱导肿瘤细胞凋亡成为药物开发的评价标准和癌症化疗的目标[18]. 有实验证明Genistein可以通过上调PTEN基因和下调survivin蛋白表达、Caspase-3的活化、bcl-2的下调等机制诱导细胞凋亡抑制肿瘤细胞生长[19-20]. 为深入研究GEN-M-NPs抑制胃癌细胞生长的机制, 本实验采用流式细胞术观察不同浓度GEN-M-NPs作用72 h细胞凋亡情况和琼脂糖凝胶电泳观察不同时间40 μmol/L GEN-M-NPs作用后DNA片段化改变, 流式细胞仪和DNA电泳检测证实有凋亡细胞的存在, 提示GEN-M-NPs对胃癌细胞SGC-7901的生长抑制作用与其诱导凋亡有关. 但是流式检测结果细胞凋亡率低于细胞抑制率, 说明诱导细胞凋亡只是纳米制剂抑制SGC-7901细胞生长的途径之一, 其生长抑制机制和凋亡机制以及与Genistein有无差异有待进一步研究.
本实验证明GEN-M-NPs对胃癌细胞生长有明显的抑制作用, 还可诱导细胞凋亡, 并随着时间的延长, 药物作用更加明显, 有缓释作用, 表明其对胃癌治疗有着很好的应用前景.下一步我们将对GEN-M-NPs的药代动力学, 毒性试验, 体内靶向性, 以及GEN-M-NPs抑制胃癌细胞生长并诱导凋亡的具体机制进行研究.
在我国胃癌高居各种恶性肿瘤之首, 严重危害人类健康. 其中进展期胃癌占整个胃癌发病率的60%-80%, 化学治疗是进展期胃癌的主要治疗手段之一. Genistein是一种天然的异黄酮类植物雌激素在大豆中广泛存在, 大量研究表明其对多种肿瘤具有化学治疗和化学预防作用, 是目前植物来源药物中研究的热点.
房静远, 教授, 上海交通大学医学院附属仁济医院, 上海市消化疾病研究所.
Genistein具有广泛的生物学效应, 可通过调节雌激素受体、增强抗氧化酶活性、诱导细胞分化、促进细胞凋亡、抑制细胞代谢关键酶活性等途径抑制多种肿瘤细胞的生长及抑制血管生成. Genistein-磁性纳米微粒与Genistein药物相比, 对胃癌细胞的生长抑制作用有无差异及可能机制, 对其进行深入研究, 有望开辟胃癌治疗的新途径.
本研究发现, Genistein-磁性纳米微粒与Ge-nistein相比, 更有效的抑制胃癌细胞的生长, 并呈现出缓释性.
探讨Genistein-磁性纳米微粒与Genistein对胃癌细胞生长的影响, Genistein-磁性纳米微粒显示出优越的抗胃癌细胞活性, 为Genistein-磁性纳米微粒应用于靶向治疗胃癌提供实验依据.
磁靶向给药系统(MTDDS): 是一种新型的药物载体, 指药物与适当的磁活性成分配置在稳定的系统中, 在一定磁场作用下, 将药物定位于靶区而发挥作用.
本文尝试探讨Genistein磁性纳米微粒对胃癌细胞SGC7901生长及凋亡的影响, 研究方法较合适, 但结论却显得有些扩大化.
编辑: 师忠芳 电编:郭海丽
| 2. | Greenlee RT, Murray T, Bolden S, Wingo PA. Cancer statistics, 2000. CA. Cancer J Clin. 2000;50:7-33. [PubMed] [DOI] |
| 3. | Gossner G, Choi M, Tan L, Fogoros S, Griffith KA, Kuenker M, Liu JR. Genistein-induced apoptosis and autophagocytosis in ovarian cancer cells. Gynecol Oncol. 2007;105:23-30. [PubMed] [DOI] |
| 4. | Zhang J, Misra RD. Magnetic drug-targeting carrier encapsulated with thermosensitive smart polymer: core-shell nanoparticle carrier and drug release response. Acta Biomater. 2007;3:838-850. [PubMed] [DOI] |
| 5. | Polkowski K, Popiolkiewicz J, Krzeczynski P, Ramza J, Pucko W, Zegrocka-Stendel O, Boryski J, Skierski JS, Mazurek AP, Grynkiewicz G. Cytostatic and cytotoxic activity of synthetic genistein glycosides against human cancer cell lines. Cancer Lett. 2004;203:59-69. [PubMed] [DOI] |
| 6. | Yang J, Park SB, Yoon HG, Huh YM, Haam S. Preparation of poly epsilon-caprolactone nanoparticles containing magnetite for magnetic drug carrier. Int J Pharm. 2006;324:185-190. [PubMed] [DOI] |
| 8. | Krauland AH, Alonso MJ. Chitosan/cyclodextrin nanoparticles as macromolecular drug delivery system. Int J Pharm. 2007;340:134-142. [PubMed] [DOI] |
| 9. | Wang HZ, Zhang Y, Xie LP, Yu XY, Zhang RQ. Effects of genistein and daidzein on the cell growth, cell cycle, and differentiation of human and murine melanoma cells(1). J Nutr Biochem. 2002;13:421-426. [PubMed] |
| 10. | Farina HG, Pomies M, Alonso DF, Gomez DE. Antitumor and antiangiogenic activity of soy isoflavone genistein in mouse models of melanoma and breast cancer. Oncol Rep. 2006;16:885-891. [PubMed] [DOI] |
| 11. | Zhang LN, Xiao ZP, Ding H, Ge HM, Xu C, Zhu HL, Tan RX. Synthesis and cytotoxic evaluation of novel 7-O-modified genistein derivatives. Chem Biodivers. 2007;4:248-255. [PubMed] [DOI] |
| 15. | Choi EJ, Kim T, Lee MS. Pro-apoptotic effect and cytotoxicity of genistein and genistin in human ovarian cancer SK-OV-3 cells. Life Sci. 2007;80:1403-1408. [PubMed] [DOI] |
| 16. | Shen JC, Klein RD, Wei Q, Guan Y, Contois JH, Wang TT, Chang S, Hursting SD. Low-dose genistein induces cyclin-dependent kinase inhibitors and G(1) cell-cycle arrest in human prostate cancer cells. Mol Carcinog. 2000;29:92-102. [PubMed] [DOI] |
| 18. | Chodon D, Ramamurty N, Sakthisekaran D. Preliminary studies on induction of apoptosis by genistein on HepG2 cell line. Toxicol In Vitro. 2007;21:887-891. [PubMed] [DOI] |
| 19. | Su SJ, Chow NH, Kung ML, Hung TC, Chang KL. Effects of soy isoflavones on apoptosis induction and G2-M arrest in human hepatoma cells involvement of caspase-3 activation, Bcl-2 and Bcl-XL downregulation, and Cdc2 kinase activity. Nutr Cancer. 2003;45:113-123. [PubMed] [DOI] |