修回日期: 2008-02-29
接受日期: 2008-03-08
在线出版日期: 2008-03-28
目的: 探讨小鼠日本血吸虫病纤维化肝组织中转化生长因子(transforming growth factor-β1, TGF-β1)、Smad2/3、Smad4和Smad7的表达和肝纤维化的发病机制.
方法: 清洁级6-8 wk龄ICR小鼠80只, 雌雄各半, 随机分为模型组和正常对照组, 用血吸虫尾蚴腹部贴附法制成动物模型, 正常组未予处理. 感染后wk 4、6、8和12末分批处死2组小鼠且称肝脾质量, 取部分肝做病理学观察, HE染色和猩红染色, 制作组织芯片, 免疫组化检测TGF-β1、Smad2/3、Smad4和Smad7在各组的表达状况.
结果: 与正常组相比, 模型组小鼠肝脾质量和肝指数均高(肝, 12 wk: 2.99±0.28 g vs 1.83±0.13 g; 脾, 12 wk: 0.87±0.15 g vs 0.14±0.02 g; 肝指数, 12 wk: 0.09±0.01 vs 0.04±0.00; 均P<0.01), TGF-β1和Smad2/3表达也均高于正常对照组(TGF-β1, 12 wk: 0.105±0.008 vs 0.024±0.002; Smad2/3, 12 wk: 0.094±0.009 vs 0.003±0.001, 均P<0.01), 以上指数分别与肝纤维化程度呈正相关(r = 0.635, 0.482, 0.646, 0.347, 0.662; 均P<0.01); Smad4表达高于对照组且随着纤维化的发展表达量在逐渐下降(4 wk: 0.075±0.011 vs 0.023±0.006, 6 wk: 0.043±0.008 vs 0.010±0.002, 8 wk: 0.038±0.009 vs 0.003±0.002, 12 wk: 0.028±0.004 vs 0.013±0.006; 均P<0.01), Smad7仅8 wk表达增强.
结论: TGF-β1和Smad2/3表达增强在肝纤维化的发生中起重要作用, Smad4可能主要在纤维化的早中期发挥效应.
引文著录: 王红群, 丁向东, 吴强, 张晴, 黄焰, 杨枫. 小鼠日本血吸虫性肝纤维化组织TGF-β1及Smads的表达. 世界华人消化杂志 2008; 16(9): 929-934
Revised: February 29, 2008
Accepted: March 8, 2008
Published online: March 28, 2008
AIM: To investigate the expression of transforming growth factor-β1 (TGF-β1), Smad2/3, Smad4 and Smad7 in Schistosoma japonicum-fibrotic liver tissues and to explore the fibrogenic molecular mechanism.
METHODS: Eighty healthy ICR mice were randomly divided into model group and normal control group. The model mice were infected with cercaria of Schistosoma japonica. The mice in both groups were killed at the end of the 4th, 6th, 8th and 12th wk respectively, and their livers, spleens, and bodies were weighed. Liver tissues were taken for HE and scarlet staining. Tissue microarray was prepared and immunohistochemical staining was used to detect the expression of TGF-β1, Smad2/3, Smad4 and Smad7.
RESULTS: In comparison with those in the normal control group, the livers and spleens of model mice were heavier and liver/body ratio was higher (liver, 12 wk: 2.99 ± 0.28 g vs 1.83 ± 0.13 g; spleen, 12 wk: 0.87 ± 0.15 g vs 0.14 ± 0.02 g; liver/body ratio, 12 wk: 0.09 ± 0.01 vs 0.04 ± 0.00; all P < 0.01); the expression of TGF-β1 and Smad2/3 was significantly stronger in livers of the model mice (TGF-β1, 12 wk: 0.105 ± 0.008 vs 0.024 ± 0.002; Smad2/3, 12 wk: 0.094 ± 0.009 vs 0.003 ± 0.001, all P < 0.01), and the above indexes were positively correlated with the degrees of hepatic fibrosis (r = 0.635, 0.482, 0.646, 0.347, and 0.662, respectively; all P < 0.05). Smad4 was found increased in livers of the model mice, but its expression decreased with the development of hepatic fibrosis (4 wk: 0.075 ± 0.011 vs 0.023 ± 0.006, 6 wk: 0.043 ± 0.008 vs 0.010 ± 0.002, 8 wk: 0.038 ± 0.009 vs 0.003 ± 0.002, 12 wk: 0.028 ± 0.004 vs 0.013 ± 0.006, all P < 0.01). Smad7 expression heightened only at the 8th wk.
CONCLUSION: TGF-β1 and Smad2/3 might play important roles in liver fibrogenesis and Smad4's effect might occur at early and middle stage of hepatic fibrosis.
- Citation: Wang HQ, Ding XD, Wu Q, Zhang Q, Huang Y, Yang F. Expression of transforming growth factor-β1 and Smads in hepatic fibrosis induced by Schistosoma Japonica in mice. Shijie Huaren Xiaohua Zazhi 2008; 16(9): 929-934
- URL: https://www.wjgnet.com/1009-3079/full/v16/i9/929.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i9.929
日本血吸虫病发病率近几年有所上升, 中晚期血吸虫病患者慢性肝纤维化和巨脾是危害患者健康的主要原因. 我们检测转化生长因子(transforming growth factor-β1, TGF-β1)及Smads信号在肝纤维化过程中的改变, 为日本血吸虫病肝纤维化的防治提供理论依据.
中国大陆株日本血吸虫尾蚴阳性钉螺购自江苏省血吸虫病防治研究所; 清洁级ICR小鼠80只购自安徽省实验动物中心; PV法免疫组化试剂盒购自北京中杉金桥生物技术有限公司; 抗TGF-β1抗体(BA0290)、抗Smad2/3抗体(BA1395)、抗Smad4(BA1399) 和Smad7 (BA1397)抗体均购自博士德生物工程有限公司.
6-8 wk龄小鼠80只, 体质量31±2 g, 随机分为模型组和正常对照组, 雌雄各半. 将钉螺置于水中室温下孵育24 h, 可观察到逸出的尾蚴, 将玻片置于水中数分钟使其黏附尾蚴(每张玻片约含尾蚴30±1条)[1]并贴附于已备皮的模型组小鼠的腹部10 min制成动物模型, 1 wk内观察到模型组小鼠腹部呈尾蚴性皮炎改变. 于4、6、8和12 wk分别处死两组小鼠各10只并称体质量, 取肝脾分别称质量, 计算肝指数(肝质量/体质量), 切取肝脏右叶组织1块用40 g/L中性甲醛固定, 余下部分置于-20℃冰箱备用. 肝组织常规石蜡包埋, 4 μm连续切片, 作HE和天狼猩红染色, 光镜观察肝组织病理变化和纤维化程度并分级打分. 肝纤维化程度判定标准[2]: 0级: 20 = 1, 正常; Ⅰ级: 21 = 2, 胶原纤维包绕肉芽肿周围并插入其中; Ⅱ级: 22 = 4, 汇管区有大量纤维, 小叶间仅有少量纤维; Ⅲ级: 23 = 8, 纤维组织大量延伸至小叶间. 光镜下观察HE切片的形态, 于虫卵肉芽肿明显处用定位仪定位, 在相应蜡块的对应区域钻取3点, 置于组织芯片的相应位点, 正常组也每例均取3点, 制成7×6点阵的组织芯片(每孔直径2 mm), 重新石蜡包埋, 4 μm连续切片, 贴附于多聚赖氨酸处理的玻片上, 分别作HE和免疫组化染色. 采用PV法, 常规脱蜡至水, 柠檬酸缓冲液热抗原修复, 抗TGF-β1抗体1∶100稀释, 余抗体均1∶50稀释, DAB显色, 苏木素复染. PBS代替一抗做阴性对照, 已知阳性片做阳性对照. 在统一的拍摄条件下每例均拍摄5个高倍视野(×400)的病变组织, 用Image-pro plus 5.0图像分析软件行吸光度分析, 常规吸光度校正, 取平均吸光度值.
统计学处理 用SPSS13.0统计学软件, 计量资料用mean±SD表示, 采用独立t检验和One-way ANOVA统计分析, 相关性分析用Spearman相关, P<0.05有统计学意义.
与正常对照组相比, 6、8和12 wk模型组小鼠肝质量均高, 其中8 wk最高, 12 wk下降(表1); 模型组小鼠的脾质量和肝指数逐渐上升, 12 wk最高, 且各时间点均高于对照组; 模型组这3项值均与肝纤维化程度变化呈正相关(表2).
| 分组 | 肝质量 | 脾质量 | 肝脏指数 | 肝纤维化 |
| 4 wk | ||||
| 模型组 | 1.83±0.09 | 0.20±0.02b | 0.052±0.00b | 1.1±0.1 |
| 正常组 | 1.73±0.12 | 0.09±0.00 | 0.045±0.00 | 1.0±0.0 |
| 6 wk | ||||
| 模型组 | 2.41±0.08ab | 0.30±0.03ab | 0.07±0.00ab | 3.8±0.2ab |
| 正常组 | 1.65±0.07 | 0.11±0.01 | 0.05±0.00 | 1.0±0.0 |
| 8 wk | ||||
| 模型组 | 3.16±0.26ab | 0.45±0.10b | 0.08±0.01ab | 5.0±0.9ab |
| 正常组 | 2.24±0.15 | 0.11±0.01 | 0.06±0.00 | 1.0±0.0 |
| 12 wk | ||||
| 模型组 | 2.99±0.28ab | 0.87±0.15abc | 0.09±0.01ab | 5.8±0.8ab |
| 正常组 | 1.83±0.13 | 0.14±0.02 | 0.04±0.00 | 1.0±0.0 |
| 肝质量 | 脾质量 | 肝指数 | TGF-β1 | Smad2/3 | Smad7 | Smad4 | |
| r | 0.635 | 0.482 | 0.646 | 0.347 | 0.662 | 0.180 | -0.523 |
| P | 0.000 | 0.002 | 0.000 | 0.028 | 0.000 | 0.265 | 0.001 |
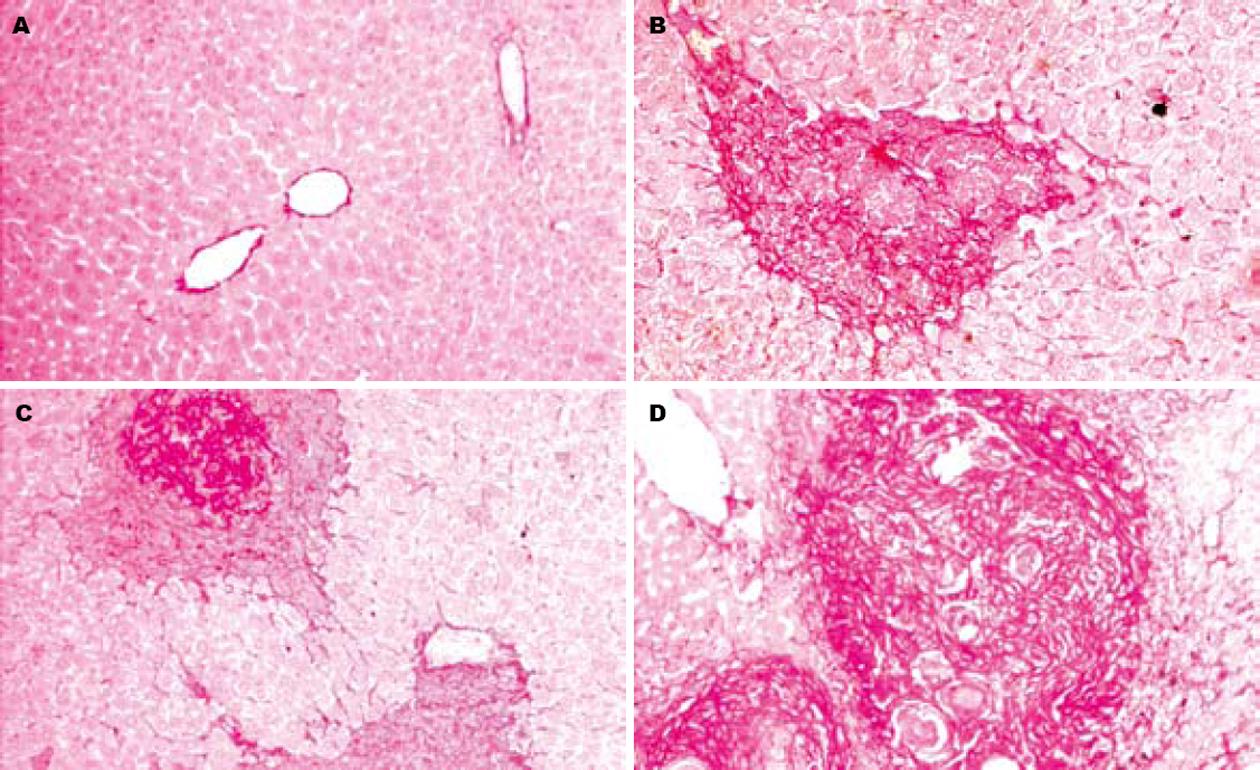
模型组4 wk可观察到在窦周隙、肝窦、血管周和汇管区散在点状、小灶状和族状分布的星状细胞、枯否氏细胞和炎细胞, 部分肝细胞水肿, 1例汇管区见虫卵; 6 wk可见虫卵沉积, 肉芽肿形成, 其周围可见胶原; 8 wk肝细胞水肿明显, 肝索和肝小叶排列紊乱, 可见大量急性肉芽肿, 其细胞密度高, 以圆形和星形细胞为主, 周围有丰富胶原沉积, 部分胶原伸至汇管区间; 12 wk部分肉芽肿胶原成分增多, 直径增大, 以梭形的纤维细胞为主, 肝纤维化程度加重, 可见肉芽肿之间胶原融合, 部分胶原纤维束沿汇管区延伸并相互连接(图1).
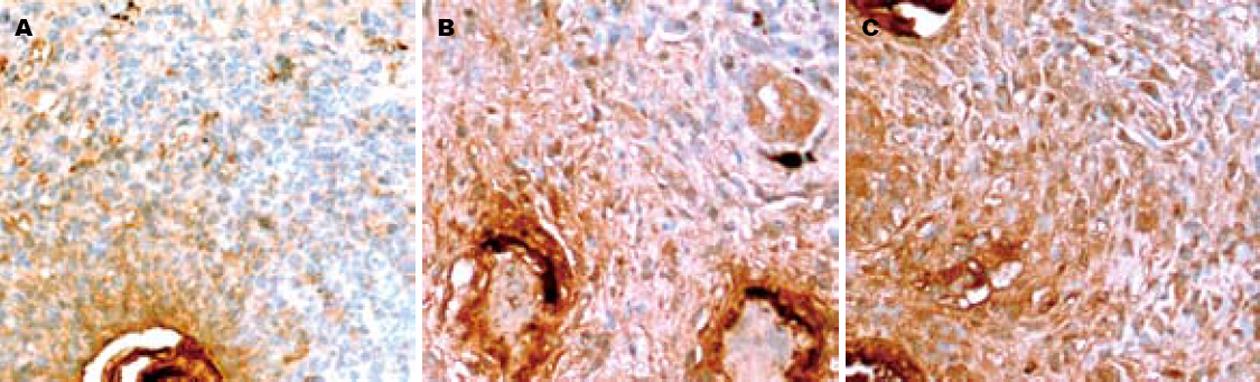
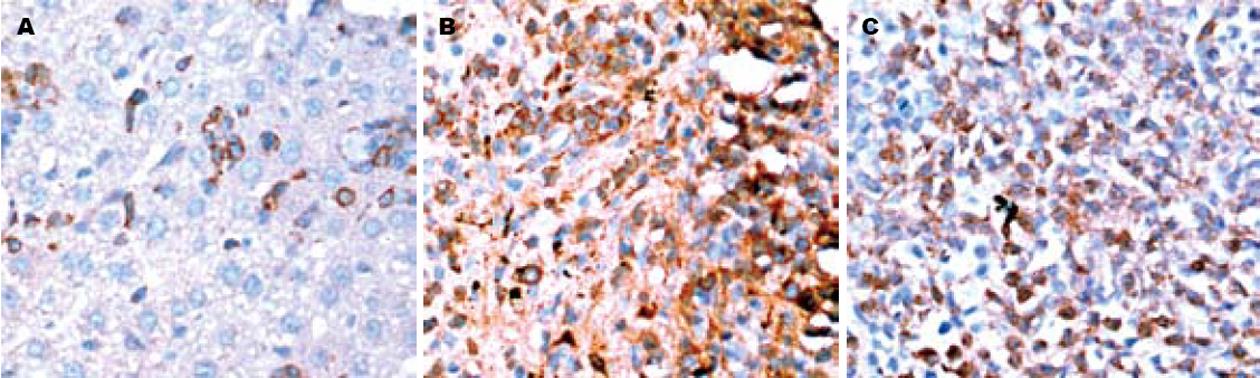
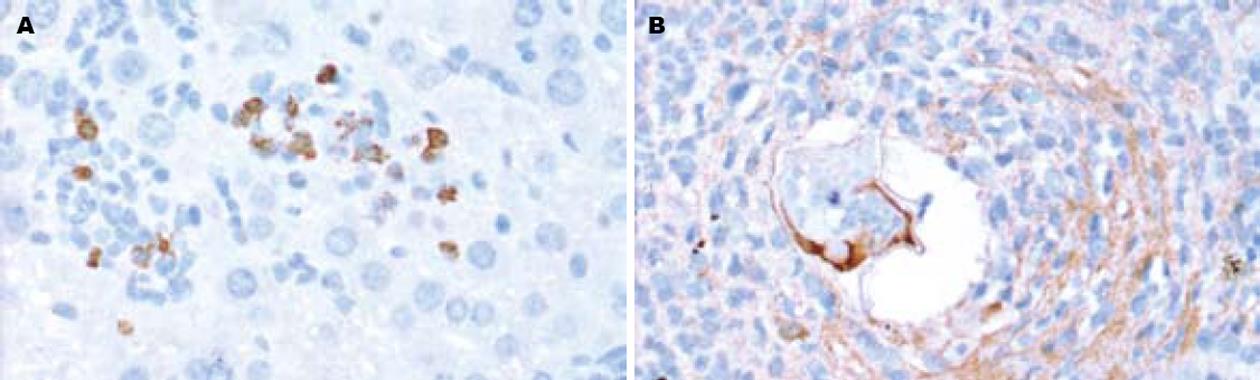
TGF-β1免疫染色定位于细胞质, 部分伴有细胞膜的表达. 正常肝脏组织中, 仅部分肝细胞和胆管上皮细胞有微弱的表达. 模型组其表达较强, 随时间推移呈逐渐增强趋势, 与肝纤维化程度呈正相关. 主要分布于肉芽肿中的各种细胞、胆管上皮细胞、窦周隙的星状细胞、肝窦及其内的枯否氏细胞, 肉芽肿周围的部分肝细胞也有较强的表达(图2). Smad2/3定位于细胞质. 正常小鼠肝组织基本无表达. 4 wk, 模型组Smad2/3可见呈散在点状、小灶状和族状阳性表达(图3A); Smad2/3在8 wk和12 wk表达达高峰(图3B-C), 主要分布于肉芽肿中各种细胞, 少数伴有细胞核的表达, 胆管上皮细胞和肉芽肿周围的部分肝细胞也呈阳性. Smad4定位于细胞核和或细胞质. 正常小鼠肝组织血管内皮细胞及血管旁少量肝细胞的细胞质微弱表达. 模型组, 4 wk和6 wk可见星状细胞和炎细胞等细胞表达(图4A), 部分肝细胞胞质也可见表达, 在8 wk和12 wk表达量少, 与肝纤维化程度呈负相关(表2). Smad7定位于细胞质. 在正常小鼠肝组织血管内皮细胞、血管壁中的细胞和肝细胞可见表达. 模型组, 8 wk表达增强, 主要分布于肝细胞, 肉芽肿中各种细胞也可见少量表达(图4B), 4 wk、6 wk和12 wk表达与正常组无差异(表3).
| 分组 | TGF-β1 | Smad2/3 | Smad7 | Smad4 |
| 4 wk | ||||
| 模型组 | 0.056±0.011b | 0.034±0.007b | 0.038±0.007 | 0.075±0.011b |
| 正常组 | 0.014±0.002 | 0.005±0.002 | 0.020±0.005 | 0.023±0.006 |
| 6 wk | ||||
| 模型组 | 0.095±0.007ab | 0.037±0.005b | 0.020±0.002a | 0.043±0.008ab |
| 正常组 | 0.036±0.009 | 0.006±0.002 | 0.022±0.005 | 0.010±0.002 |
| 8 wk | ||||
| 模型组 | 0.099±0.010ab | 0.102±0.009abe | 0.058±0.007abe | 0.038±0.009ab |
| 正常组 | 0.035±0.001 | 0.011±0.007 | 0.021±0.005 | 0.003±0.002 |
| 12 wk | ||||
| 模型组 | 0.105±0.008ab | 0.094±0.009abe | 0.039±0.002ce | 0.028±0.004abe |
| 正常组 | 0.024±0.002 | 0.003±0.001 | 0.029±0.004 | 0.013±0.006 |
TGF-β1是最为重要的致纤维化因子之一, 其对肝纤维化的发生具有特别重要的病理生理学意义. 肝纤维化过程中, 随着TGF-β1活性的增加, 胶原产生及其沉积增加, 说明TGF-β1在肝脏的过表达诱导了肝纤维化的发生[3-7]. 当阻断TGF-β的合成或封闭其信号则阻止了在各种动物模型中纤维化的发生[8-11]. 本文实验结果显示: TGF-β1在模型组表达高, 尤其8 wk和12 wk表达更强, 其变化与肝纤维化程度呈正相关, 证实了TGF-β1在血吸虫诱导的肝纤维化过程中发挥了重要作用.
TGF-β1结合到特异受体, 通过信号分子传递从而发挥作用, 其中R-Smad(Smad2和Smad3)结合到Ⅰ型受体(TβR1)并被激活, 随后他们和通用型的Smad4结合成复合物转入到细胞核, 调控特殊靶基因的转录(如胶原基因和抑制型Smads基因)[12]; Smad3在纤维化肝组织内表达增强, 也是直接的基质产生和纤维形成的调节者, 其过表达时, 纤维结合蛋白和胶原Ⅰ的沉积增加, 当其缺乏时胶原表达减少, 抵制纤维化的发生[13-18]. 应用Smad2, 3, 4反义寡聚核苷酸或cDNA可有效抑制TGF-β的生物学功能[19]. 可见, Smad2和Smad3在纤维化过程和TGF-β1信号途径中扮演着重要的作用. 本实验中, Smad2/3在模型组肝组织表达较强, 8 wk和12 wk表达最强, 其表达变化情况与TGF-β1相似, 和肝纤维化程度呈正相关, 与曾军 et al[20]研究结果一致, 证实Smad2/3在肝纤维化过程中的重要作用. 结果还显示, Smad4在模型组表达增加, 主要在炎细胞和星状细胞等细胞内表达, 随着炎症和纤维化的发展, 肝星状细胞(hepatic stellate cell, HSC)演变为肌样成纤维细胞(myofibroblast, MFB), 炎细胞也逐渐减少, 纤维细胞和胶原逐渐增加, 因此Smad4表达也渐减少, 与肝纤维化的变化程度呈负相关, 提示Smad4也参与了肝纤维化发生, 可能主要在纤维化的早中期发挥效应.
Smad7为抑制型Smads, 当被激活时结合激活的TβR1抑制R-Smad的磷酸化, 阻断TGF-β信号的转导[21]. 研究还发现, 急性肝损伤时, 分泌的Smad2诱导Smad7的表达, 而慢性损伤时, Smad2持续磷酸化则导致Smad7的缺失[22]. 本文结果显示, Smad7在8 wk一过性升高, 其表达与Smad2/3呈正相关(r = 0.553, P<0.01), 可能8 wk时Smad2/3分泌增加诱导其表达, 但随后活化的Smad2/3持续磷酸化导致Smad7的降低, 提示Smad7可能在肝纤维化早期发挥作用.
另外, 近年来有人提出上皮间质化(epithelial-to-mesenchymal transition, EMT)可能在纤维化过程中起着一定作用[23-25]; Kaimori et al[26]研究认为, TGF-β1能诱导肝细胞成为EMT状态, 这种状态的肝细胞内α1(Ⅰ)胶原mRNA表达上调, Ⅰ型胶原沉积增加. 除了肝脏HSC/MFB, 汇管区的成纤维细胞、固有的和骨髓源性的间充质细胞也具有产生纤维的潜能[27-29], 胆管上皮也可能参与了纤维化过程[12,25]. 本文实验中, 观察到TGF-β1和Smad2/3不仅在窦周隙的星状细胞和肉芽肿中的各种细胞表达, 而且在肉芽肿旁的部分肝细胞和胆管上皮细胞均有较强的表达, Smad4主要在炎细胞和HSC等细胞内表达. 结合本文结果和上述文献提示HSC、炎细胞、成纤维细胞、固有的和骨髓源性的间充质细胞、肝细胞和胆管上皮细胞等可能均参与了肝纤维化的发生.
日本血吸虫病是热带亚热带发展中国家的主要寄生虫病, 其发病率在我国近几年有所上升, 其导致的肝纤维化是危害患者健康的主要原因.
吴君, 主任医师, 贵阳医学院附属医院感染科.
肝纤维化通过多种信号转导通路发生, TGF-β1/Smads途径是其中重要的一种, 其机制尚存争议.
本研究进一步证实了TGF-β1和Smad2/3在血吸虫病肝纤维化中的重要作用, Smad4主要在此过程的早中期发挥效应, 且肝纤维化发生是多种细胞参与的过程.
TGF-β1、Smad2/3和Smad4的产生及激活是肝纤维化发生的重要过程, 通过抑制这些信号分子的产生和活性从而阻断肝纤维化的发生.
血吸虫病肝纤维化: 是指由于感染血吸虫, 虫卵沉积于肝脏汇管区, 在虫卵抗原的刺激下形成虫卵结节, 结节周围纤维组织增生, 沿着汇管区延伸, 形成干线型肝纤维化.
本文选题新颖, 实验数据可靠, 结果客观, 但论据不够充分, 具有一定的学术和实际应用价值.
编辑: 潘伯荣 电编:吴鹏朕
| 1. | Coutinho EM. Malnutrition and hepatic fibrosis in murine schistosomiasis. Mem Inst Oswaldo Cruz. 2004;99:85-92. [PubMed] [DOI] |
| 2. | Yang Y, Cai W, Jin G. Dynamic changes in hepatic myofibroblast of rabbits with Schistosoma japonicum. Zhonghua Yixue Zazhi. 1999;79:870-873. [PubMed] |
| 3. | Sanderson N, Factor V, Nagy P, Kopp J, Kondaiah P, Wakefield L, Roberts AB, Sporn MB, Thorgeirsson SS. Hepatic expression of mature transforming growth factor beta 1 in transgenic mice results in multiple tissue lesions. Proc Natl Acad Sci U S A. 1995;92:2572-2576. [PubMed] [DOI] |
| 5. | 孙 樱, 宣 世英, 辛 永宁, 吕 维红, 初 蕾蕾, 李 宁, 张 健, 张 梅. 慢性乙型肝炎患者血清TGF-β1与肝组织纤维化及肝功能相关性的研究. 中华肝脏病杂志. 2002;10:221-222. |
| 8. | George J, Roulot D, Koteliansky VE, Bissell DM. In vivo inhibition of rat stellate cell activation by soluble transforming growth factor beta type II receptor: a potential new therapy for hepatic fibrosis. Proc Natl Acad Sci U S A. 1999;96:12719-12724. [PubMed] [DOI] |
| 9. | Qi Z, Atsuchi N, Ooshima A, Takeshita A, Ueno H. Blockade of type beta transforming growth factor signaling prevents liver fibrosis and dysfunction in the rat. Proc Natl Acad Sci U S A. 1999;96:2345-2349. [PubMed] [DOI] |
| 10. | Nakamura T, Sakata R, Ueno T, Sata M, Ueno H. Inhibition of transforming growth factor beta prevents progression of liver fibrosis and enhances hepatocyte regeneration in dimethylnitrosamine-treated rats. Hepatology. 2000;32:247-255. [PubMed] [DOI] |
| 11. | Arias M, Sauer-Lehnen S, Treptau J, Janoschek N, Theuerkauf I, Buettner R, Gressner AM, Weiskirchen R. Adenoviral expression of a transforming growth factor-beta1 antisense mRNA is effective in preventing liver fibrosis in bile-duct ligated rats. BMC Gastroenterol. 2003;3:29. [PubMed] [DOI] |
| 12. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 13. | 张 彬彬, 焦 杨文, 蔡 卫民, 陶 君, 郑 敏, 董 凤芹, 刘 荣华. Smads在日本血吸虫病小鼠肝纤维化形成过程中的表达. 中国寄生虫学与寄生虫病杂志. 2004;22:154-156. |
| 14. | Uemura M, Swenson ES, Gaca MD, Giordano FJ, Reiss M, Wells RG. Smad2 and Smad3 play different roles in rat hepatic stellate cell function and alpha-smooth muscle actin organization. Mol Biol Cell. 2005;16:4214-4224. [PubMed] [DOI] |
| 15. | Schnabl B, Kweon YO, Frederick JP, Wang XF, Rippe RA, Brenner DA. The role of Smad3 in mediating mouse hepatic stellate cell activation. Hepatology. 2001;34:89-100. [PubMed] [DOI] |
| 16. | Bonniaud P, Margetts PJ, Ask K, Flanders K, Gauldie J, Kolb M. TGF-beta and Smad3 signaling link inflammation to chronic fibrogenesis. J Immunol. 2005;175:5390-5395. [PubMed] [DOI] |
| 17. | Seyhan H, Hamzavi J, Wiercinska E, Gressner AM, Mertens PR, Kopp J, Horch RE, Breitkopf K, Dooley S. Liver fibrogenesis due to cholestasis is associated with increased Smad7 expression and Smad3 signaling. J Cell Mol Med. 2006;10:922-932. [PubMed] [DOI] |
| 18. | Kitamura Y, Ninomiya H. Smad expression of hepatic stellate cells in liver cirrhosis in vivo and hepatic stellate cell line in vitro. Pathol Int. 2003;53:18-26. [PubMed] [DOI] |
| 20. | 曾 军, 杨 镇, 李 岽健, 邹 卫龙, 高 志强, 李 涛. 实验性血吸虫病肝纤维化中TGF-β1 Smad3 Smad7的表达变化及意义. 中国血吸虫病防治杂志. 2004;16:269-273. |
| 21. | Mori Y, Chen SJ, Varga J. Expression and regulation of intracellular SMAD signaling in scleroderma skin fibroblasts. Arthritis Rheum. 2003;48:1964-1978. [PubMed] [DOI] |
| 22. | Tahashi Y, Matsuzaki K, Date M, Yoshida K, Furukawa F, Sugano Y, Matsushita M, Himeno Y, Inagaki Y, Inoue K. Differential regulation of TGF-beta signal in hepatic stellate cells between acute and chronic rat liver injury. Hepatology. 2002;35:49-61. [PubMed] [DOI] |
| 23. | Zavadil J, Böttinger EP. TGF-beta and epithelial-to-mesenchymal transitions. Oncogene. 2005;24:5764-5774. [PubMed] [DOI] |
| 24. | Ward C, Robertson H, Forrest IA, Lordan J, Murphy D, Dark JH, Corris PA, Jones DE, Kirby JA. Hypothesis: epithelial-to-mesenchymal transition is a common cause of chronic allograft failure. Transplant Proc. 2005;37:977-980. [PubMed] [DOI] |
| 25. | Rygiel KA, Robertson H, Marshall HL, Pekalski M, Zhao L, Booth TA, Jones DE, Burt AD, Kirby JA. Epithelial-mesenchymal transition contributes to portal tract fibrogenesis during human chronic liver disease. Lab Invest. 2008;88:112-123. [PubMed] [DOI] |
| 26. | Kaimori A, Potter J, Kaimori JY, Wang C, Mezey E, Koteish A. Transforming growth factor-beta1 induces an epithelial-to-mesenchymal transition state in mouse hepatocytes in vitro. J Biol Chem. 2007;282:22089-22101. [PubMed] [DOI] |
| 27. | Forbes SJ, Russo FP, Rey V, Burra P, Rugge M, Wright NA, Alison MR. A significant proportion of myofibroblasts are of bone marrow origin in human liver fibrosis. Gastroenterology. 2004;126:955-963. [PubMed] [DOI] |
| 28. | Ramadori G, Saile B. Portal tract fibrogenesis in the liver. Lab Invest. 2004;84:153-159. [PubMed] [DOI] |