修回日期: 2008-03-15
接受日期: 2008-03-18
在线出版日期: 2008-03-28
目的: 探讨幽门螺杆菌(H pylori)刺激人胃癌细胞SGC-7901后, 对细胞形态, 迁移以及细胞骨架的影响.
方法: 从人胃黏膜组织中分离培养H pylori, 将得到的H pylori菌体超声裂解, 用超声提取物刺激SGC-7901细胞, 直接观察SGC-7901细胞形态的变化; 细胞迁移活动用Boyden迁移槽和划线法分析; 用phalloidin对细胞内F-actin进行荧光染色, 研究其对细胞骨架的作用. 各组间细胞迁移数量比较用单因素方差分析, 组间两两比较用SNK检验; 对照组和刺激组细胞发生蜂鸟表型的百分率进行t检验.
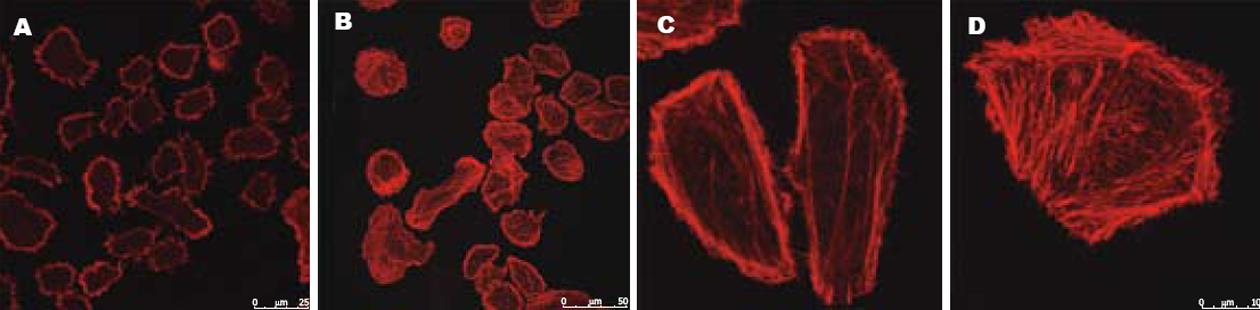
结果: H pylori菌体超声提取物刺激人胃癌细胞SGC-7901后, 细胞的活动性增强, 高浓度和低浓度刺激组与对照组相比细胞迁移数明显提高(F = 12697.314, P<0.01), 两两之间相比也具有统计学意义(P<0.01). 受刺激后蜂鸟表型细胞数较对照组大大提高(t = 29.626, P<0.01). 对照组细胞仅有少量应激纤维形成, H pylori刺激10 min后, 应激纤维增加.
结论: H pylori可诱导胃癌细胞SGC-7901发生形态改变, 促进其迁移, 并且增加细胞内细胞骨架的形成.
引文著录: 陆芬英, 张尤历, 王文兵, 陈永昌, 张宇川, 刘勇攀, 吴莺. 幽门螺杆菌提取物体外对人胃癌细胞SGC-7901形态的影响. 世界华人消化杂志 2008; 16(9): 919-923
Revised: March 15, 2008
Accepted: March 18, 2008
Published online: March 28, 2008
AIM: To investigate the effect of Helicobacter pylori (H pylori) on the morphology, motility and cytoskeleton of human gastric cancer SGC-7901 cells.
METHODS: H pylori were isolated from human gastric mucosa and cultured on a solid agar medium. The SGC-7901 cells were treated with the sonication extract to observe the morphological alteration, cell motility and cytoskeleton. Cell motility was examined by Boyden chamber motility assay and scrape motility assay. Cytoskeleton was observed by F-actin phalloidin fluorescent staining. The number of migrated SGC-7901 cells in the Boyden chamber was compared among three groups by one-way ANOVA, and the numbers between each two groups were compared by SNK test. The t test was used to compare the percentage of hummingbird-phenotype SGC-7901 cells between the stimulated group and control group.
RESULTS: The sonication extract enhanced SGC-7901 cell motility, induced the appearance of hummingbird-phenotype, and increased cytoskeleton. The Boyden chamber motility assay showed that the number of migrated SGC-7901 cells stimulated by high and low concentration of H pylori extract was significantly increased in comparison with that in the control group (F = 12697.314, P < 0.01), and there was also a significant difference between the two groups (P < 0.01). The percentage of hummingbird-phenotype SGC-7901 cells in the stimulated group was significantly higher than that in the control group (t = 29.626, P < 0.01). Cytoskeleton was just a little in the control group, but increased a lot after 10-min stimulation.
CONCLUSION: H pylori can induce morphological alteration of human gastric cancer SGC-7901 cells, enhance their motility and formation of cytoskeleton in the cells.
- Citation: Lu FY, Zhang YL, Wang WB, Chen YC, Zhang YC, Liu YP, Wu Y. Effect of Helicobacter pylori on morphology of human gastric cancer SGC-7901 cells. Shijie Huaren Xiaohua Zazhi 2008; 16(9): 919-923
- URL: https://www.wjgnet.com/1009-3079/full/v16/i9/919.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i9.919
幽门螺杆菌(Helicobacter pylori, H pylori)是一种革兰染色阴性的微需氧菌. 其感染是胃炎、胃溃疡、十二指肠溃疡的主要病因之一, 也是胃癌发病的危险因素[1-2]. 在世界范围内约有50%人群感染H pylori, 1994年国际癌症机构已将其列为Ⅰ级致癌原[3]. 小G蛋白RhoA是Rho家族的重要成员之一, 在细胞信号转导通路中起着重要作用. 他参与了一系列的生物学进程, 包括细胞形态改变, 迁移, 细胞骨架的调节, 胞质分裂, 平滑肌收缩和肿瘤浸润等[4-6]. 在众多胃癌细胞中, RhoA蛋白均呈现高表达状态[7]. 已有实验证实H pylori刺激人胃癌细胞SGC-7901后, 可提高细胞内RhoA的活性[8]. 因此, 我们通过H pylori超声提取物刺激人胃癌细胞SGC-7901, 观察细胞的形态变化, 迁移率和细胞骨架的改变, 进一步阐明H pylori的致病机制, 为临床治疗和预防H pylori感染提供理论依据.
临床H pylori菌株从本院内镜室活检标本分离培养获得. TRITC标记的phalloidin染料购自Sigma公司, Boyden迁移槽为Costar公司产品, 小牛血清为兰州民海生物工程有限公司产品, DMEM为Gibco公司产品. 取江苏大学附属医院行消化系内窥镜检查患者的胃窦黏膜(距幽门5 cm内)活检组织标本, 经快速尿素酶试验证实H pylori阳性, 病理证实为胃癌. 将活检新鲜组织用接种环均匀涂于固体琼脂培养基, 在微需氧环境, 37℃下培养, 约72 h后收集细菌. 将生长良好的H pylori刮下后用PBS漂洗两遍, 然后将之悬于不含血清的DMEM培养液中, 菌体悬液经超声裂解(100 W, 30 s, 10次, 间隔20 s, 冰浴冷却), 低温离心(12 000 r/min, 4℃, 10 min), 取上清, 在蛋白含量测定仪上测量其浓度, -20℃保存备用. 人胃癌上皮细胞株SGC-7901由江苏大学生理教研室提供, 采用含100 mL/L新生牛血清的DMEM培养基于37℃、50 mL/L CO2温箱培养, 2-3 d更换培养基1次, 待细胞铺满底后, 用2.5 g/L胰酶消化成单个细胞, 继续培养, 取对数生长期细胞进行实验.
1.2.1 迁移率分析: 选用槽底部膜的直径为60 mm, 膜上孔直径为8 μm的Boyden迁移槽. 接种前一天在膜的底部加入含100 mL/L新生牛血清的DMEM 100 μL, 放入chamber, 在chamber内加入上述培养基600 μL, 然后将迁移槽置于培养箱中过夜. 接种时用上述方法消化细胞并计数, 每个迁移槽中加入8.4×104个细胞, 然后分别加入25 g/L的H pylori超声提取物70、140 μL, 将迁移槽放入37℃、50 mL/L CO2温箱孵育12 h后, 将迁移槽取出, 用棉花将膜上部未迁移的细胞擦净, 以500 mL/L甲醇+100 mL/L乙醇固定膜45 s, 1×PBS洗膜1 min, 10 g/L甲苯胺蓝50℃水浴染色20 min, 700 mL/L, 800 mL/L, 950 mL/L, 1000 mL/L乙醇分色, 前3步每次2-3 s, 最后一步10 s, 然后将膜在水中漂洗数次, 显微镜下随机计数20个200倍视野中的细胞. 在24孔细胞培养板背面, 每孔划相距5 mm的两条直线. 细胞消化计数后, 以每孔4×104个接种, 24 h后, 用消毒的细胞刮子将两条线之间的细胞刮干净, 以PBS漂洗, 加入无血清的DMEM饥饿12 h后, 按上面的剂量加入H pylori超声提取物, 放培养箱中继续培养24 h, 于倒置显微镜下观察细胞迁移的情况.
1.2.2 蜂鸟表型观察: 细胞消化后, 以3.0×104/L的密度接种于24孔板, 待细胞贴壁后, 将培养液吸去, 每孔中加入无血清DMEM 250 μL, 饥饿12 h每个孔中加入25 g/L H pylori超声提取物100 μL, 放培养箱中继续培养, 显微镜下在不同的时间观察细胞形态, 随机计数200倍视野下100个细胞中的蜂鸟表型数目.
1.2.3 细胞骨架的荧光染色: 将细胞接种到放有爬片的24孔板中, 细胞密度约为3.0×104/L, 细胞贴壁后, 将培养液换成无血清DMEM, 每孔定容至250 μL, 12 h后分别加入25 g/L H pylori超声提取物25 μL, 刺激10 min. 吸去培养液, 用新鲜配置的20 mL/L多聚甲醛在室温下固定15 min, 然后用3 mL/L TRIton-X100室温下作用8 min. 细胞用50 μg/L罗丹明标记的鬼笔环肽(phalloidin)直接染色, 室温下孵育30 min. 从固定细胞开始每一部操作以后用PBS洗3次, 每次3 min, 最后用清水漂洗, 300 mL/L甘油封片. 在荧光显微镜下观察细胞的骨架.
统计学处理 所得数据用SPSS13.0统计软件进行检验, Boyden迁移槽迁移率分析多个均数间比较用单因素方差分析(One-Way ANOVA), 两两比较采用SNK检验, 蜂鸟表型采用t检验, P<0.05有统计学意义.
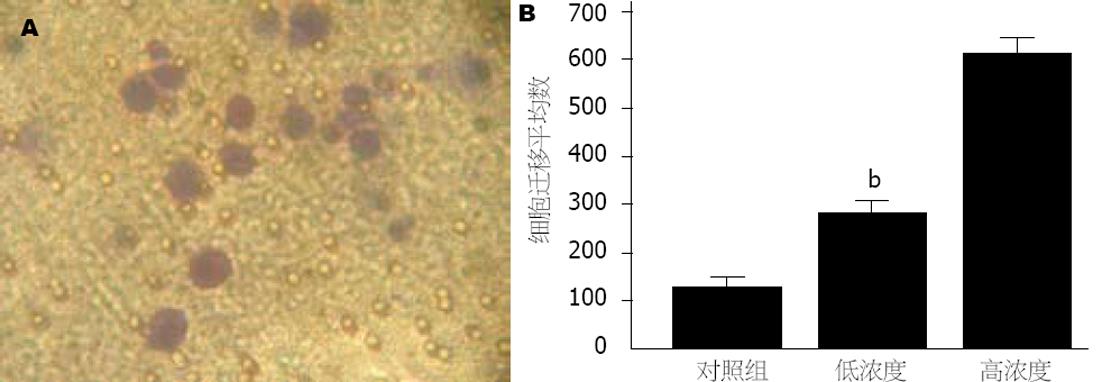
Boyden迁移槽在培养箱中孵育12 h后, 部分细胞通过膜上的小孔迁移到膜的底侧, 经固定染色后, 可见到膜上的细胞(图1A). 观察结果表明, H pylori刺激细胞后能够促进细胞的迁移, 两实验组与对照组相比细胞迁移数明显提高(F = 12697.314, P<0.01), 各组之间两两相比也具有统计学意义(P<0.01), 说明这种作用在一定范围内呈现浓度依赖性(图1B).
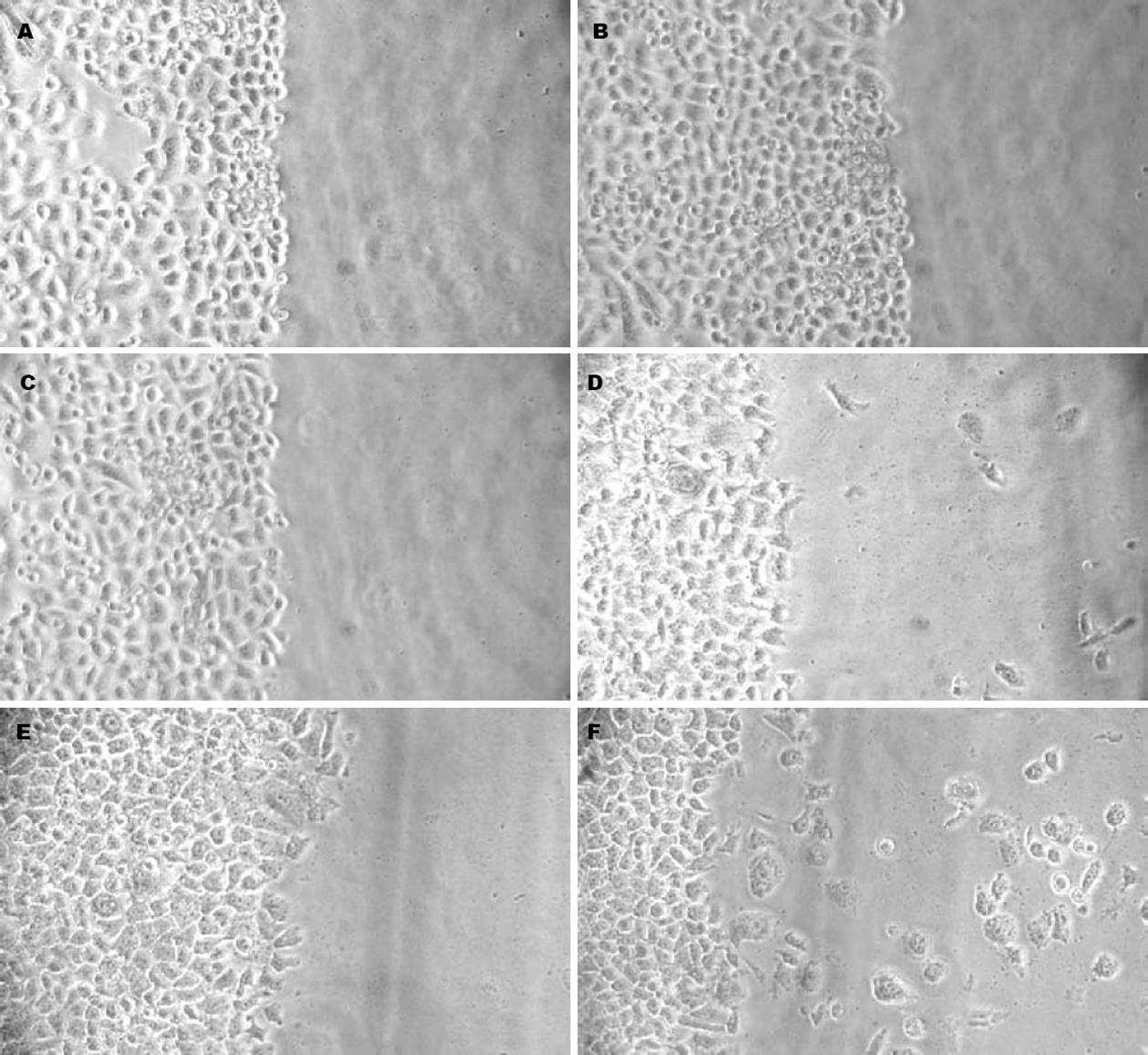
刮除细胞后24 h, 加入H pylori裂解液后, 与对照组相比, 由未刮除部分迁入刮除部分的细胞增加, 这种作用呈现浓度依赖性(图2).
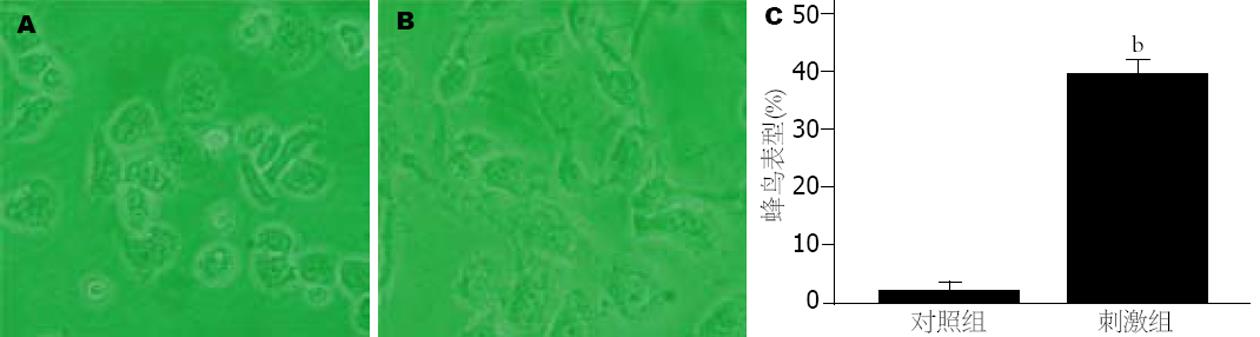
刺激24 h后, 细胞出现蜂鸟表型(图3B), 持续约12 h, 至刺激后36 h蜂鸟表型消失, 细胞开始凋亡, 而对照组细胞基本没有出现蜂鸟表型(图3A), 两者将比具有统计学意义(t = 29.626, P<0.01).
H pylori自发现以来, 因其与消化系疾病如消化性溃疡, 慢性胃炎和胃癌的发生密切相关[1-2], 其致病机制一直是研究的焦点. 以往研究表明, CagA阳性的H pylori所含有的CagA致病岛(CagPAI)编码的IV型分泌系统能够将CagA蛋白注入胃上皮细胞[9]; 在细胞内Src家族酪氨酸酶的作用下, 细胞内CagA发生磷酸化, 与SHP-2形成复合物, CagA- P-SHP-2复合物的形成可下调SHP-2的磷酸酶活性, 导致黏附激酶去磷酸化而失活, 从而引起细胞发生蜂鸟样改变, 提高细胞的活动性[10-11], 而SHP-2磷酸化可激活RhoA的活性[12], 引起一系列生物学变化. Backert et al[13]将H pylori活菌刺激人胃癌细胞AGS, 发现在CagA阳性的H pylori中, 有一个胃癌菌株Ca130其CagA虽有表达但没有发生磷酸化; 将Ca130裂解液感染AGS细胞裂解液, CagA发生了磷酸化, 推断出现这种现象的原因可能是因为该菌株缺乏Ⅳ型分泌系统或者相关的信号转导通路, 导致CagA没有被转入AGS细胞. 由此我们推测H pylori发挥致病作用并不完全依赖于活菌的Ⅳ型分泌系统, 可能有其他的毒力因子参与了这个过程. 他们将H pylori活菌感染胃癌细胞AGS 4 h, 观察到有25%-48%的细胞发生迁移, 有56%-80%的细胞发生了蜂鸟表型, 并且发现蜂鸟表型只发生于CagA阳性的菌株, 但是在胃炎菌株P227和胃癌菌株P310中, 虽然CagA发生了磷酸化, 但是细胞没有发生蜂鸟表型, 这说明CagA磷酸化对于发生蜂鸟表型是必须的, 但是还不足以诱导细胞发生这种表型, 还有赖于其他毒力因子的参与才能引起蜂鸟表型.
我们将从临床分离得到的H pylori超声裂解, 刺激人胃癌细胞SGC-7901, 受H pylori刺激的细胞发生了蜂鸟表型, 活动性提高, 细胞内应激纤维也较对照组增多. 这一结果提示我们H pylori刺激人胃癌细胞SGC-7901后, 其毒力作用并不是完全依赖于CagA, 可能有其他毒力因子通过某些途径参与其致病过程. 因活化的RhoA可引起细胞发生一系列反应, 如细胞内细胞骨架的重排[14], 增强肿瘤侵袭性[15], 促进细胞的活动[16]等, 并且印亦萍 et al[8]已证实H pylori超声提取物刺激SGC-7901后, 活性RhoA表达增强, 而总RhoA表达量没有变化. 还有研究报道H pylori生物活性物质是通过顺式转录调控元件SRE调控细胞基因表达的[17]. 所有这些都提示我们H pylori超声提取物刺激人胃癌细胞SGC-7901后, 可能通过细胞内一系列信号转导通路, 使RhoA的活性得到提高, 促使细胞迁移性增强, 骨架发生重排引起细胞发生蜂鸟表型. 这一结果的发现为我们了解H pylori感染后疾病的发生发展提供了线索, 有助于加深对H pylori的致病机制的认识. 然而, H pylori超声提取物中哪些毒力因子参与了其致病机制, 又是通过什么受体, 什么信号通路作用于宿主细胞, 这种细胞内转导通路与CagA有无相关性, 这些问题都有待于进一步研究.
幽门螺杆菌感染是胃炎、胃溃疡、十二指肠溃疡以及胃癌的主要病因之一, 1994年国际癌症机构已将其列为Ⅰ级致癌原. RhoA是Rho家族的重要成员之一, 他参与了细胞形态改变, 迁移, 细胞骨架的调节, 胞质分裂, 平滑肌收缩和肿瘤浸润等一系列生物学过程.
黄晓东, 副主任医师, 武汉市中心医院消化内科.
H pylori发现以来, 其致病机制一直是研究的焦点, 然而其作用于人体细胞后如何导致临床疾病的发生仍有待于进一步研究.
印亦萍 et al证实H pylori超声提取物刺激人胃癌细胞SGC-7901后, 可提高细胞内RhoA的活性; Backert et al将H pylori活菌感染胃癌细胞AGS 4 h, 观察到有25%-48%的细胞发生迁移, 56%-80%的细胞发生蜂鸟表型, 且发现蜂鸟表型只发生于CagA阳性的菌株.
本研究将临床分离得到的H pylori超声裂解, 以超声提取物刺激人胃癌细胞SGC-7901, 观察细胞形态学的改变, 不同于以往以活菌刺激细胞后观察其改变.
本研究为H pylori感染后疾病的发生发展提供了线索, 有助于加深对H pylori的致病机制的认识.
"蜂鸟"型: 细胞中的针尖样突出, 有一个或多个, 长度为20-70 μm, 大于2倍的细胞直径.
本研究结果明确, 证据充足, 有系统的理论分析和有价值的科学结论, 其科学性, 创新性和可读性均能较好地反映我国胃肠病学基础研究的先进水平.
编辑: 李军亮 电编:吴鹏朕
| 1. | Stolte M, Bayerdorffer E, Morgner A, Alpen B, Wundisch T, Thiede C, Neubauer A. Helicobacter and gastric MALT lymphoma. Gut. 2002;50 Suppl 3:III19-III24. [PubMed] [DOI] |
| 2. | Ando T, Goto Y, Maeda O, Watanabe O, Ishiguro K, Goto H. Causal role of Helicobacter pylori infection in gastric cancer. World J Gastroenterol. 2006;12:181-186. [PubMed] [DOI] |
| 3. | Danesh J. Helicobacter pylori infection and gastric cancer: systematic review of the epidemiological studies. Aliment Pharmacol Ther. 1999;13:851-856. [PubMed] [DOI] |
| 4. | Keely PJ. Rho GTPases as early markers for tumour progression. Lancet. 2001;358:1744-1745. [PubMed] [DOI] |
| 5. | Raftopoulou M, Hall A. Cell migration: Rho GTPases lead the way. Dev Biol. 2004;265:23-32. [PubMed] [DOI] |
| 6. | Sahai E, Marshall CJ. RHO-GTPases and cancer. Nat Rev Cancer. 2002;2:133-142. [PubMed] [DOI] |
| 7. | Liu N, Bi F, Pan Y, Sun L, Xue Y, Shi Y, Yao X, Zheng Y, Fan D. Reversal of the malignant phenotype of gastric cancer cells by inhibition of RhoA expression and activity. Clin Cancer Res. 2004;10:6239-6247. [PubMed] [DOI] |
| 8. | 印 亦萍, 张 尤历, 陈 永昌, 王 文兵, 陈 劲频, 王 瑛, 吴 莺. 幽门螺杆菌对胃癌细胞RhoA表达和活性的影响. 江苏大学学报·医学版. 2007;7:298-301. |
| 9. | Odenbreit S, Puls J, Sedlmaier B, Gerland E, Fischer W, Haas R. Translocation of Helicobacter pylori CagA into gastric epithelial cells by type IV secretion. Science. 2000;287:1497-1500. [PubMed] [DOI] |
| 10. | Tsutsumi R, Takahashi A, Azuma T, Higashi H, Hatakeyama M. Focal adhesion kinase is a substrate and downstream effector of SHP-2 complexed with Helicobacter pylori CagA. Mol Cell Biol. 2006;26:261-276. [PubMed] [DOI] |
| 11. | Stein M, Bagnoli F, Halenbeck R, Rappuoli R, Fantl WJ, Covacci A. c-Src/Lyn kinases activate Helicobacter pylori CagA through tyrosine phosphorylation of the EPIYA motifs. Mol Microbiol. 2002;43:971-980. [PubMed] [DOI] |
| 12. | Kontaridis MI, Eminaga S, Fornaro M, Zito CI, Sordella R, Settleman J, Bennett AM. SHP-2 positively regulates myogenesis by coupling to the Rho GTPase signaling pathway. Mol Cell Biol. 2004;24:5340-5352. [PubMed] [DOI] |
| 13. | Backert S, Schwarz T, Miehlke S, Kirsch C, Sommer C, Kwok T, Gerhard M, Goebel UB, Lehn N, Koenig W. Functional analysis of the cag pathogenicity island in Helicobacter pylori isolates from patients with gastritis, peptic ulcer, and gastric cancer. Infect Immun. 2004;72:1043-1056. [PubMed] [DOI] |
| 14. | Schoenwaelder SM, Petch LA, Williamson D, Shen R, Feng GS, Burridge K. The protein tyrosine phosphatase Shp-2 regulates RhoA activity. Curr Biol. 2000;10:1523-1526. [PubMed] [DOI] |
| 15. | Yoshioka K, Nakamori S, Itoh K. Overexpression of small GTP-binding protein RhoA promotes invasion of tumor cells. Cancer Res. 1999;59:2004-2010. [PubMed] |
| 16. | Ridley AJ. Rho GTPases and cell migration. J Cell Sci. 2001;114:2713-2722. [PubMed] |
| 17. | 李 璟妍, 汤 燕, 王 瑛, 王 华, 陈 永昌. 幽门螺杆菌调控胃上皮细胞基因表达的机制. 江苏大学学报·医学版. 2006;16:13-15. |