修回日期: 2008-02-17
接受日期: 2008-03-08
在线出版日期: 2008-03-28
随着肝脏部分切除手术特别是活体肝移植的开展, 肝脏的分段解剖越来越为肝脏外科医生所关注. 特别是活体肝移植供肝切除术的术前评估, 需要更精确的影像学资料来了解患者肝脏的分段及其变异情况. 1954年Couinaud提出了较为完备的八段法功能解剖, 在当今的临床实践中已得到了广泛的应用. Couinaud肝段划分法尽管比较准确和实用, 但亦有明显的缺陷, 即他是离体肝铸型的研究结果, 其方位术语是对桌面而言, 不尽符合在体肝的实际情况. 随着肝脏手术的进展和活体肝移植的开展以及影像学技术的发展和解剖学研究的深入, 发现肝脏的分段解剖具有显著的个体差异性, 因而对于患者术前肝脏解剖情况的个体评价显得尤为重要.
引文著录: 沈柏用, 施源. 肝脏分段解剖的新认识. 世界华人消化杂志 2008; 16(9): 913-918
Revised: February 17, 2008
Accepted: March 8, 2008
Published online: March 28, 2008
Radiologists have become increasingly interested in segmental anatomy of human liver, especially in view of the need for an accurate preoperative localization of focal hepatic lesions and preoperative appraisal of living donor liver transplantation. The method proposed by Couinaud in 1964 to divide the liver into 8 surgically relevant segments longitudinally along the hepatic veins and transversely through the right and left portal pedicles, has been widely accepted. Although this method may be used in some patients, from a morphologic point of view, it is questionable because of the variation in segmental anatomy of human liver. In this review, reclassification of segmental anatomy of liver is described.
- Citation: Shen BY, Shi Y. Reclassification of segmental anatomy of liver. Shijie Huaren Xiaohua Zazhi 2008; 16(9): 913-918
- URL: https://www.wjgnet.com/1009-3079/full/v16/i9/913.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i9.913
肝脏是人体中最大的实质性脏器, 解剖学研究结果显示肝脏是一分段性器官, 每一肝段都有他独立的独管道系统, 可以作为一个外科切除单位. 肝脏解剖学的研究, 反过来亦促进了肝外科的发展. 随着肝脏部分切除手术的开展, 肝脏的分段解剖也越来越为肝脏外科医生所关注[1]. 特别是肝脏部分切除术的术前评估, 需要更精确的影像学资料来了解患者肝脏的分段及其变异情况[2]. 肝的功能解剖概念最初由Cantlie于1898年提出. 国内, 上海第二军医大学吴孟超 et al在1950年时亦进行肝脏的解剖学研究, 提出了吴孟超五叶四段肝脏分叶法. 1950年中期时, Goldsmith and Woodburne[25]强调肝叶切除术应严格遵循肝脏内部的解剖, 因而提出规则性肝叶切除术的概念(regular hepatic lobectomy)[6]. 1951年瑞士的Hjortsjo[3]首次建立了肝脏管道铸型腐蚀标本和胆管造影的研究方法, 经过10例的观察提出肝动脉和肝胆管呈节段性分布, 并将肝脏分成内、外、后、前和尾5个段. 后来, Healey and Schroy[4]的进一步研究亦证实Hjortsj的发现, 在肝内门静脉的分布亦相同, 并根据通常的解剖学命名原则提出肝脏的分段命名系统. 1954年Couinaud[26]提出了较为完备的八段法功能解剖. 在当今的临床实践中已得到了广泛的应用.
Couinaud的肝段划分方法, 是以Glisson系统在肝内的分布为基础, 以肝静脉为分段界限. Glisson系统即肝门静脉、肝动脉、胆管在肝内的分、属支被结缔组织纤维鞘包绕而形成的三联管道系统, 似树枝状分布于肝内. 肝的各段均有Glisson系统的一个分支供血, 并引流胆汁, 而位于各段之间的肝静脉则引流相邻肝段的回血. 此每一个段可视为肝的功能解剖单位.
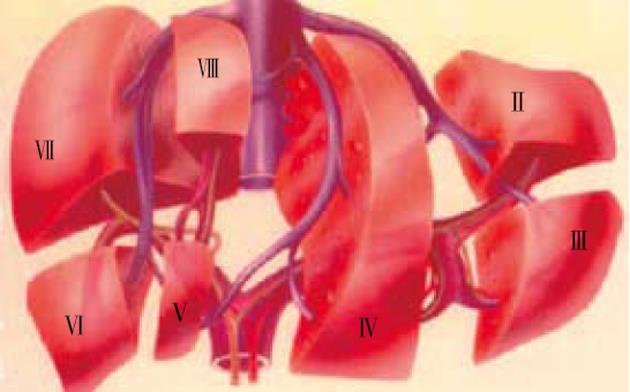
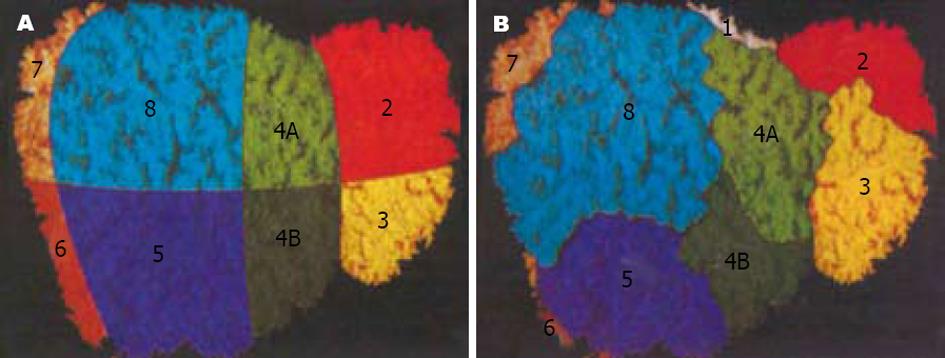
左、中、右3支主肝静脉走行区所形成的纵形切面(称为肝门静脉裂)将肝分隔成4个部分, 称为四个扇区. 每个扇区又被门静脉左、右支的水平切面分成上下2段. 4个扇区不包括尾状叶. 尾状叶编为Ⅰ段, 他是一个自主段, 因他不依赖于4个肝门静脉蒂和3支主肝静脉. 尾状叶同时接受来自左右门静脉和肝动脉的分支供血, 其静脉血经肝小静脉直接回流入下腔静脉. 肝中静脉切面(肝中裂)将肝分为左半肝和右半肝, 该切面与水平面形成一开口向左的75度夹角. 该切面的肝表位置为胆囊窝中部至腔静脉左缘连线. 肝左静脉切面(左叶间裂)将左半肝分为左外扇区和左内扇区. 以门静脉左支水平面为界, 左外扇区的上部为Ⅱ段, 下部为Ⅲ段. 左内扇区为Ⅳ段, 在外科临床上还可进一步分为上部的Ⅳa亚段和下部Ⅳb亚段.
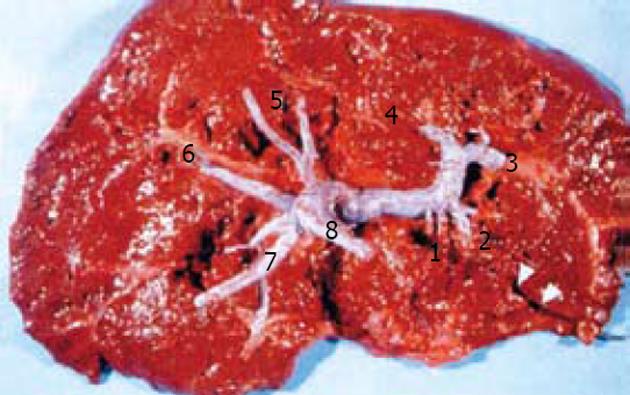
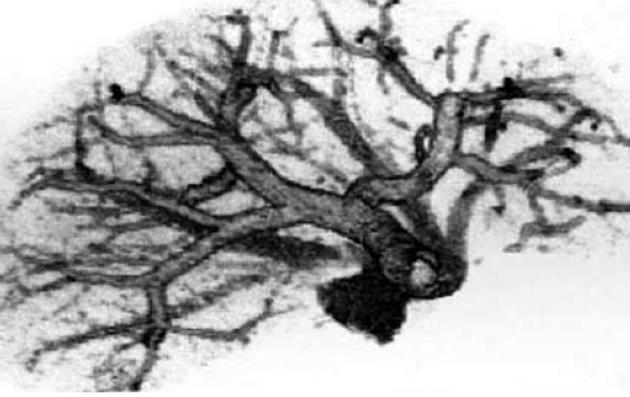
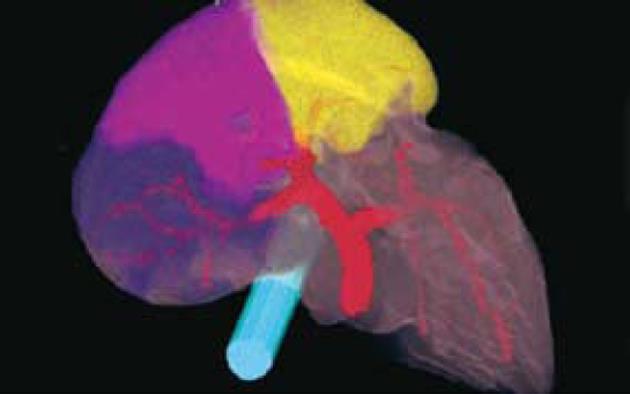
肝右静脉切面(右叶间裂)将右半肝分成右前扇区和右后扇区. 以门静脉右支水平面为界, 右前扇区上部为Ⅷ段, 下部为Ⅴ段. 右后扇区下部为Ⅵ段, 上部为Ⅶ段. 肝右静脉切面的肝表位置, 大致相当于肝前缘右角到胆囊窝右边连线中点处与肝静脉和下腔静脉汇合处的连线. Couinaud肝段解剖对肝外科具有重要意义. 由于每一肝段接受Glisson系统的一个分支, 特别是其中相对独立的门静脉系统的分支, 临床上根据病变情况可作最小范围的切除, 以尽可能保留正常肝组织. 由于以肝内血管结构作为分段的解剖基础和界线, 在CT图像上能够通过辨认肝静脉、门静脉及其他结构, 进行肝段的正确定位[14](图1-2).
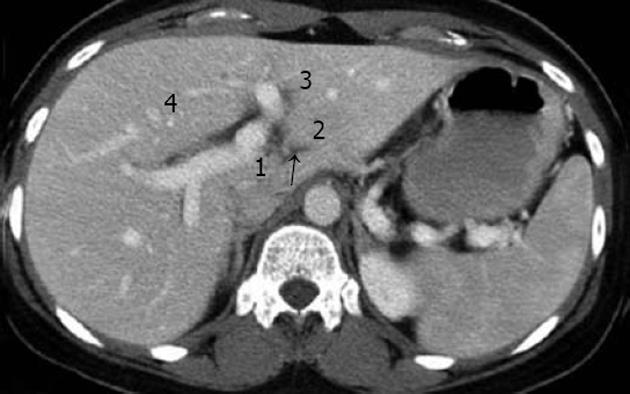
肝脏CT检查时, 可在下述4个层面上明确识别3支肝静脉和门静脉左、右支, 据此可在CT图像上明确区分各个肝段. 其他扫描层面则可参照与这4个层面的关系进行定位. (1)最头端的层面, 为3支主肝静脉和下腔静脉汇合的层面. (2)肝门静脉左支层面. (3)肝门静脉右支层面. (4)最尾端的层面, 为肝门静脉主干和胆囊水平的层面.
肝静脉: 从CT图象中可以看到, 肝静脉的3个主干, 肝左静脉、肝中静脉和肝右静脉, 呈"W"形排列, 汇入下腔静脉. 肝静脉可以作为以下肝段的分割标志: 肝左静脉左侧为Ⅱ段, 右侧为Ⅳ段; 肝中静脉左侧为Ⅳ段, 右侧为Ⅴ、Ⅷ段; 肝右静脉左侧为Ⅴ、Ⅷ段, 右侧为Ⅵ、Ⅶ段.
门静脉: 门静脉主干现分为左、右两大分支. 门静脉右支又分为右前支和右后支. 右前支为肝右叶前段的中心; 右后肢为肝右叶后段的中心. 门静脉左支的升部走形于节间裂, 为左外侧叶(Ⅱ, Ⅲ段)和左内叶(Ⅳ段)的分界.
门静脉的各个主要分支构成了各个肝段的中心, 从CT图象上可以看到在左、右半肝各形成一个"H"形, 将左半肝分为Ⅰ-Ⅳ段, 右半肝分为Ⅴ-Ⅷ段(图3-4). 肝门静脉左支层面CT图像, 显示门静脉左支. 该层面为左半肝上、下部分的分界平面, 相当于Ⅱ、Ⅲ段及Ⅳa、Ⅳb亚段的分界面. 门静脉左支及其分支在该层面呈现一倒"H"形. 门静脉左支主干后方为Ⅰ段; 箭头所示为第Ⅱ段门静脉; 门静脉向前走行后又分为两支, 左侧为Ⅲ段门静脉, 右侧为Ⅳ段门静脉.
1.3.1 影像学上的缺陷: Couinaud肝段划分法尽管比较准确和实用, 但亦有明显的缺陷, 即他是离体肝铸型的研究结果, 其方位术语是对桌面而言的, 因此不尽符合在体肝的实际情况. 如右前叶与右后叶本是前后关系, 而Couinaud认为是内外关系; Ⅶ段与Ⅵ段本是上下关系, 而Couinaud认为是前后关系等. 另外, 该分段方法不能完全适应断层解剖和影像学发展需要.
为使Couinaud肝段划分方位术语符合在体肝的实际情况并适应断层解剖和影像学发展需要, 刘树伟 et al结合Goldsmith和Woodburne肝段划分法, 国内常用肝段划分法及近年来断层解剖、B超、CT与MR的研究资料, 将Couinaud肝段划分法修正如下: (1)正中裂: 即主门裂, 内有肝中静脉走行, 分肝为左右半肝, 直接分开相邻的左内叶(段Ⅳa和段Ⅳb)与右前叶(段Ⅴ和段Ⅷ). (2)左叶间裂: 内有左叶间静脉和门静脉左支矢状部走行, 分开左内叶(段Ⅳa和段Ⅳb)与左外叶(段Ⅱ和段Ⅲ). (3)左内叶: 段Ⅳa和段Ⅳb两个亚段之间并无肝裂相分, 鉴于门静脉左支大致居左半肝上下径的中份, 外科又有亚段切除的实例, 故以门静脉左支平面作为区分段Ⅳa和段Ⅳb的标志, 即门静脉左支平面以上为段Ⅳa, 以下为段Ⅳb. (4)左段间裂: 即左门裂, 内有肝左静脉走行, 分左外叶为上段(段Ⅱ)和下段(段Ⅲ). (5)背裂: 上起三大肝静脉出肝处, 下至第一肝门, 将尾状叶(段Ⅰ)同左内叶和右前叶分开. (6)右叶间裂: 即右门裂, 内有肝右静脉走行, 分开右前叶(段Ⅴ和段Ⅷ)与右后叶(段Ⅵ和段Ⅶ). (7)右段间裂: 即横裂, 内有门静脉右支. 门静脉右支平面以上为右前叶上段(段Ⅷ)和右后叶上段(段Ⅶ), 以下为右前叶下段(段Ⅴ)和右后叶下段(段Ⅵ)[7-9].
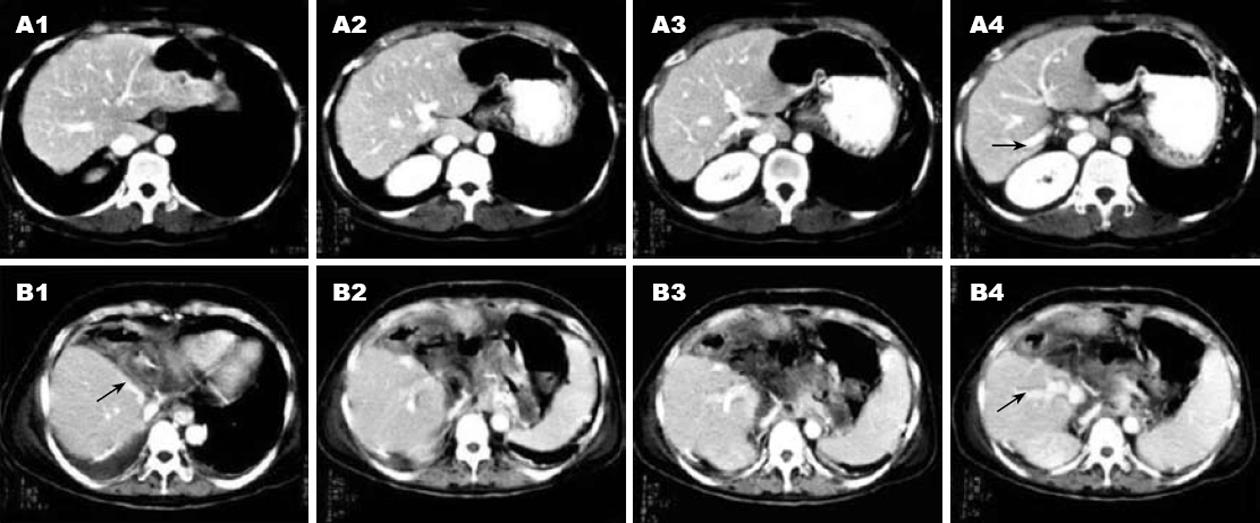
1.3.2 在右半肝肿块切除上的局限: Couinaud分段法虽然在许多患者的术前评价上有重要的指导意义, 然而在临床实践中也存在许多局限. Platzer和Maurer[18]指出肝脏的分段解剖在人群中存在很多变异, 无法用一种方法加以规范. Fasel et al[23]通过解剖的方法证实了肝静脉主干所在的平面无法精确地作为肝段的分界线. Nelson et al[24]通过增强CT, 对36例患者的术前肿瘤所在肝段的定位进行研究. 结果显示11例患者(31%)的肿瘤所在肝段CT表现与术中所见不一致.
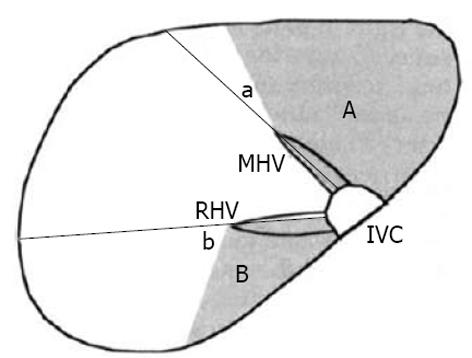
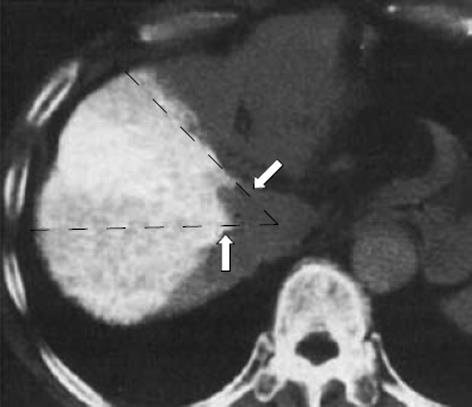
Ohashi et al[16]通过对CT下门静脉脉造影片的观察发现, 左、右半肝的分界线并非与肝中静脉汇入下腔静脉处所在的直线完全重叠; 同样, 右肝Ⅷ段与Ⅶ段的分界线也与肝右静脉所在直线成一定角度. 基于对大量病例的统计, 经肝动脉右前支造影所示的边界, 与肝右静脉所在直线成角平均为43.9±14.0度肝中静脉(HMV)与肝右静脉(HRV)所在的直线为传统理论上左、右半肝及右肝前、后叶的分界线. A、B为动脉注射造影剂后显示的左半肝及右肝后叶的范围, 实际边界与理论边界成角为a、b[16](图5-6).
通过对肝动脉右前支注射造影剂, 可以发现, 该患者的左、右半肝分界线与肝中静脉所在直线成角约5度, 而右肝Ⅷ段与Ⅶ段的真实分界与肝右静脉所在直线成大约40度角.
Nelson et al[24]的进一步研究发现, 肝脏的真是解剖分段情况与理论上的肝段分界线有较大的差异, 且更为复杂(图7). 肝脏的膈面, a为以Couinaud分段法标志的肝段分界线, b为经肝脏铸型所示的实际分界线, 两者存在较大差异[17].
Strunk et al[27]认为, 在肝段切除术的术前评估中, 行CT薄层扫描和3D重建, 有助于了解患者肝脏分段解剖的个体特征, 从而对肝段切除范围作出正确判断.
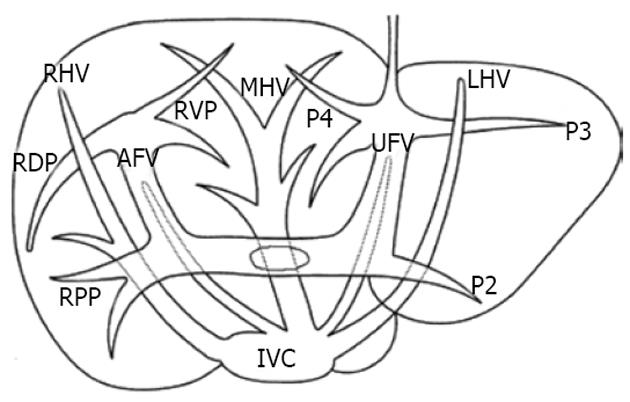
门静脉右后支的变异: Cho et al对60例患者进行CTAP检查后的门静脉3D重建图像进行了研究, 统计结果显示, 60例患者中42例(70%)门静脉右后支分支情况于Couinaud分段不一致, Ⅵ、Ⅶ段没有明显界限. 仅18例(30%)患者的门静脉右后支分为上、下两支, 分别进入Ⅵ、Ⅶ段, 符合Couinaud分段法[19](图8).
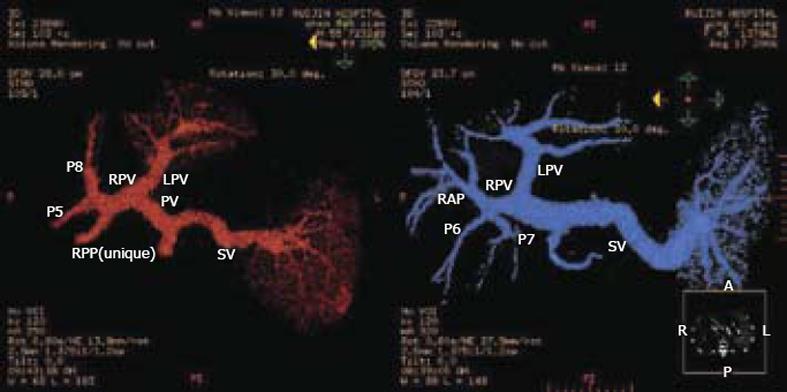
Cho et al[20]在外科实践中发现右半肝前叶, 即Couinaud Ⅴ、Ⅷ段的位置关系并非通常所说的上下关系, 而是腹侧于背侧的关系. 进一步研究发现, 几乎所有从肝门静脉右前支所发出的分支都分成腹侧和背侧两个方向, 据此将门静脉右前支分为腹侧段(RVP)和背侧段(RDP). 又通过CT的3D重建图象和体积测定发现, RVP和RDP与右后段(RPP)体积大致相等. 故认为可将右半肝分为三段, 即腹侧段、背侧段与右后段(图9-11). 右肝Ⅵ、Ⅶ段在活体肝移植中的应用, Kim et al[28]利用成人右肝Ⅵ、Ⅶ段, 成功完成一例活体肝移植, 供体为一46岁女性. 该供体肝门静脉右前支从左支根部发出, 而右后支则直接从门静脉主干发出. 经测定, 供体肝脏总体积为912.6 mL. 左半肝、右前段与右后段的体积分别为287.5 mL、287.0 mL、340.1 mL(图12).
Couinaud分段法虽然被视为经典而广泛应用, 但仍然具有不可避免的局限性. 随着肝脏手术的进展以及影像学技术的发展和解剖学研究的深入, 发现肝脏的分段解剖具有显著的个体差异性, 尤其是右半肝的分段与Couinaud分段法相比存在较大差异. 研究表明, 大部分患者肝脏的Ⅵ、Ⅶ段之间不存在明显分界, 各肝段之间的实际分界线也与经典理论存在差异, 因此术前充分了解患者肝脏解剖结构的特点是十分重要的.
对肝内血管解剖结构和肝段的准确认识是肝脏切除术前评估和活体肝移植移植肝段选择的基础. 特别是活体肝移植供体肝段的选择, 需要考虑到肝段的容积、门脉及动脉血供和静脉回流, 更需要对肝内各管道的解剖结构有精确的把握. 利用三维CT、计算机辅助技术及血管造影相结合, 将进一步提高影像学肝段定位的准确性. 通过对立体化影像的观察, 能够个体化分析患者肝脏内血管的分支及走形, 从而最大程度地减少肝切除术中出血及术后并发症, 更能为活体肝移植供体肝段的选择提供可靠的影像学依据.
肝脏是人体中最大的实质性脏器, 解剖学研究结果显示肝脏是一分段性器官, 每一肝段都有他独立的独管道系统, 可以作为一个外科切除单位. 肝脏解剖学的研究, 反过来亦促进了肝外科的发展. 随着肝脏部分切除手术的开展, 肝脏的分段解剖也越来越为肝脏外科医生所关注. 对肝内血管解剖结构和肝段的准确认识是肝脏切除术前评估和活体肝移植移植肝段选择的基础.
崔云甫, 教授, 哈尔滨医科大学第二附属医院普外一科.
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
肝的功能解剖概念最初由Cantlie于1898年提出. 国内, 上海第二军医大学吴孟超 et al在50年代时亦进行肝脏的解剖学研究, 提出了吴孟超五叶四段肝脏分叶法. 50年代中期时, Goldsmith and Woodburne强调肝叶切除术应严格遵循肝脏内部的解剖, 因而提出规则性肝叶切除术的概念(regular hepatic lobectomy). 1951年瑞士的Hjortsjo首次建立了肝脏管道铸型腐蚀标本和胆管造影的研究方法, 经过10例的观察提出肝动脉和肝胆管呈节段性分布, 并将肝脏分成内、外、后、前和尾5个段. 后来, Healey and Schroy的进一步研究亦证实Hjortsj的发现, 在肝内门静脉的分布亦相同, 并根据通常的解剖学命名原则提出肝脏的分段命名系统. 1954年Couinaud提出了较为完备的八段法功能解剖. 在当今的临床实践中已得到了广泛的应用.
本文从临床实际出发, 结合影像学, 解剖学的发展, 发现肝脏的分段解剖具有显著的个体差异性. 为手术前对肝脏解剖情况的评估尤为重要, 对活体肝移植的成功实行有深远的理论指导意义.
1 超分子化学: 多个分子间以非共价键紧密结合形成的分子聚合体, 具有新的选择、识别、信息传递、能量转移等一系列特定功能和性质; 他包括诸如"主-客体化学"、"超分子器件"、"超分子开关"等一系列全新的科学概念.
2 超分子药物: 是由主体药物分子和特别的客体分子在一定的条件下, 通过分子间的非共价键力, 组装成结构稳定的超分子, 他们改进了药物的稳定性和在人体内的运输机制.
本文立题明确, 选用参考文献新颖, 图片清晰, 论据充分, 结论可信.
编辑: 程剑侠 电编:何基才
| 1. | Sugarbaker PH. En bloc resection of hepatic segments 4B, 5 and 6 by transverse hepatectomy. Surg Gynecol Obstet. 1990;170:250-252. [PubMed] |
| 2. | Soyer P, Bluemke DA, Bliss DF, Woodhouse CE, Fishman EK. Surgical segmental anatomy of the liver: demonstration with spiral CT during arterial portography and multiplanar reconstruction. AJR Am J Roentgenol. 1994;163:99-103. [PubMed] [DOI] |
| 3. | Hjortsjo CH. The topography of the intrahepatic duct systems. Acta Anat (Basel). 1951;11:599-615. [PubMed] [DOI] |
| 4. | Healey JE Jr, Schroy PC. Anatomy of the biliary ducts within the human liver; analysis of the prevailing pattern of branchings and the major variations of the biliary ducts. AMA Arch Surg. 1953;66:599-616. [PubMed] [DOI] |
| 5. | Bismuth H. Surgical anatomy and anatomical surgery of the liver. World J Surg. 1982;6:3-9. [PubMed] [DOI] |
| 6. | Goldsmith NA, Woodburne RT. The surgical anatomy pertaining to liver resection. Surg Gynecol Obstet. 1957;105:310-318. [PubMed] |
| 8. | 裘 法祖, 王 健本, 张 祜曾. 腹部外科临床解剖学. 第1版. 济南: 山东科学技术出版社 2001; 146-153. |
| 9. | Couinaud C. Surgical anatomy of the liver. Several new aspects. Chirurgie. 1986;112:337-342. [PubMed] |
| 10. | van Leeuwen MS, Noordzij J, Fernandez MA, Hennipman A, Feldberg MA, Dillon EH. Portal venous and segmental anatomy of the right hemiliver: observations based on three-dimensional spiral CT renderings. AJR Am J Roentgenol. 1994;163:1395-1404. [PubMed] [DOI] |
| 11. | Downey PR. Radiologic identification of liver segments. AJR Am J Roentgenol. 1994;163:1267-1268. [PubMed] [DOI] |
| 12. | Ohashi I, Ina H, Okada Y, Yoshida T, Gomi N, Himeno Y, Hanafusa K, Shibuya H. Segmental anatomy of the liver under the right diaphragmatic dome: evaluation with axial CT. Radiology. 1996;200:779-783. [PubMed] [DOI] |
| 13. | Rieker O, Mildenberger P, Hintze C, Schunk K, Otto G, Thelen M. Segmental anatomy of the liver in computed tomography: do we localize the lesion accurately? Rofo. 2000;172:147-152. [PubMed] [DOI] |
| 14. | Lafortune M, Madore F, Patriquin H, Breton G. Segmental anatomy of the liver: a sonographic approach to the Couinaud nomenclature. Radiology. 1991;181:443-448. [PubMed] [DOI] |
| 15. | Mukai JK, Stack CM, Turner DA, Gould RJ, Petasnick JP, Matalon TA, Doolas AM, Murakami M. Imaging of surgically relevant hepatic vascular and segmental anatomy. Part 1. Normal anatomy. AJR Am J Roentgenol. 1987;149:287-292. [PubMed] [DOI] |
| 16. | Ohashi I, Ina H, Okada Y, Yoshida T, Gomi N, Himeno Y, Hanafusa K, Shibuya H. Segmental anatomy of the liver under the right diaphragmatic dome: evaluation with axial CT. Radiology. 1996;200:779-783. [PubMed] [DOI] |
| 17. | Fasel JH, Selle D, Evertsz CJ, Terrier F, Peitgen HO, Gailloud P. Segmental anatomy of the liver: poor correlation with CT. Radiology. 1998;206:151-156. [PubMed] [DOI] |
| 18. | Platzer W, Maurer H. On the segmental arrangement of the liver. Acta Anat (Basel). 1966;63:8-31. [PubMed] [DOI] |
| 19. | Cho A, Okazumi S, Miyazawa Y, Makino H, Miura F, Ohira G, Yoshinaga Y, Tohma T, Kudo H, Matsubara K. Proposal for a reclassification of liver based anatomy on portal ramifications. Am J Surg. 2005;189:195-199. [PubMed] [DOI] |
| 20. | Cho A, Okazumi S, Makino H, Miura F, Ohira G, Yoshinaga Y, Toma T, Kudo H, Matsubara K, Ryu M. Relation between hepatic and portal veins in the right paramedian sector: proposal for anatomical reclassification of the liver. World J Surg. 2004;28:8-12. [PubMed] [DOI] |
| 21. | Cho A, Okazumi S, Makino H, Miura F, Shuto K, Mochiduki R, Tohma T, Kudo H, Matsubara K, Gunji H. Anterior fissure of the right liver--the third door of the liver. J Hepatobiliary Pancreat Surg. 2004;11:390-396. [PubMed] [DOI] |
| 22. | Kogure K, Kuwano H, Fujimaki N, Ishikawa H, Takada K. Reproposal for Hjortsjo's segmental anatomy on the anterior segment in human liver. Arch Surg. 2002;137:1118-1124. [PubMed] [DOI] |
| 23. | Fasel JH, Gailloud P, Grossholz M, Bidaut L, Probst P, Terrier F. Relationship between intrahepatic vessels and computer-generated hepatic scissurae: an in vitro assay. Surg Radiol Anat. 1996;18:43-46. [PubMed] [DOI] |
| 24. | Nelson RC, Chezmar JL, Sugarbaker PH, Murray DR, Bernardino ME. Preoperative localization of focal liver lesions to specific liver segments: utility of CT during arterial portography. Radiology. 1990;176:89-94. [PubMed] [DOI] |
| 25. | Goldsmith NA, Woodburne RT. The surgical anatomy pertaining to liver resection. Surg Gynecol Obstet. 1957;105:310-318. [PubMed] |
| 26. | Couinaud C. The anatomy of the liver. Ann Ital Chir. 1992;63:693-697. [PubMed] |
| 27. | Strunk H, Stuckmann G, Textor J, Willinek W. Limitations and pitfalls of Couinaud's segmentation of the liver in transaxial Imaging. Eur Radiol. 2003;13:2472-2482. [PubMed] [DOI] |
| 28. | Kim SH, Suh KS, Kim SB, Lee HJ, Lee KU. Adult living donor liver transplantation using right posterior segment. Transpl Int. 2003;16:689-691. [PubMed] [DOI] |