修回日期: 2008-01-03
接受日期: 2008-01-15
在线出版日期: 2008-03-08
目的: 研究供体骨髓来源的未成熟树突状细胞(imDC)联合CD40L mAb诱导大鼠小肠移植免疫耐受.
方法: 体外培养供体大鼠树突状细胞(DC), 实验动物分为3组, 受体于手术前分别预处理后进行小肠移植. A组(n = 15): 注射生理盐水; B组(n = 15): 注射供体来源的imDC; C组(n = 15): 同时注射供体来源的imDC+CD40L mAb. 观察受体存活时间(n = 6), 移植小肠病理学检查, 用ELISA法检测受体血清IL-2、INF-γ和IL-10水平(n = 5).
结果: C组受体动物存活时间明显长于A、B两组, 统计学有显著差异(22.67±7.09 d vs 7.17±1.47 d, 11.00±2.61 d, P<0.01), C组移植小肠炎性细胞浸润、黏膜结构破坏程度、血清IL-2、INF-γ水平均明显低于A、B组, 有统计学差异(IL-2: 225.4±48.7 ng/L vs 374.1±13.2 ng/L, 353.6±10.4 ng/L; INF-γ: 56.9±2.6 ng/L vs 229.2±20.6, 125.4±18.5 ng/L, P<0.05), 血清IL-10水平C组明显高于A、B组, 有统计学意义(186.4±10.6 ng/L vs 91.7±5.4, 162.2±8.1 ng/L, P<0.05).
结论: 联合应用CD40L mAb和imDC可抑制小肠移植后的排斥反应, 诱导受体产生免疫
耐受.
引文著录: 王海权, 陈涛, 徐皓, 肇毅, 吴文溪. 联合应用供体未成熟树突状细胞与CD40L mAb诱导大鼠小肠移植免疫耐受. 世界华人消化杂志 2008; 16(7): 763-766
Revised: January 3, 2008
Accepted: January 15, 2008
Published online: March 8, 2008
AIM: To investigate the combined effects of CD40L monoclonal antibody (mAb) and immature dendritic cells on donor-specific immune tolerance in rats undergoing small intestinal transplantation.
METHODS: DCs were collected from bone marrow progenitor cells of Wistar rats cultured with granulocyte macrophage colony stimulating factor (GM-CSF) and interleukin-4 (IL-4) in vitro. Seven days before transplantation of small intestine from Wistar donor rats, normal saline (group A, n = 15), immature dendritic cells (group B, n = 15), and immature dendritic cell anti-CD40L plus monoclonal antibody (group C, n = 15) were infused intravenously into SD recipient rats (n = 15), respectively. Small bowel transplantation was performed and the survival time of recipients was observed (n = 6). Histopathological examination was evaluated, and serum IL-2, IL-10 and interferon-γ (INF-γ) levels were measured by enzyme-linked immunosorbent assay (ELISA) (n = 5).
RESULTS: The survival time of recipients in group C was significantly longer than that in group A and group B (22.67 ± 7.09 d vs 7.17 ± 1.47 d, 11.00 ± 2.61 d, P < 0.01). The degree of the inflammatory infiltrated cells and intestinal mucosal structural destruction were significantly milder in group C. The concentration of serum IL-2 and INF-γ was much lower in group C than in group A and group B (IL-2: 225.4 ± 48.7 ng/L vs 374.1 ± 13.2, 353.6 ± 10.4 ng/L; INF-γ: 56.9 ± 2.6 ng/L vs 229.2 ± 20.6, 125.4 ± 18.5 ng/L, P < 0.05). The concentration of serum IL-10 was obviously higher in group C than in group A and group B (186.4 ± 10.6 ng/L vs 91.7 ± 5.4, 162.2 ± 8.1 ng/L, P < 0.05).
CONCLUSION: The pretreatment with immature donor dendritic cells plus anti-CD40L mAb can induce immune tolerance and prolong small bowel allograft survival after transplantation.
- Citation: Wang HQ, Chen T, Xu H, Zhao Y, Wu WX. Combination of immature dendritic cells and anti-CD40L monoclonal antibody induces immune tolerance of intestinal allograft in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(7): 763-766
- URL: https://www.wjgnet.com/1009-3079/full/v16/i7/763.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i7.763
树突状细胞(DC)是分布广泛的抗原呈递细胞, 具有极强的抗原呈递能力, 不仅能激活静息型T细胞启动免疫排斥反应, 而且由于未成熟树突状细胞(imDC)几乎不表达MHC抗原, 协同刺激分子CD80和CD86极低, 可诱导T细胞的无能或凋亡. 共刺激通路在T细胞激活和同种免疫反应中的作用非常重要. CD40/CD40L是其中两大经典途径之一, 在以往的器官移植实验中他已成为研究免疫抑制的主要靶点[1-2]. 本研究采用CD40L单抗阻断共刺激途径之一的CD40/CD40L通路, 以期增强imDC在诱导大鼠小肠移植免疫耐受中的作用, 并探讨移植后Th1、Th2细胞因子IL-2、IL-10和INF-γ在其中的作用.
♂Wistar大鼠和SD大鼠, 体质量200±50 g, 清洁级, 购自中国科学院上海实验动物中心. 细胞培养基RPMI1640购自美国Gibco公司; 胎牛血清购自澳大利亚Hyclone公司; CD40L mAb、细胞因子rmGM-CSF、rmIL-4和IL-10 ELISA检测试剂盒购自美国R&D公司; 大鼠IL-2, INF-γ ELISA检测试剂盒购自上海晶美生物技术有限公司.
1.2.1 大鼠骨髓来源DC的培养: 参照Son et al[3]的方法, 稍作改动. 颈椎脱臼处死Wistar大鼠无菌手术取出股骨和胫骨, 冲洗出骨髓细胞, 以Tris-NH4Cl去红细胞, 不完全1640培养基洗涤2次, 溶于完全1640培养基置于无菌培养皿中, 在37 ℃孵箱中培养3 h, 收集非黏附细胞, 以6×105个细胞/孔加入24孔板培养, 用含rmGM-CSF和rmIL-4质量浓度各10 μg/L的DC培养液继续培养, 隔天换液. 培养d 6为imDC, 流式细胞术进行细胞表型分析.
1.2.2 大鼠异位节段性小肠移植模型的建立及分组: 参照Inoue et al[4]的方法, 将Wistar大鼠的小肠(长度为15 cm)移植给SD大鼠, 术后受体置于26-28 ℃环境中, 苏醒后即可进食固体颗粒饲料和水. 随机分为3组(n = 15). A组: 阴性对照组, 受体小肠移植术前7 d注射生理盐水; B组: 小肠移植前7 d, 受体经阴茎背iv供体的imDC, 细胞数为2×106个/只; C组: 小肠移植前7 d, 受体经阴茎背静脉注射供体的imDC, 细胞数为2×106个/只. 同时ip CD40L mAb 200 μg/只.
1.2.3 组织学分析: 于移植术后3、5、7和14 d, 4 g/L戊巴比妥钠(40 mg/kg)腹腔麻醉后取大鼠移植肠作常规HE染色组织学检查. 病理学检查参照Wilson et al[7]排斥反应分级对小肠移植排斥反应损伤的进行分级, 将排斥损伤分为轻、中、重度.
1.2.4 受体大鼠血清细胞因子检测: 移植术后第7天, 取受体外周血离心后, ELISA法检测血清中IL-2、IL-10和INF-γ水平, 按试剂盒说明书操作.
统计学处理 数据以mean±SD表示, 统计学分析采用方差分析检验各组细胞因子的水平差异. 采用SNK检验进一步分析组间差异. 生存曲线采用Log-rank检验. P<0.05认为差异具有显著性.
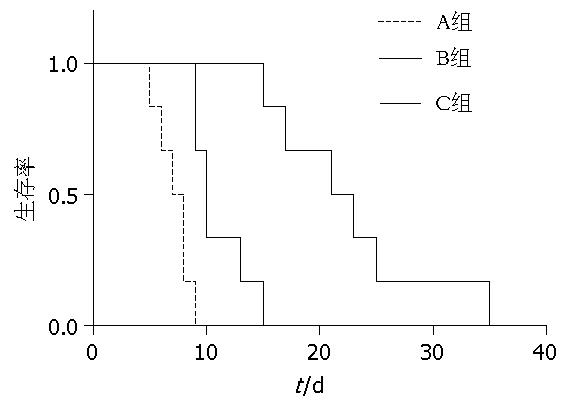
B组平均存活时间分别为11.00±2.61 d, 而A组术后生存率较低, 平均存活时间分别仅为7.17±1.47 d; C组平均存活时间为22.67±7.09 d, 显著延长受体大鼠小肠移植术后存活时间. C组平均存活时间显著高于A、B两组(P<0.01, 图1).
术后d 3开始, A、B和C组黏膜固有层、黏膜下层和肌层均有炎性细胞浸润, 浸润细胞主要为单核细胞和淋巴细胞. A、B组较C组浸润细胞明显增多, 可见小血管壁炎性细胞浸润, 管腔内血栓形成, 黏膜变薄, 绒毛及腺体隐窝变浅, 黏膜结构破坏, 随移植物的时间的延长变化逐渐加剧. 术后7 d绒毛结构明显消失, 黏膜部分脱落, 术后14 d黏膜几乎全部脱落, 留下肌层变薄, 有局灶性溶解和纤维素样坏死. C组术后3-14 d仅有黏膜层肿胀, 绒毛腺体结构和肌层破坏不明显.
C组受体大鼠血清IL-2质量浓度为显著低于A、B两组(225.4±48.7 ng/L vs 374.1±13.2 ng/L, 353.6±10.4 ng/L, P<0.05); C组受体大鼠血清INF-γ质量浓度为显著低于A、B两组(56.9±2.6 ng/L vs 229.2±20.6 ng/L, 125.4±18.5 ng/L, P<0.05); 同时组C受体大鼠血清IL-2质量浓度为显著高于A、B两组(186.4±10.6 ng/L vs 91.7±5.4 ng/L, 162.2±8.1 ng/L, P<0.05).
小肠移植已经从一个实验性研究发展成肠衰竭患者的可行治疗方法之一. 但是其仍面临着许多问题和挑战. 诱导供者特异性免疫耐受被认为可能是最终克服移植后排斥的有效途径[5-6].
在同种异体器官移植的排斥反应中, 受体T细胞应答是机体对抗原产生免疫反应或耐受的关键环节. 器官移植后, 通过受体T细胞直接或间接自我识别途径, 被激活供体和受体来源的DC细胞在移植排斥过程中扮演着重要的角色. DC递呈抗原表现为免疫激活还是免疫耐受取决于DC的表型、功能和成熟状态. imDC表面缺乏或低表达共刺激分子、黏附分子及MHC-Ⅱ类分子, 不能激活T细胞, 具有明显的耐受原性[7].
研究显示CD4O-CD40L旁路在移植排斥过程中也扮演重要的角色[8-9]. CD40-CD40L这种作用可能由其作为T细胞的共刺激信号直接途径或通过诱导B细胞表面CD80和CD86分子表达的间接途径实现. Hancock et al[10]报道, CD40信号通路在小鼠异位心脏移植模型中参与介导急性排斥反应, 应用MRI短暂阻断CD40通路能延长移植物存活时间. 但是单独使用CD40L mAb不能有效影响T细胞因子和B7分子的表达.
移植免疫的核心环节是T细胞的活化, 这包括CD4+T细胞Th及CD8+的细胞毒性T细胞(Tc). Th产生大量的细胞因子, 如IL-2, IL-10和IFN-γ等, 促进其他效应细胞活化并发挥功能, 而Tc可直接杀伤靶细胞. 本实验检测了移植后d 7 IL-2, IL-10, IFN-γ变化. 结果发现移植后imDC+CD40L mAb组大鼠Th1细胞因子IL-2、IFN-γ明显降低, 而Th2细胞因子IL-10明显升高, 与imDC组及对照组比较差异有显著统计学意义(P<0.05). Th1和Th2细胞均有Th0细胞分化而来. Th0细胞分泌的细胞因子有IL-2, IL-10, IFN-γ等. 在Th0细胞分化的初始阶段, 若加入Th2细胞因子如IL-10则抑制Th0向Th1分化; 若加入Th1细胞因子如IL-2、IFN-γ则抑制Th0向Th2分化. 在移植免疫应答中, 一般认为Th1细胞因子(主要是IL-2和IFN-γ等)参与介导排斥反应[11-12], 而Th2细胞因子(主要是IL-4和IL-10等)[13-14]可拮抗Th1细胞并抑制CTL细胞的功能, 从而诱导移植耐受. 机体在正常状态下Th1和Th2细胞功能处于动态平衡, 当机体受到异己抗原攻击时. Th1和Th2细胞中某一亚群功能增强, 另一亚群功能减弱, Lib Lau称该现象为"克隆转换". 我们的研究结果显示在imDC+CD40L mAb组Th1细胞因子IL-2、IFN-γ明显降低, 而Th2细胞因子IL-10明显升高. 抑制了Th1细胞活化, 从而抑制排斥的发生. Th1细胞向Th2细胞的偏移在移植免疫耐受的形成中发挥了重要的作用.
本研究通过联合应用imDC和CD40L mAb, 阻断imDC的CD40信号, 抑制imDC成熟, 以期增强imDC诱导小肠移植的免疫耐受. 研究结果发现: 联合使用imDC和CD40L mAb组与对照组和imDC组相比能够显著延长移植物的存活时间(P<0.01). 病理学检查结果可明显减轻同种异体排斥反应的发生. 血清中IL-2和INF-γ浓度显著降低. 同时血清中IL-10浓度明显升高. 其主要机制可能是阻断CD40信号, 抑制imDC的成熟, Th1细胞因子减少, 免疫应答的微环境遭到破坏. 阻断CD40信号, 这一免疫应答的机制不能启动, 从而减轻宿主T细胞对移植物攻击. 但其具体机制还很复杂, 需要进一步探讨.
小肠移植已经从一个实验性研究发展成肠衰竭患者的可行治疗方法之一. 但是其仍面临着许多问题和挑战. 诱导供者特异性免疫耐受被认为可能是最终克服移植后排斥的有效途径.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
未成熟树突状细胞(imDC)在诱导移植免疫耐受中具有重要作用, 如何抑制其成熟成为目前研究的热点.
近年有报道骨髓母细胞和CD40L单抗可以诱导同种异体移植物的生存时间, 提示CD40L单抗和来源于骨髓母细胞的imDC有可能在移植免疫耐受上有协同作用.
本实验从imDC与细胞因子IL-2、IL-10和INF-γ关系方面, 探讨其在免疫耐受的机制.
对DC进行不同方法的处理, 使之表达免疫抑制性细胞因子或分子, 其 可降低移植受者术后所需的免疫抑制剂剂量, 减少药物的毒副作用发生率, 提高器官移植的效果.
本文采用CD40L单抗阻断共刺激途径之一的CD40/CD40L通路, 以期增强供体来源, 未成熟DC在诱导大鼠小肠移植免疫耐受中的作用, 并探讨移植后TH1, TH2等细胞因子的作用, 具有一定的价值, 实验设计合理.
编辑: 程剑侠 电编: 郭海丽
| 1. | Wang Y, Dai H, Liu Z, Cheng X, Tellides G, Dai Z. Neutralizing IL-7 promotes long-term allograft survival induced by CD40/CD40L costimulatory blockade. Am J Transplant. 2006;6:2851-2860. [PubMed] [DOI] |
| 2. | Kanaya K, Tsuchida Y, Inobe M, Murakami M, Hirose T, Kon S, Kawaguchi S, Wada T, Yamashita T, Ishii S. Combined gene therapy with adenovirus vectors containing CTLA4Ig and CD40Ig prolongs survival of composite tissue allografts in rat model. Transplantation. 2003;75:275-281. [PubMed] [DOI] |
| 3. | Son YI, Egawa S, Tatsumi T, Redlinger RE, Kalinski P, Kanto T. A novel bulk-culture method for generating mature dendritic cells from mouse bone marrow cells. J Immunol Methods. 2002;262:145-157. [PubMed] [DOI] |
| 4. | Inoue S, Tahara K, Sakuma Y, Hori T, Uchida H, Hakamada Y, Murakami T, Takahashi M, Kawarasaki H, Hashizume K. Impact of graft length on surgical damage after intestinal transplantation in rats. Transpl Immunol. 2003;11:207-214. [PubMed] [DOI] |
| 5. | Markees TG, Pearson T, Cuthbert A, Pearson AL, Shultz LD, Leif J, Phillips NE, Mordes JP, Greiner DL, Rossini AA. Evaluation of donor-specific transfusion sources: unique failure of bone marrow cells to induce prolonged skin allograft survival with anti-CD154 monoclonal antibody. Transplantation. 2004;78:1601-1608. [PubMed] [DOI] |
| 6. | Xu H, Chen T, Wang HQ, Ji MJ, Zhu X, Wu WX. Prolongation of rat intestinal allograft survival by administration of donor interleukin-12 p35-silenced bone marrow-derived dendritic cells. Transplant Proc. 2006;38:1561-1563. [PubMed] [DOI] |
| 7. | Wilson NS, Villadangos JA. Lymphoid organ dendritic cells: beyond the Langerhans cells paradigm. Immunol Cell Biol. 2004;82:91-98. [PubMed] [DOI] |
| 8. | Li JM, Gorechlad J, Larsen CP, Waller EK. Apoptotic donor leukocytes limit mixed-chimerism induced by CD40-CD154 blockade in allogeneic bone marrow transplantation. Biol Blood Marrow Transplant. 2006;12:1239-1249. [PubMed] [DOI] |
| 9. | Perco P, Blaha P, Kainz A, Mayer B, Hauser P, Wekerle T, Oberbauer R. Molecular signature of mice T lymphocytes following tolerance induction by allogeneic BMT and CD40-CD40L costimulation blockade. Transpl Int. 2006;19:146-157. [PubMed] [DOI] |
| 10. | Hancock WW, Sayegh MH, Zheng XG, Peach R, Linsley PS, Turka LA. Costimulatory function and expression of CD40 ligand, CD80, and CD86 in vascularized murine cardiac allograft rejection. Proc Natl Acad Sci USA. 1996;93:13967-13972. [PubMed] [DOI] |
| 11. | Horwitz DA, Zheng SG, Gray JD. The role of the combination of IL-2 and TGF-beta or IL-10 in the generation and function of CD4+ CD25+ and CD8+ regulatory T cell subsets. J Leukoc Biol. 2003;74:471-478. [PubMed] [DOI] |
| 12. | Levay-Young B, Shearer JD, Gruessner AC, Kim SC, Nahkleh RE, Gruessner RW. Intestinal graft versus native liver cytokine expression in a rat model of intestinal transplantation: effect of donor-specific cell augmentation. Transplant Proc. 2004;36:399-400. [PubMed] [DOI] |
| 13. | Wilczynski JR, Radwan M, Kalinka J. The characterization and role of regulatory T cells in immune reactions. Front Biosci. 2008;13:2266-2274. [PubMed] [DOI] |
| 14. | Marinić I, Gagro A, Rabatić S. [Regulatory T cells]. Acta Med Croatica. 2006;60:447-456. [PubMed] |