修回日期: 2008-02-04
接受日期: 2008-02-15
在线出版日期: 2008-03-08
目的: 前瞻性研究多排螺旋CT(MDCT)定量评价胰腺癌血管侵犯和可切除性的价值.
方法: 胰腺癌42例术前进行MDCT检查, 采用表面容积重建法(VR)和多层面容积重建法(MPVR)对下腔静脉、腹腔干、门静脉及其分支进行三维血管重建分析, 结合原始图片评价胰腺癌及其胰腺周围血管, 并进行量化测量, 根据胰腺癌对周围血管的侵犯情况做出能否切除的术前评价, 以手术结果作为金标准进行对照和分析.
结果: 探查胰腺癌手术治疗患者42例的252支血管, 其中77支血管不同程度受侵犯, 其中腹腔干受侵12例, 敏感性84.6%, 特异性96.6%; 肠系膜上动脉受侵13例, 敏感性100%, 特异性96.7%; 肝动脉受侵9例, 敏感性81.2%, 特异性100%; 门静脉主干受侵16例, 敏感性93.3%, 特异性92.6%; 下腔静脉受侵犯6例, 敏感性100%, 特异性97.3%; 肠系膜上静脉受侵21例, 敏感性90%, 特异性86.7%. MDCT发现在栓子形成与手术结果完全相吻合. 在侵犯长度方面, 仅肠系膜上动静脉各有1例欠准确. 在受侵段与血管分支部位的距离测量方面, 仅肠系膜上动脉1例不准确.
结论: 胰腺癌术前MDCT血管三维重建能准确量化血管侵犯的范围和程度, 对可切除性评估具有重要的临床参考价值.
引文著录: 李震, 褚倩, 肖明, 沈亚琪, 宋金梅, 张进华, 胡道予. 定量术前评价胰腺癌血管侵犯多排CT技术. 世界华人消化杂志 2008; 16(7): 726-731
Revised: February 4, 2008
Accepted: February 15, 2008
Published online: March 8, 2008
AIM: To evaluate the clinical efficacy of multi-detector row computer tomography (MDCT) in the preoperative quantitative assessment of vascular involvement of pancreatic carcinoma.
METHODS: MDCT was performed on 42 pancreatic carcinoma patients; the celiac trunk and portal vein were reconstructed and their branches to three-dimension vessel were analyzed by volume rendering (VR) technique, multiplanar volume reconstruction (MPVR) and maximum intensity projection (MIP) technique. Combining the source images, the scope and extent of the vessel invaded in the portal vein celiac trunk, and inferior vena cava and their branches were evaluated and measured. Compared the CT scans results with operations and pathological sections, the diagnosis value of MDCT for pancreatic carcinoma was evaluated.
RESULTS: In the 42 pancreatic carcinoma patients with operation, 252 vessels were evaluated, 77 of which were invaded by carcinoma. Celiac trunks were invaded in 12 patients, and the sensitivity and specificity were 84.6% and 96.6%, respectively. Superior mesenteric arteries were invaded in 13 patients, and the sensitivity and specificity were 100% and 96.7%, respectively. Hepatic arteries were invaded in 9 patients, and the sensitivity and specificity were 81.2% and 100%, respectively. Portal veins were invaded in 16 patients, and the sensitivity and specificity were 93.3% and 92.6%, respectively. Inferior vena cava was invaded in 6 patients, and the sensitivity and specificity were 93.3% and 92.6%, respectively. Superior mesenteric veins were invaded in 21 patients, and the sensitivity and specificity were 90% and 86.7%, respectively. In the aspect of thrombosis, MDCT scan results were consistent with the surgical findings. Only one vessel of superior mesenteric artery and vein was not correctly measured in length by MDCT. When the length between invaded vessel and vessel branches was measured, only one patient's MDCT result was consistent with the surgical result on superior mesenteric artery.
CONCLUSION: MDCT can delineate the vascular involvement of pancreatic carcinoma with high accuracy, measure the invaded vessel correctly and provide valuable information for the preoperative assessment of pancreatic carcinoma.
- Citation: Li Z, Chu Q, Xiao M, Shen YQ, Song JM, Zhang JH, Hu DY. Quantitative preoperative assessment of vascular involvement in pancreatic carcinoma by multi-detector row computer tomography. Shijie Huaren Xiaohua Zazhi 2008; 16(7): 726-731
- URL: https://www.wjgnet.com/1009-3079/full/v16/i7/726.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i7.726
胰腺癌周围血管侵犯状况是评价肿瘤可切除性最重要的指标之一. 对于有无血管侵犯, 及其对手术的影响前人已经进行了一些研究[1-2], 其主要的研究范围集中在有无局部血管侵犯的定性的方面. 但是, 随着外科手术技术的进步, 以往不能够切除的部分发生血管侵犯的肿瘤可以采用血管移植, 动静脉吻合等方法进行切除, 并不是只要有血管侵犯就一定不能手术. 手术是否成功以及术式选择取决于血管侵犯的范围和程度[3]. 而目前对于血管侵犯的定量研究目前尚未见报道. 多排螺旋CT(MDCT)三维重建技术及其实时3D等多种强大的后处理功能的放射学新技术使得血管侵犯的定量分析成为可能[4-5], 可以清楚的显现动脉系统及其各分支血管的形态、走向, 精确测量各血管侵犯的长度和重要结构间距离, 并可了解是否存在动脉系统各分支的其他的病理情况[6-7]. 利用MDCT对胰腺癌患者周围血管侵犯状况评价进行定量研究, 旨在探讨MDCT在这方面的价值及其对临床治疗的指导作用.
回顾性分析2003-05/2005-05接受MDCT检查的胰腺癌患者61例, 男47例, 女14例, 年龄34-75(平均53)岁. 其中42例进行手术探查, 胰头部29例, 体尾部7例, 胰尾部6例. 9例行简单的根治性切除术, 11例行肿瘤切除术加部分血管切除术或人工代血管术, 22例行姑息手术或剖腹探查术. 检查前30 min, 受检者口服清水1000 mL以充盈胃及小肠, 采用美国GE公司 Lightspeed 16层螺旋CT扫描.
平扫电压120 kV, 电流250 mA, 层厚10 mm, 螺距1.375:1, 矩阵512×512[8-9], 随后进行双期增强扫描, 62.3 g/L的Ultravist 300, 总量80 mL, 3 mL/s流率利用高压注射器进行肘静脉团注, 开始注射后30和60 s后分别进行动脉期、静脉期双期扫描[10]. 增强扫描参数: 120 kV, 250 mA, 层厚10 mm, 螺距1.375:1, 矩阵512×512. 重建: 将10 mm层厚的增强图像薄层重建为1.25 mm层厚, 然后在工作站上采用ADW 4.0软件的进行重建. 利用表面容积重建法(VR), 多层面容积重建法(MVPR)和CT仿真内镜(CTVG)技术重建胰腺周围血管及其与肿瘤的三维图像[11-13], 包括腹腔动脉干、肠系膜上动脉、肝动脉、门静脉、下腔静脉和肠系膜上静脉, 以获得三维图像. 由2位放射科主治医师和2位教授采取两级读片形式进行报告, 并依照Loyer et al的标准对胰腺癌与血管的关系判断血管侵犯的范围和程度, 并将血管侵犯状况进行量化测量. Loyer et al[14]将胰腺癌与血管的关系分为6型: A型, 肿瘤和/或正常胰腺与邻近血管之间有脂肪分隔; B型, 低密度肿瘤与血管之间有正常胰腺组织; C型, 低密度肿瘤与血管为凸面点状接触; D型, 低密度肿瘤与血管为凹面接触, 或部分包绕血管; E型, 低密度肿瘤包绕邻近血管, 两者之间脂肪间隔模糊或消失; F型, 肿瘤阻塞血管. 将发生肿瘤侵犯的血管在MPR三维重建图像上结合原始轴位图像进行测量, 测量受侵犯段的长度, 距离上级血管分支处的长度和下一级血管分枝处的长度. 其中42例患者手术中探查, 术中均由术者探查胰周主要6支血管的状况, 包括腹腔动脉干、肠系膜上动脉、肝动脉、门静脉主干、下腔静脉和肠系膜上静脉. 以手术结果作为金标准进行对照和分析.
统计学处理 采用Kappa检验, 评价MDCT在胰腺癌术前可切除性评估的临床应用价值.
共计探查42例患者中的252支血管. 其中175支血管未受侵犯, 其余77支血管不同程度的侵犯. 12例患者腹腔动脉干受侵犯, MDCT估计过高2例, 估计过低1例; 13例患者肠系膜上动脉受侵犯, MDCT估计过高0例, 估计过低1例; 9例患者肝动脉受侵犯, MDCT估计过高2例, 估计过低0例; 16例患者门静脉主干受侵犯, MDCT估计过高1例, 估计过低2例; 6例患者下腔静脉受侵犯, MDCT估计过高0例, 估计过低1例; 21例患者肠系膜上静脉受侵犯, MDCT估计过高2例, 估计过低3例(表1).
| 血管 | 敏感性 | 特异性 |
| 腹腔动脉干 | 84.6 | 96.6 |
| 肠系膜上动脉 | 100.0 | 96.7 |
| 肝动脉 | 81.2 | 100.0 |
| 门静脉主干 | 93.3 | 92.6 |
| 下腔静脉 | 100.0 | 97.3 |
| 肠系膜上静脉 | 90.0 | 86.7 |
分别测量77支受侵血管的长度, 范围与程度, 与上一级和下一级血管分支部位的距离, 有无血栓形成, 血栓的长度等, 并与手术中的结果相对照(表2).
| 血管 | 侵犯长度>2 cm MDCT/手术 | 距血管分叉<1 cm MDCT/手术 | 有血栓MDCT/手术 | 总计 |
| 腹腔动脉干 | 0/0 | 13/13 | 0/0 | 13 |
| 肠系膜上动脉 | 5/6 | 4/4 | 2/2 | 12 |
| 肝动脉 | 1/1 | 2/2 | 1/1 | 9 |
| 门静脉主干 | 5/5 | 6/6 | 7/7 | 16 |
| 下腔静脉 | 2/2 | 0/0 | 0/0 | 6 |
| 肠系膜上静脉 | 7/6 | 5/5 | 6/6 | 21 |
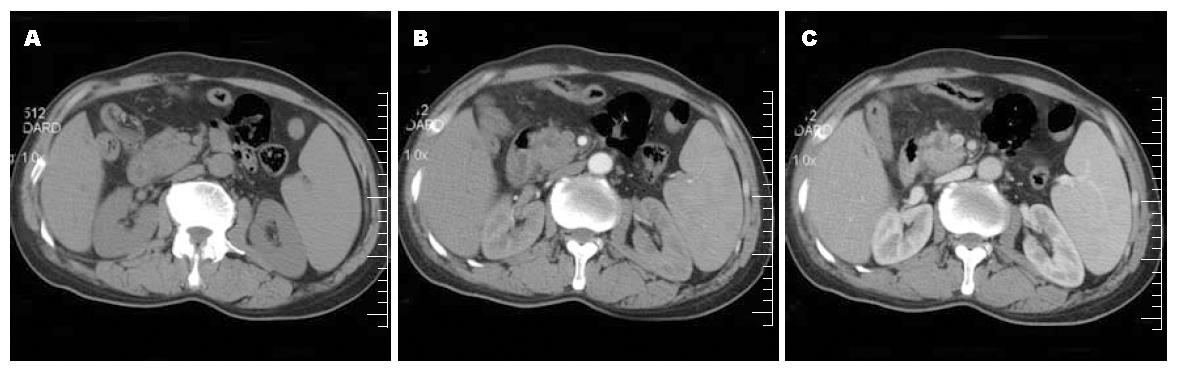
CT平扫见胰头钩突部等密度影, 十二指肠推压; CT动脉期增强见肠系膜上动脉周围脂肪间隙存在, 未见侵犯; CT门静脉期增强见肠系膜上静脉脂肪间隙部分消失, 肿瘤部分包绕血管侵犯, 其内可见小血栓形成(图1).
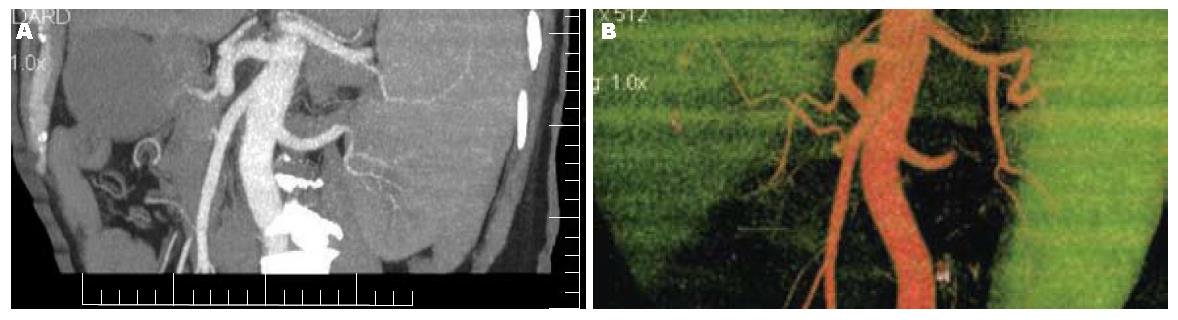
CT重建, 可见肠系膜上动脉和腹腔干及其主要分支结构清晰, 未见血管侵犯, VR期重建图像更加直观, 更有整体感觉(图2).
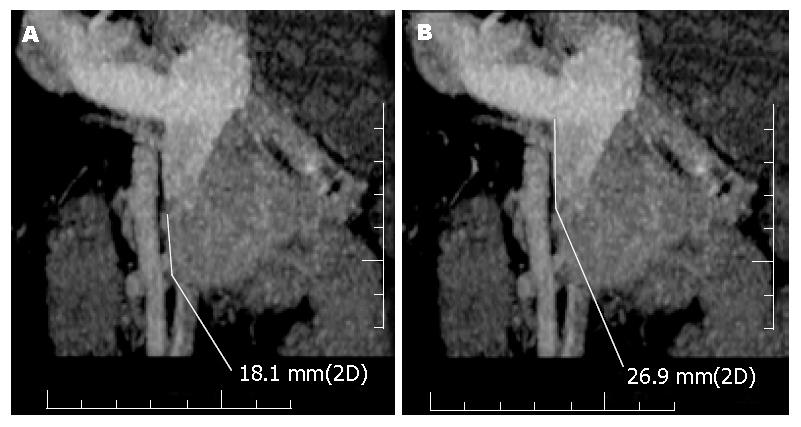
肠系膜上静脉脂肪间隙消失, 肿瘤部分包绕血管, 可见小血栓形成, 肿瘤侵犯血管段的长度为18.1 mm, 侵犯血管段上端距离门静脉主干下端26.9 mm(图3).
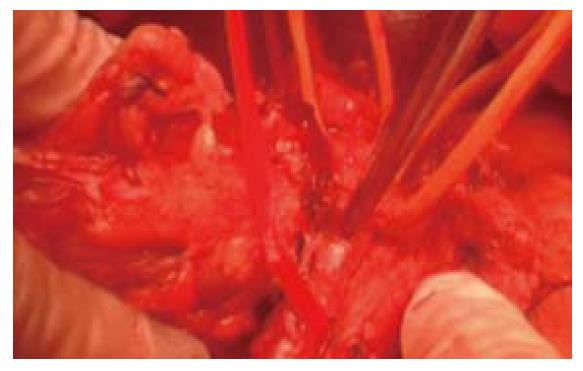
肠系膜上静脉血管侵犯范围小于2 cm, 距离肠系膜上静脉汇入门静脉处距离约为2.5 cm, 与MDCT的测量结果相同, 止血钳所指的为肠系膜上静脉. 术中切除受侵段静脉, 采用血管吻合, 顺利切除肿瘤(图4).
胰腺癌血管侵犯状况MDCT评价技术的研究范围集中在有无局部血管侵犯的定性的方面[15-17]. 但是, 随着外科手术技术的进步, 并不是只要有血管侵犯就一定不能手术. 手术是否成功取决于血管侵犯的范围和程度. 因此, 有无局部血管侵犯的定性研究是不够的, 只有量化的分析肿瘤血管侵犯的范围和程度, 才能为临床手术方案的选择提供更为确实的依据. MDCT对胰腺癌的术前分期及可切除性评判的意义胰腺癌不可切除的因素包括胰周侵犯、血管受累、腹腔种植、淋巴结和转移[18-19]. 在没有远处转移的情况下胰周血管(脾、动静脉除外)受累与否和受侵犯程度是决定可切除性的重要因素[20]. 与普通螺旋CT相比, MDCT成像更快, 精度更高, 并有多种成像方法[21-22]. 本研究结果显示, 42例患者的252支血管中, 175支血管未受侵犯, 其余77支血管不同程度的侵犯. 胰腺癌肿瘤血管侵犯MDCT对腹腔动脉干、肠系膜上动脉、肝动脉、门静脉、下腔静脉和肠系膜上静脉的灵敏度和特异度都较高, 能够较好的反应肿瘤血管侵犯状况. 其中, 12例患者腹腔动脉干受侵犯, MDCT估计过高2例, 估计过低1例; 13例患者肠系膜上动脉受侵犯, MDCT估计过高0例, 估计过低1例; 9例患者肝动脉受侵犯, MDCT估计过高2例, 估计过低0例; 16例患者门静脉主干受侵犯, MDCT估计过高1例, 估计过低2例; 6例患者下腔静脉受侵犯, MDCT估计过高0例, 估计过低1例; 21例患者肠系膜上静脉受侵犯, MDCT估计过高2例, 估计过低3例. 这以往的研究相符[3,23-24], 稍高于普通螺旋CT. 说明MDCT能够对胰腺癌的肿瘤分期以及手术切除性做出较准确的评价.
MVPR和MIP可以多层面多角度的放大显示血管的浸润程度和范围, 结合原始图片, 达到正确判断目的, 并能为手术提供很好的依据[25-26]. 原始图像由于层面和方位的限制, 展现的结构不够直观. 是以病变为中心进行三维重建, 对于病变结构以及和周围组织的关系显示的较为清楚, 斜矢状位重建对于病变范围的显示更加直观, MPVR和MIP技术对于肿瘤的浸润范围的估计有着较高的价值, 三维重建对于诊断方面一定要结合原始像, 综合考虑, 防止假阳性的发生[26-27]. VR图像可以较好的全面显示病变的全貌, 但是对于血管的侵犯帮助不大. MPVR和MIP所重建的图像均能显示主要胰腺周围血管, MIP图像对血管结构和肿瘤的全貌显示优于MPVR, 缺点是无法区分前后重叠的血管, 难以精确地反映胰腺癌与血管的关系[28]. MPVR虽不能完整显示肿瘤和血管的形态, 但能较精细地显示胰腺癌与局部相邻血管的关系, 结合多角度旋转和多层次重建, 有利于清晰显示肿瘤累及胰周血管的部位、范围及程度[13]. 我们发现在有无血栓形成方面, MDCT与手术结果完全相吻合. 在侵犯长度方面, 仅肠系膜上动静脉各有1例欠准确. 在血管分支部位的距离测量方面, 仅肠系膜上动脉1例不准. 动脉测量不准可能与受侵的动脉较为曲折有关, 较曲折的血管误差一般较大. 但总的说来, MDCT能够准确量化的反应肿瘤血管侵犯的范围和程度.
随着外科技术的提高, 发生部分明显侵犯血管可以采用血管吻合或人工血管来解决肿瘤血管侵犯导致的不能切除的问题, 肠系膜上静脉侵犯时尤为突出[29]. 例如, 肠系膜上静脉血管侵犯范围小于2 cm, 距离肠系膜上静脉汇入门静脉处距离大于1 cm时, 可以切除受侵段静脉, 采用血管吻合. 侵犯范围大于2 cm并无肠系膜上静脉分支侵犯时, 可以采用人工血管代替受侵犯的血管.
总之, 16层螺旋CT血管三维重建术前评价胰腺癌及其周围血管侵犯程度具有相当高的正确性, 能够准确量化的反应血管侵犯的范围和程度, 对于胰腺癌术前可切除性评估具有重要的临床参考价值, 是一种值得推广的方法.
胰腺癌是临床上常见疾病, 由于其位置较深, 解剖关系复杂, 常常在开腹后才发现不能手术切除. 胰腺癌周围血管侵犯是评价肿瘤可切除性最重要的指标之一, 有无血管侵犯及对手术的影响已有报道, 但都是定性研究. 多排螺旋CT(MDCT)三维重建技术及3D等后处理功能的技术使得血管侵犯的定量分析成为可能, 可精确测量各血管侵犯的长度和重要结构间距离. 本研究通过定量分析周围血管侵犯状况, 探讨MDCT价值及对临床指导作用.
沈柏用, 副教授, 上海交通大学医学院附属瑞金医院肝胆胰外科中心
胰腺癌可切除性研究一直是胰腺癌治疗中的难点和热点问题. 血管侵犯是可切除性研究的核心问题, 手术技术的进步使得原来不可切除的肿瘤可以切除, 但这必须要对血管侵犯准确的进行定量, 定量研究成为新的研究热点.
Zamboni et al提出MDCT可以使得对于有无血管侵犯的准确度从72%提高到94%, 大大减少了失败的切除术的发生. Vullierme et al对46例胰腺恶性导管内乳头黏液瘤CT与手术结果进行比较分析, 认为CT对于可切除性的研究具有相当的价值.
本研究利用多排螺旋CT技术对胰腺癌的肿瘤血管侵犯实现了精确的定量研究, 对病变的范围和程度首先实现了量化分析, 契合了最新的胰腺手术学的进展, 打破了过去只要有了较严重的局部血管侵犯就不能切除的禁忌, 同时避免了手术中才发现原以为可能分离的较轻的病变实际范围过大, 导致不可切除的问题.
本研究准确量化的反应胰腺癌血管侵犯的范围和程度, 对于胰腺癌术前可切除性评估具有重要的临床参考价值, 大大减少不必要的剖腹探查的发生, 提高手术的成功率.
多排螺旋CT(MDCT): 是目前临床上最先进和高效的CT, 因其具有多个高速探测器而得名. 目前的MDCT可以达到1 s单器官扫描, 空间分辨率可达0.125-0.625 mm, 同时可以进行多方位多角度重建和三维重建, 实现实时测量.
本文选题符合该领域的研究热点, 统计学处理符合统计学方法, 结论可靠, 但讨论不够深入, 全面.
编辑: 程剑侠 电编: 郭海丽
| 1. | Li H, Zeng MS, Zhou KR, Jin DY, Lou WH. Pancreatic adenocarcinoma: the different CT criteria for peripancreatic major arterial and venous invasion. J Comput Assist Tomogr. 2005;29:170-175. [PubMed] [DOI] |
| 2. | Zamboni GA, Kruskal JB, Vollmer CM, Baptista J, Callery MP, Raptopoulos VD. Pancreatic adenocarcinoma: value of multidetector CT angiography in preoperative evaluation. Radiology. 2007;245:770-778. [PubMed] [DOI] |
| 3. | Li H, Zeng MS, Zhou KR, Jin DY, Lou WH. Pancreatic adenocarcinoma: signs of vascular invasion determined by multi-detector row CT. Br J Radiol. 2006;79:880-887. [PubMed] [DOI] |
| 4. | Smith SL, Basu A, Rae DM, Sinclair M. Preoperative staging accuracy of multidetector computed tomography in pancreatic head adenocarcinoma. Pancreas. 2007;34:180-184. [PubMed] [DOI] |
| 5. | Takeshita K, Kutomi K, Takada K, Kohtake H, Furui S. 3D pancreatic arteriography with MDCT during intraarterial infusion of contrast material in the detection and localization of insulinomas. AJR Am J Roentgenol. 2005;184:852-854. [PubMed] [DOI] |
| 6. | Takeshita K, Kutomi K, Takada K, Kohtake H, Furui S, Takada T, Fukushima J. Unusual imaging appearances of pancreatic serous cystadenoma: correlation with surgery and pathologic analysis. Abdom Imaging. 2005;30:610-615. [PubMed] [DOI] |
| 7. | Pelaez-Luna M, Takahashi N, Fletcher JG, Chari ST. Resectability of presymptomatic pancreatic cancer and its relationship to onset of diabetes: a retrospective review of CT scans and fasting glucose values prior to diagnosis. Am J Gastroenterol. 2007;102:2157-2163. [PubMed] [DOI] |
| 8. | Chu Q, Li Z, Zhang SM, Hu DY, Xiao M. Relationship between encephalopathy and portal vein-vena cava shunt: value of computed tomography during arterial portography. World J Gastroenterol. 2004;10:1939-1942. [PubMed] [DOI] |
| 9. | Li Z, Hu DY, Chu Q, Wu JH, Gao C, Zhang YQ, Huang YR. Cell apoptosis and regeneration of hepatocellular carcinoma after transarterial chemoembolization. World J Gastroenterol. 2004;10:1876-1880. [PubMed] [DOI] |
| 10. | Satoi S, Yamamoto H, Takai S, Tanigawa N, Komemushi A, Yanagimoto H, Toyokawa H, Matsui Y, Mergental H, Kamiyama Y. Clinical impact of multidetector row computed tomography on patients with pancreatic cancer. Pancreas. 2007;34:175-179. [PubMed] [DOI] |
| 11. | Gong JS, Xu JM. Role of curved planar reformations using multidetector spiral CT in diagnosis of pancreatic and peripancreatic diseases. World J Gastroenterol. 2004;10:1943-1947. [PubMed] [DOI] |
| 12. | Vullierme MP, Giraud-Cohen M, Hammel P, Sauvanet A, Couvelard A, O'Toole D, Levy P, Ruszniewski P, Vilgrain V. Malignant intraductal papillary mucinous neoplasm of the pancreas: in situ versus invasive carcinoma surgical resectability. Radiology. 2007;245:483-490. [PubMed] [DOI] |
| 13. | Tamm EP, Loyer EM, Faria SC, Evans DB, Wolff RA, Charnsangavej C. Retrospective analysis of dual-phase MDCT and follow-up EUS/EUS-FNA in the diagnosis of pancreatic cancer. Abdom Imaging. 2007;32:660-667. [PubMed] [DOI] |
| 14. | Loyer EM, David CL, Dubrow RA, Evans DB, Charnsangavej C. Vascular involvement in pancreatic adenocarcinoma: reassessment by thin-section CT. Abdom Imaging. 1996;21:202-206. [PubMed] [DOI] |
| 15. | Ichikawa T, Erturk SM, Sou H, Nakajima H, Tsukamoto T, Motosugi U, Araki T. MDCT of pancreatic adenocarcinoma: optimal imaging phases and multiplanar reformatted imaging. AJR Am J Roentgenol. 2006;187:1513-1520. [PubMed] [DOI] |
| 16. | Song SJ, Lee JM, Kim YJ, Kim SH, Lee JY, Han JK, Choi BI. Differentiation of intraductal papillary mucinous neoplasms from other pancreatic cystic masses: comparison of multirow-detector CT and MR imaging using ROC analysis. J Magn Reson Imaging. 2007;26:86-93. [PubMed] [DOI] |
| 17. | Buchs NC, Frossard JL, Rosset A, Chilcott M, Koutny-Fong P, Chassot G, Fasel JH, Poletti PA, Becker CD, Mentha G. Vascular invasion in pancreatic cancer: evaluation of endoscopic ultrasonography, computed tomography, ultrasonography, and angiography. Swiss Med Wkly. 2007;137:286-291. [PubMed] |
| 18. | Klapdor R, Bahlo M, Babinsky A, Brenzinger ML. Reflections on treatment strategies for palliative chemotherapy of pancreatic cancer. Anticancer Res. 2007;27:1789-1794. [PubMed] |
| 19. | Chang ST, Goodman KA, Yang GP, Koong AC. Stereotactic body radiotherapy for unresectable pancreatic cancer. Front Radiat Ther Oncol. 2007;40:386-394. [PubMed] [DOI] |
| 20. | Rappeport ED, Hansen CP, Kjaer A, Knigge U. Multidetector computed tomography and neuroendocrine pancreaticoduodenal tumors. Acta Radiol. 2006;47:248-256. [PubMed] [DOI] |
| 21. | Yovino S, Darwin P, Daly B, Garofalo M, Moesinger R. Predicting unresectability in pancreatic cancer patients: the additive effects of CT and endoscopic ultrasound. J Gastrointest Surg. 2007;11:36-42. [PubMed] [DOI] |
| 22. | Kakihara D, Yoshimitsu K, Irie H, Tajima T, Asayama Y, Hirakawa M, Ishigami K, Yamaguchi K, Taketomi A, Nishihara Y. Usefulness of the long-axis and short-axis reformatted images of multidetector-row CT in evaluating T-factor of the surgically resected pancreaticobiliary malignancies. Eur J Radiol. 2007;63:96-104. [PubMed] [DOI] |
| 23. | Imbriaco M, Smeraldo D, Liuzzi R, Carrillo F, Cacace G, Vecchione D, Diglio A, Salvatore M. Multislice CT with single-phase technique in patients with suspected pancreatic cancer. Radiol Med. 2006;111:159-166. [PubMed] [DOI] |
| 24. | Kala Z, Válek V, Hlavsa J, Hana K, Vánová A. The role of CT and endoscopic ultrasound in pre-operative staging of pancreatic cancer. Eur J Radiol. 2007;62:166-169. [PubMed] [DOI] |
| 25. | Schima W, Ba-Ssalamah A, Kölblinger C, Kulinna-Cosentini C, Puespoek A, Götzinger P. Pancreatic adenocarcinoma. Eur Radiol. 2007;17:638-649. [PubMed] [DOI] |
| 26. | Mehmet Erturk S, Ichikawa T, Sou H, Saitou R, Tsukamoto T, Motosugi U, Araki T. Pancreatic adenocarcinoma: MDCT versus MRI in the detection and assessment of locoregional extension. J Comput Assist Tomogr. 2006;30:583-590. [PubMed] [DOI] |
| 27. | Kawamoto S, Lawler LP, Horton KM, Eng J, Hruban RH, Fishman EK. MDCT of intraductal papillary mucinous neoplasm of the pancreas: evaluation of features predictive of invasive carcinoma. AJR Am J Roentgenol. 2006;186:687-695. [PubMed] [DOI] |
| 28. | Tamm EP, Loyer EM, Faria S, Raut CP, Evans DB, Wolff RA, Crane CH, Dubrow RA, Charnsangavej C. Staging of pancreatic cancer with multidetector CT in the setting of preoperative chemoradiation therapy. Abdom Imaging. 2006;31:568-574. [PubMed] [DOI] |
| 29. | Imbriaco M, Megibow AJ, Ragozzino A, Liuzzi R, Mainenti P, Bortone S, Camera L, Salvatore M. Value of the single-phase technique in MDCT assessment of pancreatic tumors. AJR Am J Roentgenol. 2005;184:1111-1117. [PubMed] [DOI] |