修回日期: 2008-02-26
接受日期: 2008-02-29
在线出版日期: 2008-03-08
目的: 观察和探讨细胞角质素CK18和CK19在不同肝组织中的表达及其意义.
方法: 采用免疫组化SP法观察正常肝组织8例, 肝硬化组织27例和肝细胞癌(hepatocellular carcinoma, HCC)组织43例中CK18, CK19的表达.
结果: 肝CK18和CK19在肝硬化组与正常肝组织的表达率均无明显差异, 但两者在肝细胞癌组与肝硬化组之间差异有显著性(65.1% vs 29.6%, 69.8% vs 25.9%, P<0.01). 在20/27例肝硬化组织和35/43例HCC组织中可见到CK18, CK19标记的卵圆细胞, 且在两种组织中卵圆细胞的数量有显著性差异(CK18: 6.57±1.69 vs 10.70±2.31; CK19: 5.37±1.17 vs 10.45±2.15, P<0.01).
结论: CK18和CK19参与了肝硬化到HCC的癌变过程; CK18和CK19在卵圆细胞中的强阳性表达, 支持HCC的卵圆细胞起源学说.
引文著录: 李蔚, 周慧聪, 李继昌, 段芳龄. 细胞角质素CK18和CK19在肝细胞癌组织中的表达. 世界华人消化杂志 2008; 16(7): 721-725
Revised: February 26, 2008
Accepted: February 29, 2008
Published online: March 8, 2008
AIM: To observe the expressions of cytoketatin18 (CK18) and cytoketatin19 (CK19) in tissues of hepatocellular carcinoma, liver cirrhosis, and normal liver.
METHODS: Immunohistochemical streptavidin-peroxidase (SP) method was adopted to examine the expression of CK18 and CK19 in tissue samples of normal liver (n = 8), liver cirrhosis (n = 27), and hepatocellular carcinoma (n = 43).
RESULTS: The positive rates of CK18 expression in hepatic cirrhosis and normal liver tissues had no significant differences. However, CK18 expression was significantly different between hepatocellular carcinoma and liver cirrhosis (65.1% vs 29.6%, P < 0.01). The positive rates of CK19 expression in cirrhosis of liver and normal liver had no significant differences. But the expression of CK19 was markedly higher in hepatocellular carcinoma than that in hepatic cirrhosis (69.8% vs 25.9%, P < 0.01). Oval cells with strongly positive staining could be seen in the portal area of cirrhosis cases (20/27) and in the brink of carcinoma cases (35/43), and there were significant differences (CK18: 6.57 ± 1.69 vs 10.70 ± 2.31; CK19: 5.37 ± 1.17 vs 10.45 ± 2.15, P < 0.01) in the numbers between cirrhosis of liver and hepatocellular carcinoma.
CONCLUSION: CK18 and CK19 are involved in hepatocarcinogenesis. Oval cells are strongly positive for CK18 and CK19 in cirrhosis of liver and hepatocellular carcinoma. Oval cells are associated with regeneration of liver, and are probably original cells of hepatocellular carcinoma.
- Citation: Li W, Zhou HC, Li JC, Duan FL. Expressions of cytokeratin 18 and cytokeratin 19 in hepatocellular carcinoma tissues. Shijie Huaren Xiaohua Zazhi 2008; 16(7): 721-725
- URL: https://www.wjgnet.com/1009-3079/full/v16/i7/721.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i7.721
肝细胞癌(hepatocellular carcinoma, HCC)由肝内未分化的肝干细胞或卵圆细胞异常分化而来. 卵圆细胞被证实是肝脏干细胞(stem cell)的子代细胞[1], 是肝干细胞的一种[2-3], 并根据卵圆细胞的形态, 表型特征, 癌基因表达及体外转化等大量间接证据[4-22], 认为HCC来源于卵圆细胞. 他具有独特的细胞形态和免疫表型, 既可表达肝细胞型细胞角质素CK8和CK18, 又可表达胆管细胞型角质素CK7和CK19. 我们通过免疫组化方法, 检测卵圆细胞标志物CK18和CK19在正常肝组织, 肝硬化组织和HCC组织中的表达, 并观察卵圆细胞在不同组织中的增生状况, 以期了解卵圆细胞在HCC发生中的作用.
新乡医学院病理教研室, 郑州大学第一附属医院, 第二附属医院病理科, 河南省肿瘤医院HCC患者共43例, 肝硬化27例及肝囊肿8例, 血管瘤及肝硬化旁经病理证实为正常的蜡块或组织. 鼠抗人CK18, CK19购自福建迈新公司, SP试剂盒及DAB试剂盒购自北京中山公司.
常规石蜡切片, HE染色. 免疫组化染色按试剂盒说明书进行: 二甲苯及梯度酒精脱腊水化; 30 mg/L过氧化氢室温孵育10 min, 以消除内源性过氧化物酶的活性; 枸橼酸盐缓冲液抗原修复10 min; 正常山羊血清封闭, 室温孵育20 min; 倾去血清、勿洗、滴加一抗工作液, 4 ℃孵育过夜; 加二抗, 室温孵育20 min; SP室温孵育20 min; DAB镜下显色2-5 min; 苏木精复染, 酒精脱水, 二甲苯透明, 中性树胶封固. 设空白对照, 用PBS缓冲液代替一抗孵育已知阳性切片, 结果阴性. 根据阳性细胞所占的比例及显色程度, 将染色结果分为弱阳性(+), 阳性(++), 强阳性(+++)及阴性(-). 分别为25%-50%, 51%-70%, 70%以上及小于25%的细胞着色(参照1997年全国免疫组化技术诊断标准化专题研讨会意见).
统计学处理 应用SPSS10.0统计软件进行, 计数资料采用χ2检验, 计量资料采用配对t检验, α = 0.05为有统计学意义.
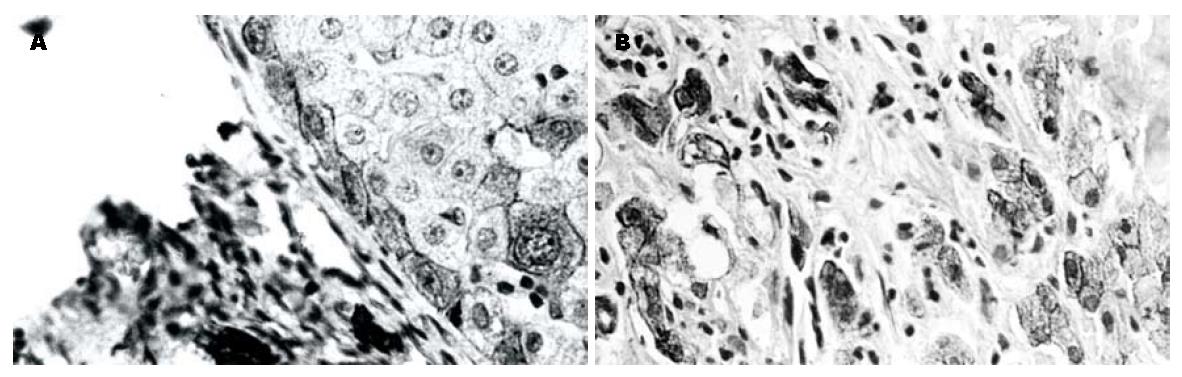
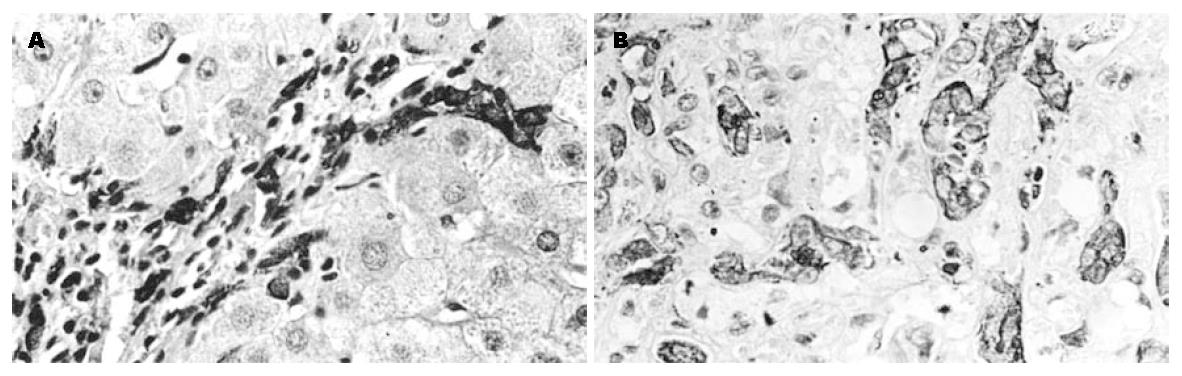
在正常肝组织中, CK18主要定位于小叶间胆管上皮细胞, 呈阳性染色, 靠近间质(汇管区)的肝细胞呈弱阳性染色, 其他部位肝细胞不着色, 主要为胞膜着色, 肝细胞质内亦有弱阳性着色, 从靠近间质汇管区向肝小叶中央区CK18着色呈逐渐衰减的趋势, 阳性率25%; 在肝硬化组织中, CK18在胆管细胞中呈阳性着色, 而在肝细胞中的着色亦有分布异质性, 从靠近间质汇管区向假小叶中央区亦呈逐渐衰减趋势, 偶见呈强阳性着色的异型细胞, 在汇管区内可见呈强阳性染色的小细胞, 这些细胞具有独特的细胞形态, 细胞体积小, 约为正常肝细胞的1/4至1/2大小, 整个细胞大部分为卵圆形胞核所占据, 而胞质较少(图1A); 在HCC组织中, 癌细胞和间质内假胆管均呈强阳性着色, 在癌巢周边常可见到的成簇分布或散在分布的卵圆细胞(图1B). CK18在肝硬化组中的表达率与其在正常组中的表达率相比无显著差异, 而在HCC中的表达率与其在肝硬化组中的表达率相比有显著差异(P<0.01, 表1). CK19在正常肝组织中, 胆管上皮细胞阳性表达, 肝细胞呈阴性表达, 在肝硬化组织中, 间质中胆管、假胆管呈阳性着色, 间质中可见强阳性着色的卵圆细胞, 肝细胞不着色(图2A), 在正常肝组织中和肝硬化组之中的阳性表达率分别为0%和29.6%, 二者之间无明显差异(P>0.05). 在HCC中, 癌细胞, 间质中假胆管中呈阳性表达, 相对正常肝细胞呈阴性表达, 并见卵圆细胞的阳性表达(图2B), HCC的阳性表达率为69.8%, HCC和肝硬化组之间表达有显著差异(P<0.01, 表1).
在正常肝组织中未见到卵圆细胞, 在20/27例肝硬化组织中, 靠近肝小叶边缘汇管区周围可见到CK18及CK19染色较深的小细胞, 体积约为正常肝细胞的1/2-1/4, 胞核呈卵圆形, 胞质稀少, 即卵圆细胞. 在35/43例HCC组织中亦可见到卵圆细胞的增生, 他们位于癌巢周边, 成簇分布或散在分布. 他们在肝硬化组织和HCC组织中的数量之间有显著性差异, CK18及CK19标记的卵圆细胞在二者均有显著性差异(P<0.01, 表2).
CK18, CK19为两种不同的胆管上皮细胞角质素, CK18被认为是成熟肝细胞的标志, 属于肝细胞型细胞角质素; CK19属于胆管细胞型细胞角质素, 一般认为肝细胞不表达CK19[23]. 卵圆细胞在分化过程中既可表达CK18, 又可表达CK19. Grisham et al[24]提出了有关肝脏发育的流动肝(streaming liver)假说. 理由是肝板形态类似轨道, 新生肝细胞呈向心性从门静脉周围区移行至中央静脉区, 最终因凋亡死亡. 流动肝假说从细胞发育角度解释了门静脉周围区和中央静脉周围区肝细胞活力和功能的差异. 而CK18在正常肝组织和肝硬化组织肝细胞中从靠近间质汇管区向肝(假)小叶中央区的分布异质性也说明了这一点. 目前认为, 肝再生通常通过处于增生静止期的分化肝细胞进入细胞周期完成, 如果这一途径出现缺陷, 胆管上皮细胞可以从门脉汇管区移出并分化成肝细胞, 这种胆管上皮细胞即卵圆细胞(oval cell). CK18属肝细胞型角质素, 即在肝实质细胞可有表达, 但从我们的实验结果来看, 并不是所有的肝细胞都可表达CK18. 因此, CK18在正常肝组织, 肝硬化组织和HCC组织中的表达状况, 体现了卵圆细胞在肝的发育, 再生, 癌变过程中担当着重要的角色. 在正常肝组织中, 胆管上皮细胞呈阳性着色, 而在肝细胞中则从靠近间质汇管区向肝小叶中央呈逐渐衰减趋势, 印证了流动肝学说, 在肝硬化组织中, 正常肝细胞再生功能缺损, 胆小管源性卵圆细胞从汇管区向外迁移分化形成肝细胞, 卵圆细胞来源于胆管上皮细胞, CK18呈强阳性着色, 间质内胆管, 假胆管亦呈阳性着色. 而肝细胞仍遵循流动肝的轨道, 亦呈现出类似正常肝细胞的异质性着色. 仅从形态学上推测尚不能说明全部问题, CK18在正常肝组织和肝硬化组织中的异质性表达和流动肝假说的关系, 还需进一步研究.
本实验结果提示CK19在正常肝组织中, 胆管上皮细胞阳性着色, 肝细胞无阳性着色; 在肝硬化组织中, 间质中胆管, 假胆管呈阳性着色, 间质中可见阳性着色的卵圆细胞, 肝细胞不着色. 而在HCC组织中, 癌细胞和间质中假胆管呈阳性着色, 并可见卵圆细胞强阳性着色. HCC癌细胞表达CK19, 提示在肝细胞癌变过程中, 细胞表型发生了改变, 这也为探索HCC的细胞起源提供了线索. Sell et al[25]从动物模型的研究成果推论无论是肝细胞癌还是胆管细胞管癌均起源于汇管周的肝脏干细胞, 卵圆细胞是干细胞的子代细胞, 并认为卵圆细胞可向Hering管分化, 或形成胆管样结构, 在致癌环境作用下, 该干细胞可异常分化形成癌细胞. 本实验中卵圆细胞及部分肝癌细胞表达CK19, 表明卵圆细胞具有向上皮分化的潜能, 当分化为正常肝细胞时, 表达CK19的表型被抑制, 而当细胞癌变时就表现干细胞的某些表型, 如表达CK19.
CK18, CK19在肝硬化组与正常组中的表达率相比无明显差异, 而在HCC组与肝硬化组中的表达率相比有明显差异, 表明CK18, CK19主要参与了从肝硬化到肝细胞癌的癌变过程. 结合他们在卵圆细胞中的强阳性表达, 提示HCC可能起源于卵圆细胞. 在正常生理情况下及在半肝切除时, 肝脏干细胞并未激活及参与肝细胞的再生[26]. 据推测, 仅在各种内源或外源性毒素等的刺激下, 肝细胞自身的复制能力受到损害时, 肝脏的干细胞才被激活[27]. 本实验中正常肝组织中未见到卵圆细胞, 但在肝硬化组织中和HCC组织中却有卵圆细胞的存在, 且其数量在两种组织中有显著性差异, 而90%的HCC由肝硬化发展而来, 肝硬化被认为是肝细胞癌的癌前病变, 验证了卵圆细胞在肝脏损伤后再生和癌变中的作用, 进一步支持HCC的卵圆细胞源学说.
肝细胞癌(HCC)是严重危害人类健康的恶性肿瘤之一. 不少学者对其进行了细胞学起源的探讨, 提出了肝细胞癌可能起源于肝内未分化的卵圆细胞的假说, 并从肝癌组织中发现了肝卵圆细胞的存在.
范学工, 教授, 中南大学湘雅医院感染科
Fang et al在大鼠肝癌模型中测得卵圆细胞贯穿于造模全过程, 其c-myc的表达量随肝癌的进展增高, 由此推测c-myc作为致癌基因可能对卵圆细胞恶性转化其重要作用.
本文通过免疫组化方法, 检测卵圆细胞标志物CK18和CK19在正常肝组织, 肝硬化组织和HCC组织中的表达, 并观察卵圆细胞在不同组织中的增生状况, 以期了解卵圆细胞在HCC发生中的作用.
本文以卵圆细胞作为种子细胞进行肝细胞移植, 应用于终末期肝衰竭的临床治疗.
本文是一篇学术水平一般的文章, 但结果有一定的意义.
编辑: 程剑侠 电编: 吴鹏朕
| 1. | Thorgeirsson SS. Hepatic stem cells. Am J Pathol. 1993;142:1331-1333. [PubMed] |
| 2. | Vessey CJ, de la Hall PM. Hepatic stem cells: a review. Pathology. 2001;33:130-141. [PubMed] [DOI] |
| 3. | Petersen BE. Hepatic "stem" cells: coming full circle. Blood Cells Mol Dis. 2001;27:590-600. [PubMed] [DOI] |
| 4. | Shupe T, Petersen BE. Evidence regarding a stem cell origin of hepatocellular carcinoma. Stem Cell Rev. 2005;1:261-264. [PubMed] [DOI] |
| 5. | Alison MR. Liver stem cells: implications for hepatocarcinogenesis. Stem Cell Rev. 2005;1:253-260. [PubMed] [DOI] |
| 6. | Wu XZ, Chen D. Origin of hepatocellular carcinoma: role of stem cells. J Gastroenterol Hepatol. 2006;21:1093-1098. [PubMed] [DOI] |
| 7. | Lee JS, Heo J, Libbrecht L, Chu IS, Kaposi-Novak P, Calvisi DF, Mikaelyan A, Roberts LR, Demetris AJ, Sun Z. A novel prognostic subtype of human hepatocellular carcinoma derived from hepatic progenitor cells. Nat Med. 2006;12:410-416. [PubMed] [DOI] |
| 8. | Yamamoto T, Uenishi T, Ogawa M, Ichikawa T, Hai S, Sakabe K, Tanaka S, Kato H, Mikami S, Ikebe T. Immunohistologic attempt to find carcinogenesis from hepatic progenitor cell in hepatocellular carcinoma. Dig Surg. 2005;22:364-370. [PubMed] [DOI] |
| 9. | Alison MR, Lovell MJ. Liver cancer: the role of stem cells. Cell Prolif. 2005;38:407-421. [PubMed] [DOI] |
| 10. | Matthews VB, Yeoh GC. Liver stem cells. IUBMB Life. 2005;57:549-553. [PubMed] [DOI] |
| 11. | Fang CH, Zhang GQ, Zhu XY, Gong JQ. Distribution of oval cells and c-myc mRNA expression in mouse hepatocarcinogenesis. Hepatobiliary Pancreat Dis Int. 2004;3:433-439. [PubMed] |
| 12. | Fang CH, Gong JQ, Zhang W. Function of oval cells in hepatocellular carcinoma in rats. World J Gastroenterol. 2004;10:2482-2487. [PubMed] [DOI] |
| 13. | Fang CH, Zhang W, Zhu XY, Gong JQ, Zhang GQ. The expression of c-kit and proliferating cell nuclear antigen in oval cells of rats with hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2003;2:537-544. [PubMed] |
| 14. | Dumble ML, Croager EJ, Yeoh GC, Quail EA. Generation and characterization of p53 null transformed hepatic progenitor cells: oval cells give rise to hepatocellular carcinoma. Carcinogenesis. 2002;23:435-445. [PubMed] [DOI] |
| 15. | 龚 加庆, 方 驰华. 大鼠肝癌发生发展过程中肝组织增殖细胞核抗原动态演变规律. 中国普外基础与临床杂志. 2007;14:11-14. |
| 18. | 龚 加庆, 方 驰华, 李 雅. 肝卵圆细胞在进行性肝损伤过程中分布及迁移的实验研究. 中国普外基础与临床杂志. 2004;11:389-392. |
| 20. | 肖 家诚, 金 晓龙, 曾 晓颖, Ruck P, Adam A, Kaiserling E. 肝细胞肝癌和肝硬化组织中的卵圆细胞: 电镜与免疫电镜研究. 检验医学. 2004;19:47-50. |
| 23. | Hsia CC, Evarts RP, Nakatsukasa H, Marsden ER, Thorgeirsson SS. Occurrence of oval-type cells in hepatitis B virus-associated human hepatocarcinogenesis. Hepatology. 1992;16:1327-1333. [PubMed] [DOI] |
| 24. | Grisham JW. Migration of hepatocytes along hepatic plates and stem cell-fed hepatocyte lineages. Am J Pathol. 1994;144:849-854. [PubMed] |
| 25. | Sell S, Dunsford HA. Evidence for the stem cell origin of hepatocellular carcinoma and cholangiocarcinoma. Am J Pathol. 1989;134:1347-1363. [PubMed] |
| 26. | Sell S. Comparison of liver progenitor cells in human atypical ductular reactions with those seen in experimental models of liver injury. Hepatology. 1998;27:317-331. [PubMed] [DOI] |
| 27. | Bralet MP, Branchereau S, Brechot C, Ferry N. Cell lineage study in the liver using retroviral mediated gene transfer. Evidence against the streaming of hepatocytes in normal liver. Am J Pathol. 1994;144:896-905. [PubMed] |