修回日期: 2008-01-15
接受日期: 2008-01-30
在线出版日期: 2008-02-28
目的: 探讨白介素6(IL-6)基因启动子-572C/G多态性与非酒精性脂肪肝炎(NASH)相关性.
方法: 应用聚合酶联反应-限制性片段长度多态性(PCR-RFLP)方法, 分别检测NASH患者78例和正常者104例IL-6基因启动子-572C/G多态性的变异. 采用ELISA法检测NASH患者组IL-6血清含量.
结果: IL-6基因启动子-572位点的C等位基因频率高于健康对照组, 两组基因分布频率有显著统计学差异(0.564 vs 0.404, P<0.05); NASH患者组中CC基因型携带者IL-6血清含量显著高于其他基因型携带者(6.54±4.21 vs 4.68±2.88, P<0.05), 但HOMA-IR及BMI与其他两组基因型相比较并无显著统计学差异.
结论: IL-6基因启动子-572位点的C等位基因与NASH发病具有一定程度相关性.
引文著录: 马瑞宏, 黄颖秋. 白介素6基因启动子-572C/G多态性与非酒精性脂肪肝炎的关系. 世界华人消化杂志 2008; 16(6): 635-639
Revised: January 15, 2008
Accepted: January 30, 2008
Published online: February 28, 2008
AIM: To investigate the relationship between the C/G genotypes of interleukin-6 (IL-6) single nucleotide polymorphism (SNP) at 572 and the development of nonalcoholic steatohepatitis (NASH).
METHODS: Polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) was used to determine a common polymorphism of the human IL-6 gene -572C/G in 104 controls and NASH 78 patients. Enzyme linked immunosorbent assay (ELISA) was used to determine the concentration of serum IL-6 in 78 patients with NASH.
RESULTS: Homozygotes for -572C of IL-6 gene were more frequent in NASH patients than in controls (0.564 vs 0.404, P < 0.05). Level of IL-6 was significantly higher in NASH patients with IL-6 -572C/C genotype than that in NASH patients with other genotypes (6.54 ± 4.21 vs 4.68 ± 2.88, P < 0.05). The significant difference in HOMA-IR was not seen in three genotypes.
CONCLUSION: The C/G homozygotes of IL-6 single nucleotide polymorphism at -572 have something to do with the pathogenesis of NASH.
- Citation: Ma RH, Huang YQ. C/G homozygotes of interleukin-6 single nucleotide polymorphism at -572 are associated with nonalcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 635-639
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/635.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.635
非酒精性脂肪肝炎(NASH)是一种代谢综合征, 常合并内脏性肥胖、血脂紊乱、高血压、糖调节异常和Ⅱ型糖尿病等多元代谢紊乱[1-2], 胰岛素抵抗(IR)是此类代谢综合症共同的病理生理特点. 近年来发现多种炎症因子在IR发生发展中扮演重要角色, 包括TNF-B, IL-6等[3]. 而NASH兼具慢性炎症性疾病特点, 炎症因子在其发病中应具有一定作用, 此方面研究较少. 本文试图就IL-6基因启动子第572C/G等位基因单核苷酸多态性与NASH疾病及IR相关性做初步探讨.
选取无亲缘关系182人, 其中经临床血液检查结合超声及CT证实NASH患者组78例, 男39例, 女39例, 年龄44.08±15.93岁, 体质量指数(BMI)28.93±4.56; 健康对照组(NC)104例, 男53例, 女51例, 年龄42.12±16.34岁; BMI 28.90±4.31.
1.2.1 NASH的诊断条件: (1)非酒精性; (2)CT诊断脂肪肝; (3)除外其他肝脏原因疾病包括药物性肝损害[4].
1.2.2 临床血指标检查: 所有受试者均空腹12 h后抽取肘部静脉血, 各3份, 每份3 mL, 抗凝处理后用于模板DNA的制备, 不抗凝处理分别用于血IL-6浓度检测及其临床血指标检查.
1.2.3 模板DNA的制备: 抽取受试者外周静脉血3 mL, 经抗凝处理后, 加入9 mL红细胞溶血剂, 红细胞充分溶解后, 再加入2 mL白细胞溶解剂, 隔夜后, 将667 μL的蛋白质沉淀剂加入上述未出现沉淀等异常现象的溶液内, 离心后取上清液, 加入2-丙醇(2-propanol)2 mL, 振荡至液体澄清, 可见白色絮状物出现, 即为DNA.
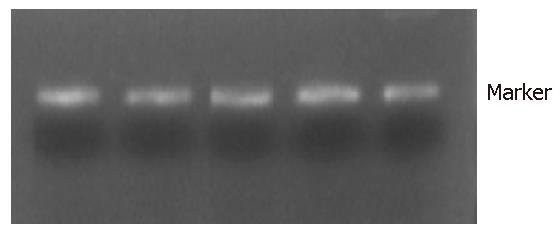
1.2.4 PCR-RFLP分析及DNA序列测定: 利用已制备的两组受试者的DNA, 应用PCR扩增包括IL6基因启动子第572位点等位基因在内的163 bp长度片段. 从GenBank(NM000600)中查取人IL6基因序列(略), 使用primer Primier 5.0 Demo软件进行在线引物设定. 引物序列为: 上游引5'GGAGACGCCTTGAAGTAACTGC3', 下游引物为5'GAGTTTCCTCTGACTCCATCGCAG3', 购自日本北海道sequence株式会社. PCR反应体系含Taq PCR Mixture1 5 µL(QIAGEN Taq PCR core kit试剂盒); 上游引物600 pmol, 下游引物600 pmol; 模板DNA<1 µg; 加超纯水至30 µL. PCR扩增循环: 94 ℃预变性10 min, 94 ℃ 60 s, 51 ℃ 45 s, 72 ℃ 60 s, 72 ℃延伸10 min, 4 ℃终止, 36个循环. 取PCR扩增产物3 µL, 40 g/L琼脂糖凝胶电泳10 min, 电压100 V, Kodak电泳图像分析系统EDAS290比较PCR扩增产物, 并根据Marker条带位置确定PCR扩增产物是否为目的基因片段. 另取PCR扩增产物3 µL, 混入0.5 µL 10×Buffer G, 0.5 µL限制性内切酶MbiⅠ(Fermentas, Burlington, Canada), 4 µL超纯水, 对PCR扩增产物进行酶切, 条件是37 ℃, 6 h, 酶切产物经40 g/L琼脂糖凝胶电泳10 min, 电压100 V, Kodak电泳图像分析系统, 观察带型并拍照.
1.2.5 血液实验室检查: 对78例NASH患者进行空腹12 h临床血指标检查. 包括应用酶联免疫测定法测定IL-6血清水平(Fermentas, Burlington Canada), 同时用全自动生化仪测定血清白蛋白、血清丙氨酸转氨酶(ALT)、血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)值, 空腹血糖(FPG, 葡萄糖氧化酶法)、空腹胰岛素(FINS, 胰岛素放射免疫试剂盒Fermentas, Burlington Canada, 放射免疫分析法). 测量身高、体质量、腰围及血压, 并计算出体质量指数(BMI = 体质量kg/身高的平方m2). 采用稳态模式评估法(HOMA公式)评价胰岛素抵抗指数(HOMA-IR), 计算公式如下: HOMA-IR = FPG×FINS/22.5.
统计学处理 应用SPSS10.0软件包, 文中有关变量用mean±SD. HOMA-IR经对数转换后进行分析, 相对危险度和相关分析采用软件包中的比值比(odds ratio, OR)和Chi-square检验. P<0.05具有显著差异性.
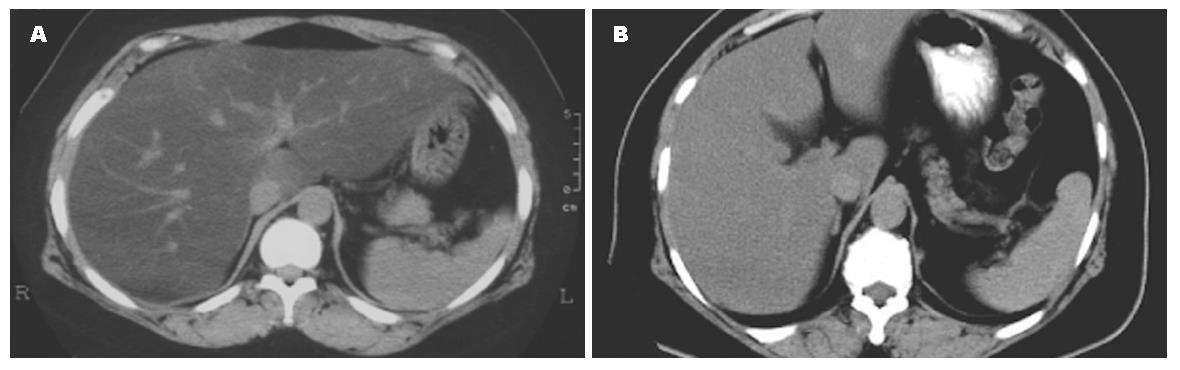
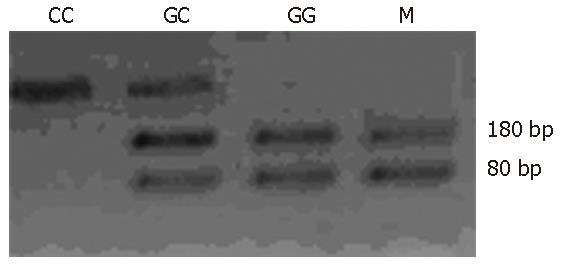
两组受试者均可检测到预计的163 bp片段, 且均符合Hardy-Weinberg平衡检验及卡方Chi-square检验(P>0.05). 限制性内切酶MbiⅠ对IL-6基因PCR扩增产物酶切后存在三种基因型: CC(缺乏BpiⅠ酶切位点, 仅见与扩增产物一样的163 bp片段)、GC(可见163 bp片段, 101 bp片段和62 bp片段)、GG(可见101 bp片段和62 bp片段)见图1. NASH患者组与正常对照组相比, C等位基因频率有显著差异性(56.4% vs 40.4%, P<0.05).NASH患者组的CC基因型频率要显著高于正常对照组(35.9% vs 17.3%, P<0.05, 表1), 通过CT诊断脂肪肝(图2).
依据基因PCR扩增产物酶切后3种基因型(图1), 将NASH患者分为CC组、GC组和GG组, 3组基因型临床资料数据见表2. CC组与其他两组相比血清IL-6水平明显高于其他两组(6.54±4.21 ng/L vs 4.68±2.88 ng/L, P<0.05). GG基因组的HOMA-IR, BMI与其他两组基因型相比无显著统计学差异, resistin基因三种酶切产物电泳见图3.
| 基因型 | C/C | C/G | G/G | P值 |
| 年龄 | 44.8±14.8 | 49.2±15.3 | 35.4±16.5 | >0.05 |
| 性别(M/F) | 14/14 | 14/16 | 11/9 | >0.05 |
| 腰围(cm) | 90.6±15.0 | 81.4±15.1 | 99.2±16.3 | >0.05 |
| BMI | 30.1±4.8 | 27.0±3.2 | 30.2±5.6 | >0.05 |
| 收缩压(mmHg) | 132.1±13.53 | 124.1±16.3 | 138.2±16.2 | >0.05 |
| 舒张压(mmHg) | 80.2±11.7 | 72.9±10.3 | 81.3±10.2 | >0.05 |
| ALT(IU/L) | 93.2±61.1 | 76.1±38.1 | 117.4±65.0 | >0.05 |
| 白蛋白(g/L) | 42.1±3.1 | 43.3±2.2 | 45.4±4.0 | >0.05 |
| TG(mg/dL) | 169.3±103.2 | 178.6±111.2 | 136.7±61.1 | >0.05 |
| TC(mg/dL) | 211.3±37.2 | 208.7±56.3 | 175.5±35.4 | >0.05 |
| HDL-Chol(mg/dL) | 47.4±13.9 | 47.7±14.9 | 42.1±10.6 | >0.05 |
| IL-6(ng/L) | 6.54±4.21 | 4.72±3.1 | 4.63±2.66 | <0.05 |
| 空腹血糖FPG(mg/dL) | 114.6±35.5 | 100.7±14.4 | 104.4±16.2 | >0.05 |
| 空腹胰岛素FINS(mU/L) | 13.4±10.5 | 9.9±8.7 | 13.0±9.6 | >0.05 |
| HOMA-IR | 3.16±1.79 | 3.01±2.72 | 3.24±2.42 | >0.05 |
非酒精性脂肪肝病(NAFLD)是指除过量饮酒及其他明确损肝因素所致的, 以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[5], NASH是NAFLD病程进展的一个阶段. NASH发病机制至今不明确, 目前认为他是一种遗传、环境及代谢应激相关性疾病, 广为接受的是二次打击学说[6], 该学说主要包括胰岛素抵抗、氧化应激作用、脂质过氧化作用等方面机制. 其中氧化应激机制中关于细胞因子如TNF-α, 白介素等的研究成为近年研究的热点, 而这些研究都与NASH的分子机制有着千丝万缕的联系[7-9]. IL-6是一种重要的促炎细胞因子, 作为炎症细胞分化的主要调节因子可以上调黏附分子的表达, 从而加强炎症反应, 还可参与脂类代谢, 在调节免疫应答和炎症反应中起重要作用. IL-6基因位于第七号染色体短臂上, 含5个外显子和4个内含子. IL-6基因启动子区存在基因变异及基因多态性, 这种多态性与多种疾病存在密切相关性[10-12], 其中有研究表明IL-6在胰岛素抵抗患者中升高, 参与胰岛素抵抗的形成[13-15]. Fishman et al[16]于1998年报导IL-6基因启动区174位点存在C/G多态性, 等位基因C纯合子形成IL-6减少, 而等位基因G的纯合子和杂合子形成IL-6增多, 携带GG纯合子人的血清中IL-6浓度大约是CC纯合子的2倍, 得出推论IL-6基因多态性与胰岛素抵抗有关, 随后欧美国家相继有报道支持这一研究[17-20]. 而在我国类似研究的结果却有着一定差距, IL-6基因174G/C多态性频率等位基因C明显少于欧美人群, 可能与胰岛素抵抗无关[21-22]. 鉴于IL-6、胰岛素抵抗及NASH存在待证实的交叉关系, 本文从IL-6基因启动子-572C/G多态性着手, 观察我国人群中该基因频率及与胰岛素抵抗、NASH的相关性. 在本文的研究中IL-6基因启动子-572位点的CC、CG及GG基因型在NASH患者组中分别为0.359、0.385及0.256, 健康对照组中分别为0.173、0.442及0.385. 两组基因分布频率有明显统计学差异(P<0.05); NASH患者组中CC基因型携带者IL-6血清含量显著高于其他基因型携带者(6.54±4.21 ng/L vs 4.68±2.88 ng/L, P<0.05), 但HOMA-IR及BMI与其他两组基因型相比较并无显著统计学差异.
NASH的病因机制复杂, 参与的基因很多, 而研究单个基因多态性时, 可能会因样本的选择及数量不足、基因突变频率低及外界环境影响而致研究结果受到局限, 在以后的研究中可采取增加样本数量及联合相关基因研究.
目前认为NASH发病机制主要包括胰岛素抵抗、氧化应激作用、脂质过氧化作用等方面. 其中氧化应激机制关于细胞因子如TNF-α, 白细胞介素等的研究成为近年研究的热点, IL-6是一种重要的促炎细胞因子, 该基因启动子区存在基因变异及基因多态性, 有研究表明IL-6参与胰岛素抵抗的形成.
陈其奎, 教授, 中山大学附属第二医院消化内科.
鉴于IL-6、胰岛素抵抗及NASH存在待证实的交叉关系, 本文从IL-6基因启动子-572C/G多态性着手, 观察我国人群中该基因频率及与胰岛素抵抗、NASH的相关性.
本文为阐明IL-6在NASH发病机制中的作用提供新证据.
NASH二次打击学说: 第一次打击使脂肪在肝内过量堆积, 引起脂肪变性, 与胰岛素抵抗有关, 第二次打击包括氧化应激和脂质过氧化, 这是由促氧化物和抗氧化物失衡所致. 这其中涉及了基因遗传易感性、多种外界因素及多种细胞因子的相互作用, 中心环节是IR和氧化应激.
本 文对非酒精性脂肪肝炎的基因多态性提供了一些有价值的信息, 具有一定的探索价值.
编辑: 李军亮 电编: 郭海丽
| 1. | Brunt EM. Nonalcoholic steatohepatitis. Semin Liver Dis. 2004;24:3-20. [PubMed] [DOI] |
| 2. | Ratziu V, Tahiri M, Bonyhay L. [Nonalcoholic steatohepatitis]. Ann Endocrinol (Paris). 2005;66:1S71-1S80. [PubMed] |
| 3. | Pickup JC, Mattock MB, Chusney GD, Burt D. NIDDM as a disease of the innate immune system: association of acute-phase reactants and interleukin-6 with metabolic syndrome X. Diabetologia. 1997;40:1286-1292. [PubMed] [DOI] |
| 6. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 7. | Casano-Sancho P, López-Bermejo A, Fernández-Real JM, Monrós E, Valls C, Rodríguez-González FX, Ricart W, Ibáñez L. The tumour necrosis factor (TNF)-alpha-308GA promoter polymorphism is related to prenatal growth and postnatal insulin resistance. Clin Endocrinol (Oxf). 2006;64:129-135. [PubMed] [DOI] |
| 8. | Yang X, Jansson PA, Pellmé F, Laakso M, Smith U. Effect of the interleukin-6 (-174) g/c promoter polymorphism on adiponectin and insulin sensitivity. Obes Res. 2005;13:813-817. [PubMed] [DOI] |
| 9. | Qi L, van Dam RM, Meigs JB, Manson JE, Hunter D, Hu FB. Genetic variation in IL6 gene and type 2 diabetes: tagging-SNP haplotype analysis in large-scale case-control study and meta-analysis. Hum Mol Genet. 2006;15:1914-1920. [PubMed] [DOI] |
| 10. | Fernández-Real JM, Broch M, Vendrell J, Richart C, Ricart W. Interleukin-6 gene polymorphism and lipid abnormalities in healthy subjects. J Clin Endocrinol Metab. 2000;85:1334-1339. [PubMed] [DOI] |
| 11. | Ravaglia G, Forti P, Maioli F, Chiappelli M, Dolzani P, Martelli M, Bianchin M, Mariani E, Bolondi L, Licastro F. Associations of the -174 G/C interleukin-6 gene promoter polymorphism with serum interleukin 6 and mortality in the elderly. Biogerontology. 2005;6:415-423. [PubMed] [DOI] |
| 12. | Park BL, Lee HS, Kim YJ, Kim JY, Jung JH, Kim LH, Shin HD. Association between interleukin 6 promoter variants and chronic hepatitis B progression. Exp Mol Med. 2003;35:76-82. [PubMed] [DOI] |
| 13. | Pickup JC, Chusney GD, Thomas SM, Burt D. Plasma interleukin-6, tumour necrosis factor alpha and blood cytokine production in type 2 diabetes. Life Sci. 2000;67:291-300. [PubMed] [DOI] |
| 14. | Wolford JK, Colligan PB, Gruber JD, Bogardus C. Variants in the interleukin 6 receptor gene are associated with obesity in Pima Indians. Mol Genet Metab. 2003;80:338-343. [PubMed] [DOI] |
| 15. | Sato W, Horie Y, Watanabe S, Suzuki A. [Tumor suppressor gene PTEN and non-alcoholic steatohepatitis (NASH)]. Nihon Rinsho. 2005;63:1475-1483. [PubMed] |
| 16. | Fishman D, Faulds G, Jeffery R, Mohamed-Ali V, Yudkin JS, Humphries S, Woo P. The effect of novel polymorphisms in the interleukin-6 (IL-6) gene on IL-6 transcription and plasma IL-6 levels, and an association with systemic-onset juvenile chronic arthritis. J Clin Invest. 1998;102:1369-1376. [PubMed] [DOI] |
| 17. | Fernández-Real JM, Broch M, Vendrell J, Gutiérrez C, Casamitjana R, Pugeat M, Richart C, Ricart W. Interleukin-6 gene polymorphism and insulin sensitivity. Diabetes. 2000;49:517-520. [PubMed] [DOI] |
| 18. | Vozarova B, Fernández-Real JM, Knowler WC, Gallart L, Hanson RL, Gruber JD, Ricart W, Vendrell J, Richart C, Tataranni PA. The interleukin-6 (-174) G/C promoter polymorphism is associated with type-2 diabetes mellitus in Native Americans and Caucasians. Hum Genet. 2003;112:409-413. [PubMed] |
| 19. | Fernandez-Real JM, Vayreda M, Richart C, Gutierrez C, Broch M, Vendrell J, Ricart W. Circulating interleukin 6 levels, blood pressure, and insulin sensitivity in apparently healthy men and women. J Clin Endocrinol Metab. 2001;86:1154-1159. [PubMed] [DOI] |
| 20. | Esteve E, Villuendas G, Mallolas J, Vendrell J, López-Bermejo A, Rodríguez M, Recasens M, Ricart W, San Millán JL, Escobar-Morreale H. Polymorphisms in the interleukin-6 receptor gene are associated with body mass index and with characteristics of the metabolic syndrome. Clin Endocrinol (Oxf). 2006;65:88-91. [PubMed] [DOI] |
| 22. | 刘 永生, 王 金凤, 于 连慧, 刘 和平, 孟 繁超, 刘 德铭. 白细胞介素6基因启动子-174G/C, 572C/G多态性与冠心病的相关性. 中国心血管病研究杂志. 2007;5:264-266. |