修回日期: 2008-01-15
接受日期: 2008-01-29
在线出版日期: 2008-02-28
目的: 分析配对胃癌组织中S100A4的蛋白与胃癌临床病理及预后的相关性.
方法: 构建胃癌组织芯片, 免疫组化方法检测S100A4蛋白在80例胃癌组织以及配对切缘正常胃黏膜和转移淋巴结组织中的表达, 分析S100A4表达与胃癌临床病理及预后的相关性.
结果: S100A4在切缘正常胃黏膜、癌灶、淋巴结转移灶表达阳性率依次为7.5%、23.8%、30.0%, 差异具有显著性(P = 0.001); 癌灶中S100A4表达与肿瘤浸润深度及TNM分期相关(P = 0.051), 与预后无关; 转移淋巴结组织中S100A4表达出现分化(P = 0.031, OR = 1.756), 阳性表达者预后差(P = 0.0009), 并且是独立预后影响因子(P = 0.030, OR = 2.103).
结论: S100A4表达参与了胃癌的进展过程, 转移淋巴结中S100A4蛋白的表达状况对胃癌预后判断价值优于原发灶的表达.
引文著录: 黄海力, 吴本俨, 尤纬缔, 王卫华, 王孟薇. 配对胃癌组织中S100A4的表达. 世界华人消化杂志 2008; 16(6): 629-634
Revised: January 15, 2008
Accepted: January 29, 2008
Published online: February 28, 2008
AIM: To examine the expression of S100A4 protein in gastric cancer and its correlation with the prognosis and clinical pathology.
METHODS: Archival tissues from 80 patients with gastric cancer were retrieved. Matched samples including adjacent normal gastric tissues, primary tumor and metastasis lymph node tissues were applied in tissue array technology, and investigated immunohistochemically. The correlations of S100A4 protein expression with clinicopathologic factors and survival were analyzed.
RESULTS: The positive rates of S100A4 protein in non-neoplastic mucosa, primary tumor and metastasis lymph node tissues were 7.5%, 23.8%, and 30.0%, respectively (P = 0.001). In primary tumor lesions, S100A4 expression was correlated significantly with the deeper invasion and TNM stages (P = 0.051). S100A4 expression in lymph node metastasis tissues was associated with a poor survival (P = 0.0009). In multivariate Cox's regression analysis, S100A4 expression was significantly variable (P = 0.031, OR = 1.756) in lymph node metastasis tissues and was an independent prognostic factor in patients (P = 0.030, OR = 2.103).
CONCLUSION: S100A4 protein expression may be a late event that takes part in the progression of gastric cancer. The status detection of S100A4 protein expression in metastasis lymph node tissues may enhance the accuracy to prognosticate gastric cancer patients.
- Citation: Huang HL, Wu BY, You WD, Wang WH, Wang MW. S100A4 gene expression in matched gastric cancer samples. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 629-634
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/629.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.629
S100A4又名Mts1, p9Ka, fibroblast specific protein-1(FSP1), 是S100家族中研究最多的与肿瘤相关的一个蛋白. 多方面的证据表明S100A4能够促进肿瘤的浸润和转移, 影响预后[1-3]. 其具体作用机制还不十分明确, 已有的证据表明该分子主要是与一些细胞骨架蛋白起作用[4-6]. S100A4还能够与野生型p53蛋白结合, 使p53蛋白的磷酸化, 同时抑制p53的DNA结合活性, 使p53下游的靶基因如P21/WAF, MDM2, 血小板凝血酶敏感蛋白(thrombospondin-1)等表达下调, 从而对肿瘤细胞的凋亡及增殖浸润发挥间接的调节作用[7-8]. 新近的研究还发现S100A4能够调节MMP, TIMP表达以及促进血管形成以及调节肿瘤细胞周围基质重构的作用[9-12]. 在多数肿瘤, 如: 乳腺癌, 结肠癌, 肺癌, 胰腺癌, 胆囊癌, 甲状腺癌等肿瘤中, S100A4表达高于对应正常黏膜, 并且与肿瘤的浸润, 转移以及预后有关[13-20]. 在胃癌中尤其是对预后的影响方面, 少见报道, 为进一步了解S100A4与胃癌发生、发展的关系, 我们对有淋巴结转移的胃癌患者用免疫组化方法检测S100A4在配对胃癌组织中的表达.
构建组织芯片的80例标本均来源于解放军总医院1992/2002年胃癌手术患者; 患者均为首次发现胃癌, 术前没有经过放化疗或免疫治疗, 影像学检查均未发现有远隔脏器转移; 手术切除彻底, 手术标本残端及切缘均未见有残留癌细胞. 80例患者中男性62例, 女性18例; 胃底和贲门癌16例(20.0%), 胃体癌18例(22.5%), 胃窦及幽门癌46例(57.5%); 黏膜或者黏膜下层浸润者15例(18.8%), 浸润至肌层和浆膜层者65例(81.3%); 80例患者均有淋巴结转移, 按照UICC1997年胃癌TNM分期, Ⅰ, Ⅱ, Ⅲ期例数分别为15例(18.8%), 23例(28.8%), 42例(52.5%). 截止到2004-12, 患者平均随访时间为43 mo, 所有患者中死亡38例, 存活42例, 最长生存时间为153 mo. 主要试剂: S100A4 Rabbit Polyclonal Antibody(NeoMarkers).
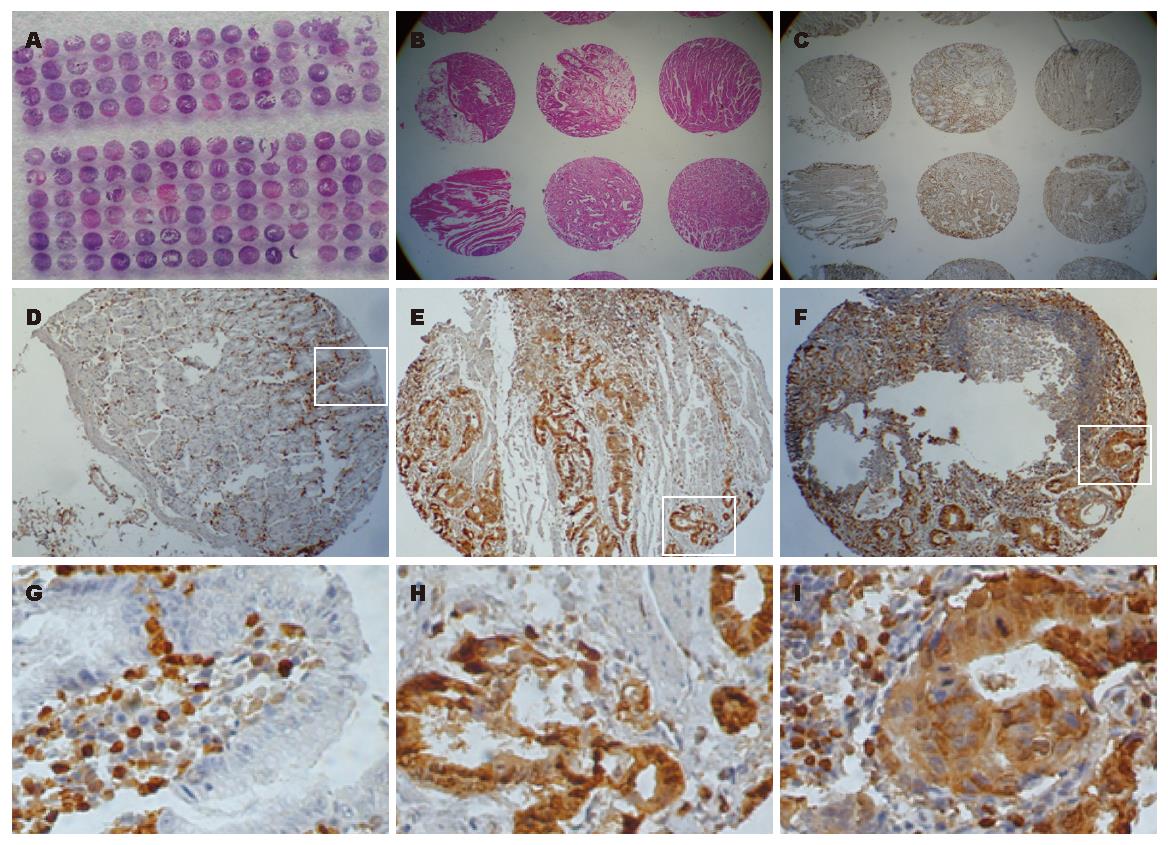
1.2.1 组织芯片的构建: 石蜡标本切缘黏膜、原发肿瘤病灶、淋巴结转移灶分别选择两个区域打孔, 每个组织芯的直径为1 mm.
1.2.2 免疫组化: 芯片常规脱蜡水化, 枸橼酸抗原修复液98 ℃微波修复15 min. S100A4抗体1:200稀释, 采用SP法(PV-9000二步法免疫组化染色试剂盒, 购自Zymed公司), 操作按照试剂盒说明进行, DAB显色. 以TBS代替一抗作为阴性对照. 阳性判断: 阳性细胞数≤10%记0分, 10%-50%记1分, 50%-70%记2分, ≥70%记3分; 信号强弱的判断标准为: 阴性或者基本无显色, 0分, 弱阳性1分, 阳性2分, 强阳性3分. 两项评分相乘: ≤2为阴性, ≥3为阳性.
统计学处理 采用SPSS12.0软件进行统计学分析. S100A4表达在肿瘤, 对应正常和转移淋巴结组织中表达差异以及与临床病理类型之间的差异比较用卡方检验. 生存率曲线的绘制用Kaplan-Meier方法, 对生存率影响的单因素分析用log-rank检验. 多因素生存分析用COX逐步回归估计各危险因素的相对危险度及95%可信区间. P≤0.05为差异具有显著性.
正常腺体几乎无表达, 肿瘤表达强于正常, 但阳性率不到50%, 且基本为弱阳性表达. 阳性部位主要分布于细胞质中, 少部分细胞核也阳性着色. 血管平滑肌细胞和间质细胞表达明显强于胃腺细胞和肿瘤细胞(图1).
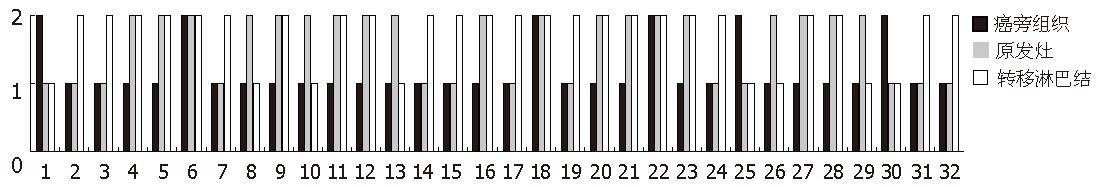
切缘正常黏膜, 胃癌组织以及转移淋巴结阳性率分别为7.5%, 23.8%, 30.0%, 卡方检验胃癌及转移淋巴结中S100A4表达高于正常黏膜, 差异具有显著性(χ2 = 13.28, P = 0.001, 表1); 转移淋巴结和胃癌组织提示两者之间S100A4表达无差异(P = 0.373). 80例患者中, 48例患者S100A4在切缘、癌灶以及转移淋巴结灶中表达一致, 32例患者出现表达的变化(图2); 癌灶相比于配对的正常黏膜, 20%出现表达升高, 76.3%表达不变, 3.8%表达下降; 而转移淋巴结灶相对于配对癌灶, 12.5%表达升高, 81.3%表达不变, 6.3%出现表达下降(表2).
| 分类 | 表达升高 | 表达不变 | 表达下降 |
| 原发灶 vs 切缘 | 16(20.0) | 61(76.3) | 3(3.8) |
| 转移灶 vs 原发灶 | 10(12.5) | 65(81.3) | 5(6.3) |
肿瘤组织中S100A4表达与浸润深度和TNM分期相关, 随肿瘤的进展表达升高(P = 0.051, 表3).
| 病理类型 | n | 胃癌组织中S100A4表达(%) | |
| - | + | ||
| 肿瘤大小 | |||
| <4.39 | 33 | 78.8 | 21.2 |
| >4.39 | 47 | 74.5 | 25.5 |
| 肿瘤分化 | |||
| 中高分化 | 8 | 50.0 | 50.0 |
| 中分化 | 5 | 80.0 | 20.0 |
| 中低分化 | 59 | 79.7 | 20.3 |
| 印戒黏液 | 8 | 75.0 | 25.0 |
| 浸润深度 | |||
| 黏膜及黏膜下层 | 15 | 100.0 | 0.0 |
| 肌层 | 23 | 73.9 | 26.1 |
| 全层 | 42 | 69.0 | 31.0 |
| TNM分期 | |||
| Ⅰ | 15 | 100.0 | 0.0 |
| Ⅱ | 23 | 73.9 | 26.1 |
| Ⅲ | 42 | 69.0 | 31.0 |
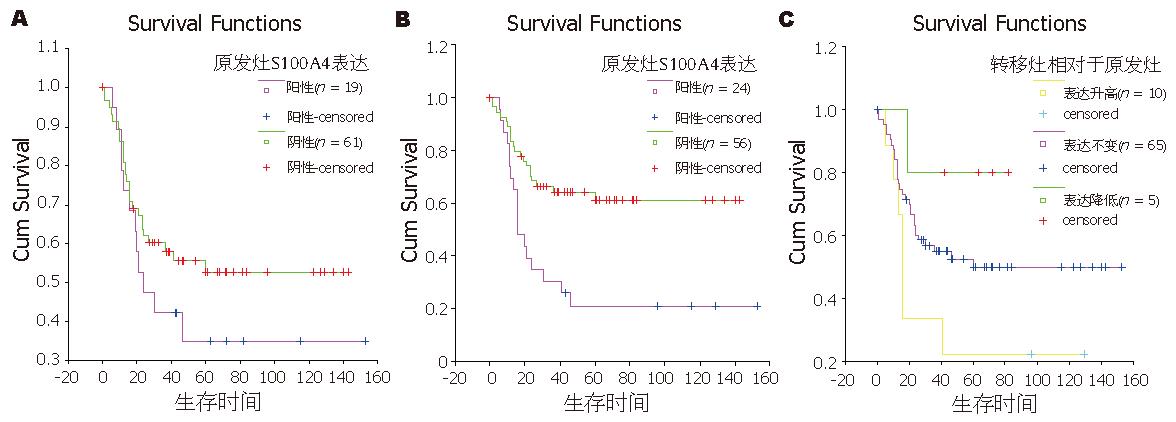
单因素生存分析, 肿瘤组织中S100A4表达状况与生存率之间未显示统计学意义(P = 0.235); 但淋巴结转移灶中, S100A4阳性表达者生存率显著低于阴性者,(P = 0.002), 阳性者3年生存率为30.43%, 阴性者为64.18%; 进一步分析表明, 原发灶表达阴性而转移淋巴结中表达阳性者, 预后最差; 原发灶表达阳性而转移淋巴结中表达阴性者, 预后最好(P = 0.082, 图3). 引入性别、肿瘤大小、浸润深度、肿瘤部位、肿瘤分化、有无癌栓、TNM分期、S100A4在转移淋巴结中表达等因素进行多因素生存分析, 显示除TNM分期以外, 淋巴结中S100A4表达状况为独立预后影响因子(表4).
| 肿瘤参数 | Cox's统计值 | P | 相对危险度(Relative risk) | 95%置信区间(CI 95%) |
| S100A4表达 | 4.722 | 0.030 | 2.103 | 1.076-4.110 |
| TNM分期 | 4.633 | 0.031 | 1.756 | 1.052-2.931 |
S100A4蛋白与肿瘤相关性的研究非常广泛, 虽然其具体机制仍有待于进一步研究, 但目前比较一致的结论是该分子能够促进多种肿瘤的进展并且与预后有关[20-24]. S100A4在胃癌中的研究少见, 少见的几篇研究认为S100A4表达与胃癌淋巴结转移及预后相关[25-27], 国内未见S100A4与预后的研究[28-30]. 与既往多数研究不同, 本研究中, 采取了80例切缘、原发灶、转移淋巴结灶的患者进行了配对分析, 这样一方面能够减少不同的遗传异质性带来的影响, 另一方面可以观察到该分子在肿瘤发展过程中续贯性的表达变化.
不同类型肿瘤中, S100A4阳性表达率在30%-70%左右, 在胃癌中约为50-70%[25-29]. 本研究中S100A4在胃癌中阳性率为23.8%, 低于以往研究, 可能与阳性判断标准不同以及病例数不同有关. 值得一提的是胃组织的间质中淋巴细胞和血管平滑肌细胞呈现强阳性显色, 这与其他研究中结论一致. S100A4在76.25%胃癌原发灶中表达与切缘组织相同, 仅20%出现表达升高, 同时原发灶中的表达与胃癌的浸润和TNM分期有关(P = 0.051), 说明该分子表达的变化在胃癌中只是一个散发的晚期事件, 只与部分胃癌的进展有关. S100A4淋巴结转移灶中相对于原发癌灶的表达无统计学差异(30% vs 23.8%), 多数表达没有发生改变65例(81.25%), 有10例(12.50%)患者原发癌灶表达为阴性, 在淋巴结转移灶中出现阳性表达, 而5例(6.25%)在原发癌灶表达阳性者在转移灶中表达阴性, 这可能是转移过程中发生的获得性改变, 也可能是原发灶异质性细胞转移的结果.
在胃癌原发灶中, S100A4表达阳性者预后更差, 但没有显示出统计学差异(P = 0.235), 而有趣的是S100A4在淋巴结转移灶中的表达状况却与预后相关(P = 0.002), 在多因素生存分析中, 即使引入TNM分期等进行分析, 其表达状况仍是独立预后影响因子(P = 0.003, OR = 2.103), 阳性者3年生存率为30.43%, 阴性者为64.18%. 进一步分析表明淋巴结转移灶中相对于原发癌灶表达升高者预后要比表达下降者差, 10例表达升高的患者中7例均在41 mo内死亡, 而5例表达下降者中仅1例在19 mo死亡, 其余均存活42 mo以上. 这提示我们, 一些基因在肿瘤转移的过程中可能会出现一些获得性表达或者表达缺失, 而这种表达变化会对后续的肿瘤的进展或者预后产生影响; 另外一种可能的解释就是原发癌灶存在分子表达的异质性, 而转移灶的分析能更客观的反映了转移肿瘤细胞对预后影响的特性.
总之, 相对于既往S100A4在肿瘤中的研究, 本研究提示S100A4在胃癌的进展及转移过程中可能出现表达的分化, 并且对预后产生影响; 该分子在转移淋巴结中的表达分析比原发癌灶的分析更能反映预后.
胃癌的发病率在发展中国家居所有恶性肿瘤首位. 虽然在其发病机制方面进行了广泛的探索与研究, 找到一些能够影响胃癌侵袭和预后的分子标志物, 然而目前仍缺乏比较特异的公认的指标来判断胃癌的预后.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科.
S100A4属于S100蛋白家族, 大量研究表明S100A4是一个与多种肿瘤侵袭和预后密切相关的蛋白分子. 虽然其发挥作用的机制目前仍不完全清楚, 但主要涉及改变肿瘤细胞骨架蛋白、促进肿瘤细胞周围血管生成以及基质降解、影响p53蛋白的磷酸化等.
S100A4在胃癌中的研究少见, S100A4在胃癌发生、发展过程中其表达的趋势如何仍不明确. 少见的几篇研究认为S100A4表达与胃癌淋巴结转移及预后相关, 但国内未见S100A4与胃癌预后的研究.
与既往多数研究不同, 本研究中, 采取了80例切缘、原发灶、转移淋巴结灶的患者进行了配对分析, 这样一方面能够减少因个体遗传异质性带来的影响, 另一方面可以观察到该分子在肿瘤发展过程中续贯性的表达变化.
本研究发现: (1)S100A4蛋白主要在进展期胃癌中表达升高, 但升高比例仅为20%, 因此该分子表达的变化在胃癌中只是一个散发的晚期事件. (2)S100A4在胃癌的进展及转移过程中可能出现表达的分化, 更有意义的发现是从转移淋巴结组织中检测该分子的表达状况比胃癌组织中检测更具有预后判断价值, 这拓展了大家研究S100A4乃至其他肿瘤预后标志物检测视野.
S100A4: 有多种别名, pEL98、mts1、p9Ka、calvasculin、FSP1、CAPL. S100A4分子是S100蛋白家族的成员之一, 该家族成员蛋白质分子N末端和C末端具有特征性EF-手型基序(即螺旋-环-螺旋结构域, helix-loop-helix domain).
该文选题新颖, 研究方法设计合理, 观察指标较系统, 数据客观, 结论明确, 有较好的学术价值, 该研究结论对于胃癌的预后评估有一定临床意义.
编辑: 师忠芳 电编: 郭海丽
| 1. | Helfman DM, Kim EJ, Lukanidin E, Grigorian M. The metastasis associated protein S100A4: role in tumour progression and metastasis. Br J Cancer. 2005;92:1955-1958. [PubMed] [DOI] |
| 2. | Tarabykina S, Griffiths TR, Tulchinsky E, Mellon JK, Bronstein IB, Kriajevska M. Metastasis-associated protein S100A4: spotlight on its role in cell migration. Curr Cancer Drug Targets. 2007;7:217-228. [PubMed] [DOI] |
| 3. | Garrett SC, Varney KM, Weber DJ, Bresnick AR. S100A4, a mediator of metastasis. J Biol Chem. 2006;281:677-680. [PubMed] [DOI] |
| 4. | Kriajevska MV, Cardenas MN, Grigorian MS, Ambartsumian NS, Georgiev GP, Lukanidin EM. Non-muscle myosin heavy chain as a possible target for protein encoded by metastasis-related mts-1 gene. J Biol Chem. 1994;269:19679-19682. [PubMed] |
| 5. | Ford HL, Silver DL, Kachar B, Sellers JR, Zain SB. Effect of Mts1 on the structure and activity of nonmuscle myosin II. Biochemistry. 1997;36:16321-16327. [PubMed] [DOI] |
| 6. | Li ZH, Bresnick AR. The S100A4 metastasis factor regulates cellular motility via a direct interaction with myosin-IIA. Cancer Res. 2006;66:5173-5180. [PubMed] [DOI] |
| 7. | Grigorian M, Andresen S, Tulchinsky E, Kriajevska M, Carlberg C, Kruse C, Cohn M, Ambartsumian N, Christensen A, Selivanova G. Tumor suppressor p53 protein is a new target for the metastasis-associated Mts1/S100A4 protein: functional consequences of their interaction. J Biol Chem. 2001;276:22699-22708. [PubMed] [DOI] |
| 8. | Chen H, Fernig DG, Rudland PS, Sparks A, Wilkinson MC, Barraclough R. Binding to intracellular targets of the metastasis-inducing protein, S100A4 (p9Ka). Biochem Biophys Res Commun. 2001;286:1212-1217. [PubMed] [DOI] |
| 9. | Andersen K, Maelandsmo GM, Hovig E, Fodstad O, Loennechen T, Winberg JO. Interleukin-1 alpha and basic fibroblast growth factor induction of matrix metalloproteinases and their inhibitors in osteosarcoma cells is modulated by the metastasis associated protein CAPL. Anticancer Res. 1998;18:3299-3303. [PubMed] |
| 10. | Mathisen B, Lindstad RI, Hansen J, El-Gewely SA, Maelandsmo GM, Hovig E, Fodstad O, Loennechen T, Winberg JO. S100A4 regulates membrane induced activation of matrix metalloproteinase-2 in osteosarcoma cells. Clin Exp Metastasis. 2003;20:701-711. [PubMed] [DOI] |
| 11. | Schmidt-Hansen B, Ornås D, Grigorian M, Klingelhöfer J, Tulchinsky E, Lukanidin E, Ambartsumian N. Extracellular S100A4(mts1) stimulates invasive growth of mouse endothelial cells and modulates MMP-13 matrix metalloproteinase activity. Oncogene. 2004;23:5487-5495. [PubMed] [DOI] |
| 12. | Semov A, Moreno MJ, Onichtchenko A, Abulrob A, Ball M, Ekiel I, Pietrzynski G, Stanimirovic D, Alakhov V. Metastasis-associated protein S100A4 induces angiogenesis through interaction with Annexin II and accelerated plasmin formation. J Biol Chem. 2005;280:20833-20841. [PubMed] [DOI] |
| 13. | Rudland PS, Platt-Higgins A, Renshaw C, West CR, Winstanley JH, Robertson L, Barraclough R. Prognostic significance of the metastasis-inducing protein S100A4 (p9Ka) in human breast cancer. Cancer Res. 2000;60:1595-1603. [PubMed] |
| 14. | Lee WY, Su WC, Lin PW, Guo HR, Chang TW, Chen HH. Expression of S100A4 and Met: potential predictors for metastasis and survival in early-stage breast cancer. Oncology. 2004;66:429-438. [PubMed] [DOI] |
| 15. | de Silva Rudland S, Martin L, Roshanlall C, Winstanley J, Leinster S, Platt-Higgins A, Carroll J, West C, Barraclough R, Rudland P. Association of S100A4 and osteopontin with specific prognostic factors and survival of patients with minimally invasive breast cancer. Clin Cancer Res. 2006;12:1192-1200. [PubMed] [DOI] |
| 16. | Gongoll S, Peters G, Mengel M, Piso P, Klempnauer J, Kreipe H, von Wasielewski R. Prognostic significance of calcium-binding protein S100A4 in colorectal cancer. Gastroenterology. 2002;123:1478-1484. [PubMed] [DOI] |
| 17. | Flatmark K, Pedersen KB, Nesland JM, Rasmussen H, Aamodt G, Mikalsen SO, Bjørnland K, Fodstad Ø, Maelandsmo GM. Nuclear localization of the metastasis-related protein S100A4 correlates with tumour stage in colorectal cancer. J Pathol. 2003;200:589-595. [PubMed] [DOI] |
| 18. | Kimura K, Endo Y, Yonemura Y, Heizmann CW, Schafer BW, Watanabe Y, Sasaki T. Clinical significance of S100A4 and E-cadherin-related adhesion molecules in non-small cell lung cancer. Int J Oncol. 2000;16:1125-1131. [PubMed] [DOI] |
| 19. | Matsubara D, Niki T, Ishikawa S, Goto A, Ohara E, Yokomizo T, Heizmann CW, Aburatani H, Moriyama S, Moriyama H. Differential expression of S100A2 and S100A4 in lung adenocarcinomas: clinicopathological significance, relationship to p53 and identification of their target genes. Cancer Sci. 2005;96:844-857. [PubMed] [DOI] |
| 20. | Miyazaki N, Abe Y, Oida Y, Suemizu H, Nishi M, Yamazaki H, Iwasaki M, Inoue H, Ueyama Y, Nakamura M. Poor outcome of patients with pulmonary adenocarcinoma showing decreased E-cadherin combined with increased S100A4 expression. Int J Oncol. 2006;28:1369-1374. [PubMed] [DOI] |
| 21. | Sato N, Fukushima N, Maitra A, Iacobuzio-Donahue CA, van Heek NT, Cameron JL, Yeo CJ, Hruban RH, Goggins M. Gene expression profiling identifies genes associated with invasive intraductal papillary mucinous neoplasms of the pancreas. Am J Pathol. 2004;164:903-914. [PubMed] [DOI] |
| 22. | Oida Y, Yamazaki H, Tobita K, Mukai M, Ohtani Y, Miyazaki N, Abe Y, Imaizumi T, Makuuchi H, Ueyama Y. Increased S100A4 expression combined with decreased E-cadherin expression predicts a poor outcome of patients with pancreatic cancer. Oncol Rep. 2006;16:457-463. [PubMed] [DOI] |
| 23. | Davies BR, O'Donnell M, Durkan GC, Rudland PS, Barraclough R, Neal DE, Mellon JK. Expression of S100A4 protein is associated with metastasis and reduced survival in human bladder cancer. J Pathol. 2002;196:292-299. [PubMed] [DOI] |
| 24. | Zou M, Famulski KS, Parhar RS, Baitei E, Al-Mohanna FA, Farid NR, Shi Y. Microarray analysis of metastasis-associated gene expression profiling in a murine model of thyroid carcinoma pulmonary metastasis: identification of S100A4 (Mts1) gene overexpression as a poor prognostic marker for thyroid carcinoma. J Clin Endocrinol Metab. 2004;89:6146-6154. [PubMed] [DOI] |
| 25. | Yonemura Y, Endou Y, Kimura K, Fushida S, Bandou E, Taniguchi K, Kinoshita K, Ninomiya I, Sugiyama K, Heizmann CW. Inverse expression of S100A4 and E-cadherin is associated with metastatic potential in gastric cancer. Clin Cancer Res. 2000;6:4234-4242. [PubMed] |
| 26. | Lee OJ, Hong SM, Razvi MH, Peng D, Powell SM, Smoklin M, Moskaluk CA, El-Rifai W. Expression of calcium-binding proteins S100A2 and S100A4 in Barrett's adenocarcinomas. Neoplasia. 2006;8:843-850. [PubMed] [DOI] |
| 27. | Cho YG, Nam SW, Kim TY, Kim YS, Kim CJ, Park JY, Lee JH, Kim HS, Lee JW, Park CH. Overexpression of S100A4 is closely related to the aggressiveness of gastric cancer. APMIS. 2003;111:539-545. [PubMed] [DOI] |