修回日期: 2008-01-16
接受日期: 2008-01-23
在线出版日期: 2008-02-18
目的: 研究细胞S期激酶相关蛋白2(S-phase kinase-asociated protein 2, Skp2)在大肠腺瘤组织中的表达.
方法: 应用逆转录聚合酶链反应(RT-PCR)和免疫组化方法检测20例管状腺瘤、15例绒毛状腺瘤、18例混合性腺瘤和20例正常黏膜组织中Skp2的表达情况.
结果: 绒毛状腺瘤和混合性腺瘤Skp2 mRNA的表达水平显著高于正常对照组(0.71±0.34, 0.63±0.20 vs 0.34±0.20, P<0.01), 而管状腺瘤Skp2 mRNA的相对含量与正常对照组无显著差异, 绒毛状腺瘤和混合性腺瘤Skp2 mRNA的相对含量与管状腺瘤组亦有显著差异(0.71±0.34, 0.63±0.20 vs 0.43±0.22, P<0.05); 但是绒毛状腺瘤和混合性腺瘤间无显著差异. 大肠管状腺瘤、绒毛状腺瘤、混合性腺瘤及正常组Skp2蛋白表达阳性率分别为15%(3/20)、46.7%(7/15)、27.8%(5/18)和5.0%(1/20), 各组间有显著差异(P<0.05).
结论: 从基因及蛋白水平证明, Skp2的阳性表达与大肠腺瘤的组织学类型有关, 可能对大肠腺瘤的发生发展起促进作用.
引文著录: 刘晓珺, 杜雅菊, 沈滨. Skp2 mRNA及蛋白在大肠腺瘤组织中的表达. 世界华人消化杂志 2008; 16(5): 559-562
Revised: January 16, 2008
Accepted: January 23, 2008
Published online: February 18, 2008
AIM: To study the expression of S-phase kinase-asociated protein 2 (Skp2) in large intestine adenoma tissue.
METHODS: Expression of Skp2 was detected in 20 cases of tubular adenoma, 15 cases of villous adenoma, 18 cases of mixed type adenoma and 20 cases of normal tissue using RT-PCR and immunohistochemical technique.
RESULTS: The expression level of Skp2 mRNA was significantly higher in villous adenoma and mixed type adenoma than in normal tissue (0.71 ± 0.34, 0.63 ± 0.20 vs 0.34 ± 0.20, P < 0.01). However, there was no difference in the relative amount of Skp2 mRNA between tubular adenoma and normal tissue. However, there was a significant difference in villous adenoma, mixed type adenoma and tubular adenoma (0.71 ± 0.34, 0.63 ± 0.20 vs 0.43 ± 0.22, P < 0.05). There was no difference in villous adenoma and mixed type adenoma. The positive rate for the expression of Skp2 in tubular adenoma, villous adenoma, mixed type adenoma and normal tissue was 15% (3/20), 46.7% (7/15), 27.8% (5/18) and 5.0% (1/20), respectively(P < 0.05)
CONCLUSION: Positive expression of Skp2 in large intestine adenoma is related with its histology type and may promote the development of large intestine adenoma.
- Citation: Liu XJ, Du YJ, Shen B. Expression of S-phase kinase-asociated protein 2 mRNA in large intestine adenoma tissue. Shijie Huaren Xiaohua Zazhi 2008; 16(5): 559-562
- URL: https://www.wjgnet.com/1009-3079/full/v16/i5/559.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i5.559
大肠腺瘤虽然是一组良性肿瘤性病变, 但多项研究显示80%的结直肠癌是由腺瘤演变而来[1]. 在大肠腺瘤发生发展过程中, 有多种因子参与, 并分别在不同阶段起着不同的作用, 对腺瘤生长的促进或抑制等产生影响. 细胞S期激酶相关蛋白2(S-phase kinase-asociated protein 2, Skp2)是细胞周期中重要的调节因子, 在肿瘤发生中备受关注. 我们应用RT-PCR及免疫组织化学技术检测Skp2在大肠腺瘤中的表达.
收集2004-2005年哈尔滨医科大学附属二院腔镜中心大肠黏膜活检诊断病例: 管状腺瘤20例(男13例, 女7例, 平均年龄55.7岁)、绒毛状腺瘤15例(男9例, 女6例, 平均年龄58岁)、混合性腺瘤18例(男12例, 女6例, 平均年龄57.2岁)、正常黏膜20例(平均年龄35岁)患者的病变组织, 一部分40 g/L甲醛固定, 用于病理学及免疫组织化学检测; 另一部分液氮速冻后置于-80 ℃冰箱保存, 备于提取RNA. TRIzol®Reagent购于Gibco BRL公司, M-MLV Reverse Transcriptase, Tag DNA聚合酶为Pramega产品, 引物由上海生工合成. Skp2鼠抗人mAb(克隆系: 1G12E9), PV-9000二步法免疫组化检测试剂盒均购于北京中山生物技术有限公司. 冰冻高速离心机, PTC-100热循环仪, GE-100凝胶电泳仪, 全自动数码凝胶图像系统, 紫外分光光度计和Olmpus CX40显微镜等.
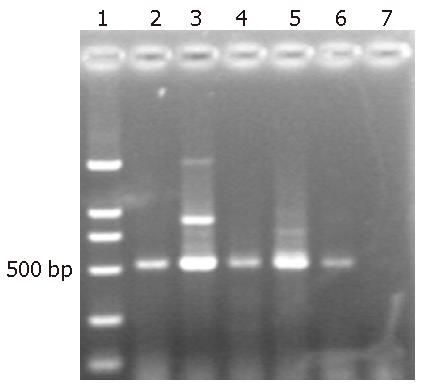
1.2.1 组织总RNA提取和cDNA合成: 按试剂盒说明书进行操作. PCR扩增, 引物设计为: F: 5'-AGTCTCTATGGCAGACCTTAGACC-3', R: 5'-TTTCTGGAGATTCTTTCTGTAGCC-3', 扩增片段长度500 bp, 设置β-actin为阳性参照, 同时设H2O为阴性对照. 反应体系: 10×Buffer 2.5 μL, dNTP(2.5 mmol/L)2 μL, MgCl2(25 mmol/L)2 μL, 上、下游引物(10 pmol/L)各1 μL, Tag DNA聚合酶 0.5 μL, cDNA 2 μL, 水补足体系至25 μL; 反应条件: 95 ℃预变性5 min, 94 ℃ 1 min, 55 ℃ 1 min, 72 ℃ 2 min, 35个循环, 72 ℃ 10 min. 产物20 mg/L琼脂糖凝胶电泳, 溴化乙锭染色(10 mg/L)后, 通过凝胶成像系统对目的电泳条带进行光密度扫描, 与自身β-actin形成条带比较的相对值表示Skp2 mRNA的表达水平(图1).
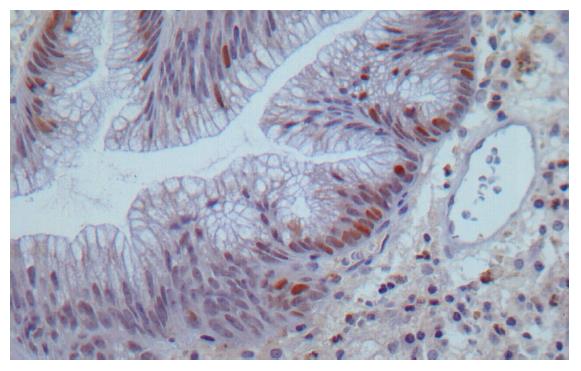
1.2.2 免疫组化方法: 4 μ连续切片, 常规脱蜡和水化. 30 mg/L H2O2室温处理10 min, 以阻断内原性过氧化物酶. 加EDTA缓冲液用高压锅抗原热修复2 min. 滴加Skp2鼠抗人mAb 50 μL, 4 ℃孵育过夜. 按照PV-9000二步法免疫组化检测试剂说明, 加入试剂1, 室温静止20 min; 再滴加试剂2, 室温孵育20 min. DAB显色, 苏木精复染. 以PBS代替一抗作为阴性对照. 阳性结果判定: Skp2阳性细胞为细胞核呈棕黄色(图2). 每张病理切片随机选取10个视野, 每个视野计数100个细胞, 共1000个细胞, 计算着色细胞所占比例, <10%者为阴性, ≥10%者为阳性.
统计学处理 所有数据采用SPSS10.0软件处理, 采用χ2检验及q检验, P<0.05为有统计学意义.
大肠管状腺瘤Skp2 mRNA的相对含量与正常对照组无显著差异(q = 1.52、P>0.05); 绒毛状腺瘤和混合性腺瘤Skp2 mRNA的表达水平显著高于正常对照组(q绒-正 = 5.69, P<0.01; q混-正 = 4.73, P<0.01); 绒毛状腺瘤和混合性腺瘤Skp2 mRNA的相对含量与管状腺瘤组亦有显著差异(q绒-管 = 4.28, P<0.01; q混-管 = 3.26, P<0.05); 但是绒毛状腺瘤和混合性腺瘤间无显著差异(q = 1.15, P>0.05)(表1).
| 分组 | n | Skp2 mRNA相对含量 | Skp2蛋白 | |
| 阳性例数 | 阳性率(%) | |||
| 管状腺瘤 | 20 | 0.43±0.22 | 3 | 15.0 |
| 绒毛状腺瘤 | 15 | 0.71±0.34 | 7 | 46.7 |
| 混合性腺瘤 | 18 | 0.63±0.20 | 5 | 27.8 |
| 正常组 | 20 | 0.34±0.20 | 1 | 5.0 |
细胞核着色呈棕黄色为Skp2蛋白表达阳性. 大肠管状腺瘤、绒毛状腺瘤、混合性腺瘤及正常组Skp2蛋白表达阳性率分别为15%(3/20)、46.7%(7/15)、27.8%(5/18)和5.0%(1/20), 各组间有显著差异(χ2 = 11.6, P<0.05)(表1)
自1974年Morson[2]提出"腺瘤-癌"顺序的大肠癌发生的理论, 越来越多的流行病学、病理学以及临床研究方面的证据表明大肠腺瘤是大肠癌的癌前病变. 研究显示, 肠镜下摘除腺瘤可降低76%-90%的大肠癌发病率[3]. 因此, 积极诊治大肠腺瘤成为控制和减少大肠癌发病的重要途径.
有研究认为腺瘤的生长过程受到不同的因子影响, 有决定形态的因子, 有促进或抑制生长的因子. 因此, 只有在特定人群, 一定大小的腺瘤, 在某个阶段受到促发因素作用, 使其自身的自限性发生了变异才导致癌变. 这是一个复杂的积累过程, 可能伴随着细胞周期调控机制的紊乱. 目前, 研究发现与正常黏膜比较, 小于5 mm的大肠腺瘤处在细胞周期的S期和G2期细胞明显增加.
Skp2是细胞从G1期进入S期的必需因子, 是DNA复制所必需的人类F-box蛋白家族成员[4-5], 通过泛素蛋白酶体途径(ubiquitin proteasome pathway)参与细胞周期的调控. 泛素蛋白酶体途径是真核细胞中一种蛋白降解方式, 主要降解胞内泛素化的蛋白质, 在细胞周期发展、基因转录及信号转导过程中发挥重要作用. Skp2作为泛素连接酶复合物SCF(Skpl-Cullin-F-Box)的底物识别亚基, 特异性识别磷酸化的底物并介导其泛素化降解. 目前研究发现许多恶性肿瘤组织中Skp2的表达呈不同程度增高, 通过对多种靶蛋白的泛素化降解如E2F、cyclinD1、cyclinE、cyclinA、cyclinB、CDC25B、p27kipl、p21wafl及p53, 而与细胞周期调控及肿瘤的发生、发展和预后密切相关[6-11], 有原癌基因的潜能. 国内外大量研究显示, Skp2与肿瘤组织的许多生物学性状相关[12-13]. Ishii et al[14]在肺腺癌细胞珠A549中发现, Skp2过表达不但能够降低细胞周期蛋白p27kipl, cyclinE蛋白表达, 还能增加S期细胞数, 抵抗腺病毒感染引起的细胞凋亡. Hershko et al[15]通过免疫印迹分析和免疫组化的方法检测的20例人结肠直肠癌标本中, p27和Skp2的表达水平呈负相关, 且Skp2在分化良好的结肠直肠癌标本中几乎缺如, 其表达随分化程度的降低而逐渐增高. Shim et al[16]建立了前列腺特异性表达Skp2的转基因鼠模型, 结果这种鼠中Skp表达足以导致前列腺体积增大, 促进不典型增生及低度前列腺癌的发生, Skp2过量表达可下调p27kipl, 但仅局限于不典型增生区域. 我们的实验发现, Skp2 mRNA在大肠腺瘤组织中有不同程度的增高, 并且在3个组织类型中的表达水平不同. 绒毛状腺瘤和混合性腺瘤Skp2 mRNA的表达水平显著高于正常对照组(P<0.01); 而管状腺瘤Skp2 mRNA的相对含量与正常对照组无显著差异(P>0.05); 绒毛状腺瘤和混合性腺瘤Skp2 mRNA的相对含量与管状腺瘤组亦有显著差异(P<0.05); 但是绒毛状腺瘤和混合性腺瘤间无显著差异. 免疫组化结果显示, 15绒毛状腺瘤患者中有7例阳性表达Skp2, 阳性率46.7%; 混合性腺瘤的检出率是27.8%, 管状腺瘤的阳性率为15%, 正常组1例阳性, 统计学分析, 各组间有显著差异(P<0.05). 研究表明, Skp2的表达与大肠腺瘤的组织学类型有关, Skp2在绒毛状腺瘤和混合性腺瘤中呈高表达, 可能对大肠腺瘤的发生发展起促进作用.
Skp2是细胞周期中重要的调节因子, 在肿瘤发生中备受关注. 目前研究发现许多恶性肿瘤组织中Skp2的表达呈不同程度增高, 与细胞周期调控及肿瘤的发生、发展和预后密切相关, 有原癌基因的潜能.
李华山, 副主任医师, 中国医科大学广安门医院肛肠科
大肠腺瘤是大肠癌的癌前病变, 从腺瘤到癌是一个复杂的积累过程, 可能伴随着细胞周期调控机制的紊乱, 这是研究的热点.
Hershko et al通过免疫印迹分析和免疫组化的方法检测的20例人结肠直肠癌标本中, p27和Skp2的表达水平呈负相关, 且Skp2在分化良好的结肠直肠癌标本中几乎缺如, 其表达随分化程度的降低而逐渐增高.
研究Skp2在不同病理类型大肠腺瘤中的表达, 并且从基因及蛋白双重水平上加以证明.
对Skp2的监测及干预有可能成为控制和减少大肠癌发病的重要途径.
本文研究目的明确, 条理清楚, 具有一定的临床意义.
编辑: 李军亮 电编: 何基才
| 1. | Atkin WS, Morson BC, Cuzick J. Long-term risk of colorectal cancer after excision of rectosigmoid adenomas. N Engl J Med. 1992;326:658-662. [PubMed] [DOI] |
| 2. | Morson BC. Evolution of cancer of the colon and rectum. Cancer. 1974;34:suppl: 845-suppl: 849. [PubMed] [DOI] |
| 3. | Winawer SJ, Zauber AG, Ho MN, O'Brien MJ, Gottlieb LS, Sternberg SS, Waye JD, Schapiro M, Bond JH, Panish JF. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med. 1993;329:1977-1981. [PubMed] [DOI] |
| 4. | Ganoth D, Bornstein G, Ko TK, Larsen B, Tyers M, Pagano M, Hershko A. The cell-cycle regulatory protein Cks1 is required for SCF(Skp2)-mediated ubiquitinylation of p27. Nat Cell Biol. 2001;3:321-324. [PubMed] [DOI] |
| 5. | Sutterlüty H, Chatelain E, Marti A, Wirbelauer C, Senften M, Müller U, Krek W. p45SKP2 promotes p27Kip1 degradation and induces S phase in quiescent cells. Nat Cell Biol. 1999;1:207-214. [PubMed] [DOI] |
| 6. | Yokoi S, Yasui K, Saito-Ohara F, Koshikawa K, Iizasa T, Fujisawa T, Terasaki T, Horii A, Takahashi T, Hirohashi S. A novel target gene, SKP2, within the 5p13 amplicon that is frequently detected in small cell lung cancers. Am J Pathol. 2002;161:207-216. [PubMed] [DOI] |
| 7. | Ezoe S, Matsumura I, Nakata S, Gale K, Ishihara K, Minegishi N, Machii T, Kitamura T, Yamamoto M, Enver T. GATA-2/estrogen receptor chimera regulates cytokine-dependent growth of hematopoietic cells through accumulation of p21(WAF1) and p27(Kip1) proteins. Blood. 2002;100:3512-3520. [PubMed] [DOI] |
| 8. | Gstaiger M, Jordan R, Lim M, Catzavelos C, Mestan J, Slingerland J, Krek W. Skp2 is oncogenic and overexpressed in human cancers. Proc Natl Acad Sci USA. 2001;98:5043-5048. [PubMed] [DOI] |
| 9. | Li JQ, Wu F, Masaki T, Kubo A, Fujita J, Dixon DA, Beauchamp RD, Ishida T, Kuriyama S, Imaida K. Correlation of Skp2 with carcinogenesis, invasion, metastasis, and prognosis in colorectal tumors. Int J Oncol. 2004;25:87-95. [PubMed] [DOI] |
| 10. | DeSalle LM, Pagano M. Regulation of the G1 to S transition by the ubiquitin pathway. FEBS Lett. 2001;490:179-189. [PubMed] [DOI] |
| 11. | Shapira M, Ben-Izhak O, Linn S, Futerman B, Minkov I, Hershko DD. The prognostic impact of the ubiquitin ligase subunits Skp2 and Cks1 in colorectal carcinoma. Cancer. 2005;103:1336-1346. [PubMed] [DOI] |
| 12. | Takanami I. The prognostic value of overexpression of Skp2 mRNA in non-small cell lung cancer. Oncol Rep. 2005;13:727-731. [PubMed] [DOI] |
| 13. | Masuda TA, Inoue H, Sonoda H, Mine S, Yoshikawa Y, Nakayama K, Nakayama K, Mori M. Clinical and biological significance of S-phase kinase-associated protein 2 (Skp2) gene expression in gastric carcinoma: modulation of malignant phenotype by Skp2 overexpression, possibly via p27 proteolysis. Cancer Res. 2002;62:3819-3825. [PubMed] |
| 14. | Ishii T, Matsuse T, Masuda M, Teramoto S. The effects of S-phase kinase-associated protein 2 (SKP2) on cell cycle status, viability, and chemoresistance in A549 lung adenocarcinoma cells. Exp Lung Res. 2004;30:687-703. [PubMed] [DOI] |
| 15. | Hershko D, Bornstein G, Ben-Izhak O, Carrano A, Pagano M, Krausz MM, Hershko A. Inverse relation between levels of p27(Kip1) and of its ubiquitin ligase subunit Skp2 in colorectal carcinomas. Cancer. 2001;91:1745-1751. [PubMed] [DOI] |
| 16. | Shim EH, Johnson L, Noh HL, Kim YJ, Sun H, Zeiss C, Zhang H. Expression of the F-box protein SKP2 induces hyperplasia, dysplasia, and low-grade carcinoma in the mouse prostate. Cancer Res. 2003;63:1583-1588. [PubMed] |