修回日期: 2008-01-15
接受日期: 2008-01-23
在线出版日期: 2008-02-18
目的: 初步探讨PUMA(P53 up-regulated modulator of apoptosis)蛋白在胰腺癌发生发展中的作用及其可能机制, 并研究PUMA蛋白表达与临床病理学指标的关系.
方法: 应用免疫组化Envision方法检测60例导管胰腺癌组织石蜡标本中PUMA, Bcl-2和P53蛋白表达以及19例正常胰腺组织石蜡标本中PUMA蛋白表达; TUNEL检测细胞凋亡(AI); 分析PUMA表达与临床病理学指标的关系以及其与AI和P53、Bcl-2表达的相关性.
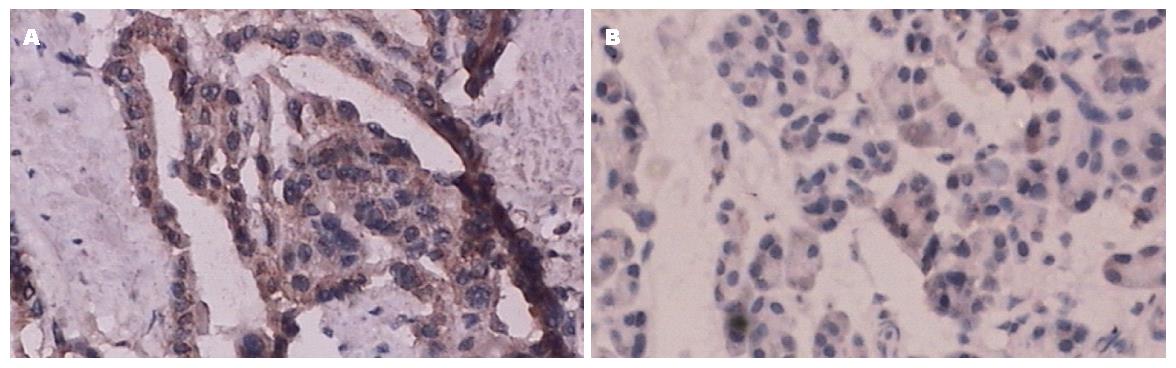
结果: PUMA在胰腺癌组织中的阳性率低于正常胰腺组织, 有统计学差异(30% vs 57.9%, P<0.05); PUMA表达与肿瘤大小, 淋巴结转移和远处转移有关(P<0.05), 而与肿瘤分化程度和TNM分期无关; AI在PUMA阳性和阴性表达的肿瘤组织中, 有统计学差异(20.63%±6.27% vs 17.44%±5.86%, P<0.05); P53和Bcl-2在胰腺癌中的表达率分别为46.7%(28/60)和41.7%(25/60); PUMA与P53和Bcl-2表达分别有显著的相关性(P = 0.013, P = 0.046).
结论: 胰腺癌的生长、淋巴结和远处转移与PUMA蛋白表达缺失有关, PUMA可能是胰腺癌基因治疗的新粑点.
引文著录: 张克君, 李德春, 朱东明. PUMA蛋白在胰腺癌中的表达及临床意义. 世界华人消化杂志 2008; 16(5): 488-492
Revised: January 15, 2008
Accepted: January 23, 2008
Published online: February 18, 2008
AIM: To investigate the role of PUMA in development of pancreatic cancer (PC) and its mechanism as well as its correlation with P53 up-regulate dmodulator of apoptosis (PUMA) expression and clinicopathologic parameters.
METHODS: Expression of PUMA, P53 and Bcl-2 in 60 PC tissue samples and 19 normal pancreatic tissue samples was assessed with immunohistochemical Envision method. Apoptosis index (AI) was detected with TUNEL method. Correlations between expressions of P53 up-regulated modulator of apoptosis (PUMA), P53, Bcl-2, AI and clinicopathologic parameters were analyzed.
RESULTS: The positive rate of PUMA expression was significantly lower in PC tissue samples than in normal pancreatic tissue samples (30% vs 52.6%, P < 0.05). The PUMA expression was correlated with tumor size, lymph node and distant metastasis (P < 0.05), but not with any other clinical or pathological parameters. The AI of positive and negative PUMA expression in PC tissue samples was 20.63% ± 6.27% and 17.44% ± 5.86%, respectively (P < 0.05). The positive rate of P53 and Bcl-2 expression in PC tissue samples was 46.7% (28/60) and 41.7% (25/60), respectively. Expression of PUMA was closely related with that of Bcl-2 and P53 in PC tissue samples (P < 0.05).
CONCLUSION: Absent PUMA expression in PC tissue is related with the development of PC and lymph node and distant metastasis. PUMA may be a new target for the treatment of PC.
- Citation: Zhang KJ, Li DC, Zhu DM. PUMA expression in pancreatic cancer and its clinical significance. Shijie Huaren Xiaohua Zazhi 2008; 16(5): 488-492
- URL: https://www.wjgnet.com/1009-3079/full/v16/i5/488.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i5.488
细胞凋亡受阻是胰腺癌发生的重要原因, 而高侵袭性和高转移性是大部分患者无法获得根治性治疗的主要因素[1-4]. 深入阐明胰腺癌浸润转移和生长的分子机制, 对于寻找胰腺癌诊治的新靶点, 提高其疗效具有重要的临床意义. PUMA(P53 up-regulated modulator of apoptosis)是新近发现的Bcl-2家族BH-3亚家族中的成员, 是P53介导的下游促凋亡基因[5-7]. 体外实验表明[6-8], 转染外源性PUMA基因可以诱导肿瘤细胞的快速凋亡和抑制集落形成, 而PUMA基因沉默后, 肿瘤细胞的凋亡能力明显减弱, 说明PUMA能促进细胞凋亡, 抑制肿瘤细胞生长, 而PUMA表达缺失可促进肿瘤细胞的生长. 临床研究中发现[9-11], 许多恶性肿瘤中存在PUMA表达缺失, 而PUMA表达缺失与肿瘤的远处和淋巴结转移有相关性, 在某些肿瘤, PUMA表达缺失与肿瘤大小和5年生存率明显相关. 本文采用免疫组化技术研究PUMA蛋白表达与胰腺癌临床病理因素的相关性及意义.
收集苏州大学第一附属医院、青岛大学第一附属医院、四川大学华西医院普外科2001-05/2006-05病理诊断均为导管腺癌的60例胰腺癌石蜡标本(临床资料完整), 男39例, 女21例, 年龄35-71(中位数56)岁; 肿瘤直径小于4 cm者22例, 大于或等于4 cm者38例; 高分化30例, 中分化13例, 低分化17例; 根据TNM分期(1997恶性肿瘤国际临床病期分类)标准: Ⅰ13例、Ⅱ12例、Ⅲ 15例、Ⅳ 20例; 伴有淋巴结转移32例, 无淋巴结转移28例; 远处转移者20例(肝转移、腹膜和网膜种植等); 19例正常胰腺组织标本, 取自壶腹癌、胰腺内分泌肿瘤和外伤的患者. 所有患者均为第一次手术, 术前未经任何放化疗. 兔抗人PUMA多克隆抗体为美国Cell Signaling公司产品, Bcl-2和P53抗体购自北京中山, 二抗: Envision试剂为即用型试剂, 购自Dako公司, TUNEL检测试剂盒购自罗氏公司.
1.2.1 免疫组织化学染色: 采用Envision二步法检测操作流程, 具体操作步骤按照说明书进行. 判定结果: PUMA和Bcl-2阳性判断标准以胞质内出现棕黄染色为阳性, P53阳性判断标准以胞核内出现棕黄染色为阳性. 用专业图像分析系统分析阳性程度: 阳性反应的强度分为-(≤10%), 弱阳性+(10%-20%), 中度阳性++(20%-51%), 强阳性+++(>51%).
1.2.2 凋亡细胞原位缺口末端标记(TUNEL)法检测细胞凋亡: 具体操作按照说明书进行. 结果判断以细胞核中有棕黄色颗粒为阳性细胞, 即凋亡细胞. 随机计数5个以上高倍视野, 不少于1000个细胞, 将凋亡细胞与总细胞比值定义为凋亡指数(AI).
统计学处理 应用SAS6.0统计软件, 采用χ2检验, 以P<0.05为差异有显著性.
PUMA阳性表达主要在细胞质内, 部分质核内同时表达. 60例胰腺癌组织中18例表达阳性, 阳性率30%; 在19例正常胰腺组织中11例表达阳性, 阳性率57.9%. PUMA在肿瘤组织中的阳性率明显低于正常胰腺组织, 差异有显著性(P = 0.028)(图1, 表1).
| 分组 | - | + | ++ | +++ | % |
| 胰腺癌组织 | 42 | 8 | 5 | 5 | 30 |
| 正常胰腺组织 | 8 | 8 | 3 | 0 | 57.9 |
在胰腺癌组织中, PUMA蛋白表达与肿瘤分化程度、TNM分期无关(P>0.05); PUMA在远处转移组和淋巴结转移组的阳性表达率低于非远处转移组和非淋巴结转移组(P<0.05), 在肿瘤大于4 cm组的阳性表达率低于肿瘤小于4 cm组(P<0.05, 表2).
| 分期 | 分类 | n | 阳性率(n/n) | P |
| 肿瘤直径 | <4 cm | 22 | 10/22 | |
| ≥4 cm | 38 | 8/38 | 0.047 | |
| 分化程度 | 高 | 30 | 9/30 | |
| 中 | 13 | 5/13 | ||
| 低 | 17 | 4/17 | 0.72 | |
| 分期 | Ⅰ | 13 | 4/13 | |
| Ⅱ | 12 | 6/12 | ||
| Ⅲ+Ⅳ | 35 | 8/35 | 0.373 | |
| 淋巴结转移 | 有 | 32 | 3/32 | |
| 无 | 28 | 15/28 | 0.045 | |
| 远处转移 | 有 | 20 | 2/20 | |
| 40 | 10/22 | 0.017 |
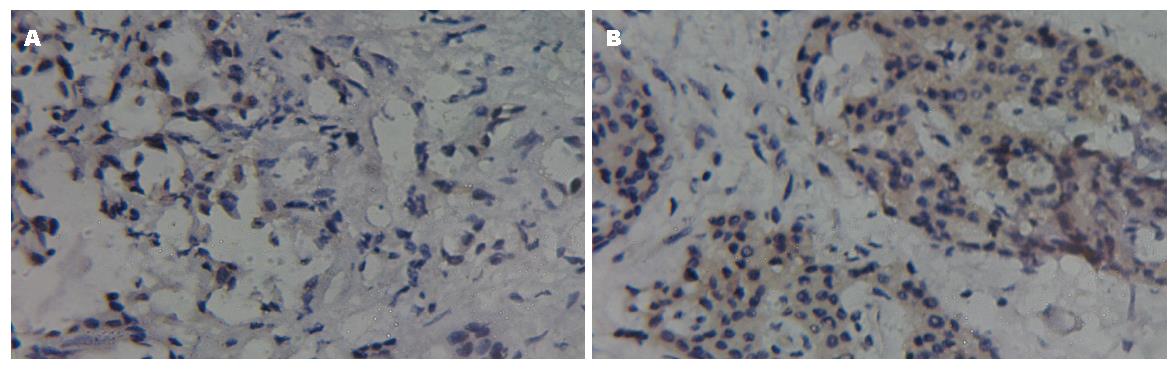
在PUMA阳性和阴性表达的胰腺癌组织中, AI分别20.63%±6.27%和17.44%±5.86%, 差异有显著性(P<0.05, 图2).
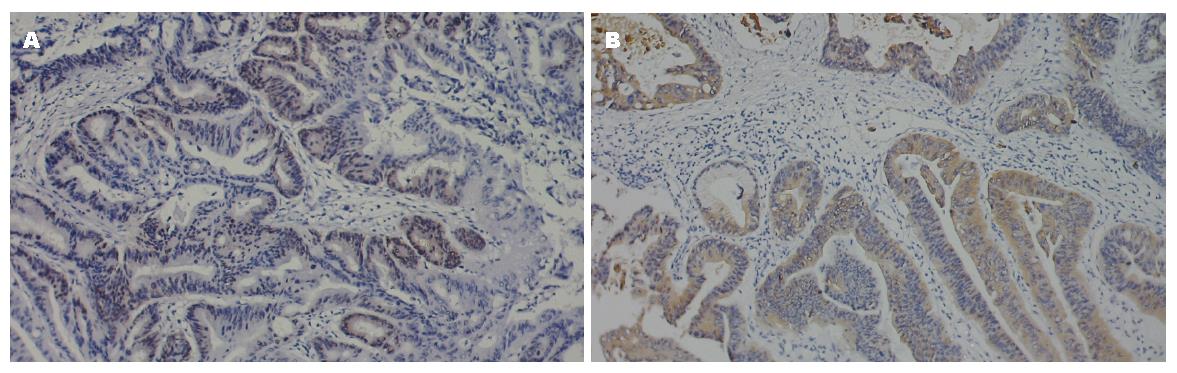
18例PUMA阳性表达胰腺癌组织中, Bcl-2阳性4例, P53阳性4例, 42例PUMA阴性表达的胰腺癌组织中, Bcl-2阳性21例, P53阳性24例, PUMA与Bcl-2明显相关(χ2 = 4.0, P = 0.046), PUMA与P53表达有明显相关性(χ2 = 6.173, P = 0.013)(图3, 表3).
| PUMA | n | P53 | Bcl-2 | ||
| ≤10% | >10% | ≤10% | >10% | ||
| ≤10% | 42 | 18 | 24 | 21 | 21 |
| >10% | 18 | 14 | 4 | 14 | 4 |
PUMA是P53下游的关键性促凋亡基因, 许多恶性肿瘤存在PUMA表达缺失, 而且PUMA表达缺失在不同肿瘤组织中的意义不尽相同. 如 PUMA表达缺失与结肠癌远处转移有相关性, 而与其他病理因素无相关性[9]; 在恶性黑色素瘤中[10-11], PUMA表达缺失与淋巴结转移和5年生存率明显相关, 除此之外, PUMA表达缺失还与黑色素瘤大小和分期相关.
本研究显示, PUMA在胰腺癌组织中的阳性表达率明显低于正常胰腺组织, 提示胰腺癌组织中存在PUMA表达缺失. 分析PUMA表达与临床病理学指标的关系中发现, PUMA蛋白表达水平与胰腺癌肿块的大小有关: 在<4 cm的肿瘤组织中, PUMA表达率较高(10/22), 在≥4 cm的肿瘤组织, PUMA表达较低(8/38). 凋亡检测证实PUMA缺失的肿瘤组织中AI较低, 而PUMA阳性表达的肿瘤组织中AI较高. 由于PUMA具有凋亡促进作用, PUMA表达高者加快细胞凋亡, PUMA表达缺失者细胞凋亡减慢[8-9], 因此, PUMA表达缺失所导致的细胞凋亡能力的下降可能是胰腺癌肿瘤生长和肿块大小不同的原因之一.
PUMA可以通过P53依赖性途径以及P53非依赖性两条途径促进细胞凋亡[14-17]. 在本实验中, PUMA表达缺失肿瘤组织存在高频率P53突变, 而在PUMA表达阳性肿瘤组织存在低频率P53突变, PUMA和P53表达明显负相关, 说明PUMA在胰腺癌内是依赖内源性P53途径发挥作用. P53变异后丧失了对PUMA的正向调节作用, 致使PUMA表达缺失. Bcl-2是PUMA下游的凋亡抑制基因, 当PUMA基因诱导表达后, PUMA可以与Bcl-2/bcl-xL结合, 中和Bcl-2/bcl-xL的凋亡抑制活动[18-19]. 本研究发现, 胰腺癌中PUMA和Bcl-2表达有明显负相关关系, 所以胰腺癌中PUMA表达缺失后, 对Bcl-2/与Bcl-XL的中和作用减弱或消失, 从而使Bcl-2抑凋亡效用加强. 本实验表明, 胰腺癌组织中PUMA的凋亡调节作用可能是P53-PUMA-Bcl-2途径.
分析PUMA表达与临床病理学指标的关系中发现: PUMA表达水平与淋巴结转移和远处转移有明显相关性, 在淋巴结和远处转移组织中存在PUMA表达缺失, 在非转移组织存在高水平的PUMA表达. Gansauge et al[20]和Tomaszewska et al[21]报道, P53突变和Bcl-2高表达与胰腺癌的淋巴结转移和远处转移明显相关, 在高转移性胰腺癌中存在高频率P53突变和Bcl-2表达. 本实验证实了P53和Bcl-2与PUMA表达有明显的负相关, 而PUMA既受P53调节又调节下游的Bcl-2, 因而, PUMA是否直接参入胰腺癌的转移过程有待于进一步研究.
我们的研究还发现, PUMA在不同分期和不同分化肿瘤组织的阳性表达率差异分别无统计学意义(P>0.05), 说明PUMA与肿瘤分化程度和分期无明显相关. 我们收集的资料由于失访及其他原因亦未进行生存分析.
Ad-P53是胰腺癌治疗的有效基因, 但P53对于来不同源甚至同种来源的肿瘤细胞对P53的易感性不一致, 使得P53进入细胞受到阻碍, 因此P53并不是对所有肿瘤有效, 对来源相同的肿瘤细胞的治疗效果也不相同[22-25].
本研究发现, PUMA表达缺失与肿瘤生长和转移有关, 因此转染外源性PUMA基因对促进细胞凋亡及抑制肿瘤转移可能有重要作用, 也为外源导入P53诱导凋亡效果不好的肿瘤提供了新的可能治疗靶点. 但要使其成为可能, 一方面需要明确PUMA的作用通路, 阐明他与其他相关基因相互作用的机制; 另一方面需要寻找到能导致PUMA激活的DNA元件、转录因子及其他无毒性的小分子物质, 这样就可以利用这些物质激活PUMA在肿瘤细胞内强表达, 达到治疗的目的.
PUMA是近年发现的位于P53下游的基因, 具有强大的促凋亡作用和细胞生长抑制作用. 许多肿瘤组织存在PUMA低表达, 其低表达水平与肿瘤的发生、发展有关, 而增加肿瘤细胞PUMA表达可明显地抑制肿瘤生长, 并能增强肿瘤细胞对放疗和化疗的敏感性.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
PUMA在实体肿瘤表达的文献报道只见于肝癌、胃癌、结直肠癌、鼻咽癌、头颈癌、恶性黑色素瘤等, 在胰腺癌中未见报道.
本文以免疫组化的方法研究PUMA在胰腺癌组织的表达情况以及与临床病理因素的关系, 并探讨PUMA在胰腺癌中的作用及其可能机制.
本研究为胰腺癌基因治疗提供了新的靶点, 同时为外源导入P53诱导凋亡效果不好的肿瘤提供了新的可能治疗靶点.
本文选题较新颖, 学术价值较好, 研究方法科学, 数据客观, 结论明确, 有较好的学术价值.
编辑: 师忠芳 电编: 郭海丽
| 1. | Welsch T, Kleeff J, Friess H. Molecular pathogenesis of pancreatic cancer: advances and challenges. Curr Mol Med. 2007;7:504-521. [PubMed] [DOI] |
| 2. | Adrian TE. Inhibition of pancreatic cancer cell growth. Cell Mol Life Sci. 2007;64:2512-2521. [PubMed] [DOI] |
| 3. | Mimeault M, Hauke R, Mehta PP, Batra SK. Recent advances in cancer stem/progenitor cell research: therapeutic implications for overcoming resistance to the most aggressive cancers. J Cell Mol Med. 2007;11:981-1011. [PubMed] [DOI] |
| 4. | Westphal S, Kalthoff H. Apoptosis: targets in pancreatic cancer. Mol Cancer. 2003;2:6. [PubMed] [DOI] |
| 5. | Yu J, Zhang L, Hwang PM, Kinzler KW, Vogelstein B. PUMA induces the rapid apoptosis of colorectal cancer cells. Mol Cell. 2001;7:673-682. [PubMed] [DOI] |
| 6. | Nakano K, Vousden KH. PUMA, a novel proapoptotic gene, is induced by p53. Mol Cell. 2001;7:683-694. [PubMed] [DOI] |
| 7. | Chipuk JE, Bouchier-Hayes L, Kuwana T, Newmeyer DD, Green DR. PUMA couples the nuclear and cytoplasmic proapoptotic function of p53. Science. 2005;309:1732-1735. [PubMed] [DOI] |
| 8. | Hemann MT, Zilfou JT, Zhao Z, Burgess DJ, Hannon GJ, Lowe SW. Suppression of tumorigenesis by the p53 target PUMA. Proc Natl Acad Sci USA. 2004;101:9333-9338. [PubMed] [DOI] |
| 9. | Jansson A, Arbman G, Sun XF. mRNA and protein expression of PUMA in sporadic colorectal cancer. Oncol Rep. 2004;12:1245-1249. [PubMed] [DOI] |
| 10. | Karst AM, Dai DL, Martinka M, Li G. PUMA expression is significantly reduced in human cutaneous melanomas. Oncogene. 2005;24:1111-1116. [PubMed] [DOI] |
| 11. | Karst AM, Dai DL, Cheng JQ, Li G. Role of p53 up-regulated modulator of apoptosis and phosphorylated Akt in melanoma cell growth, apoptosis, and patient survival. Cancer Res. 2006;66:9221-9226. [PubMed] [DOI] |
| 12. | Gu J, Zhang L, Swisher SG, Liu J, Roth JA, Fang B. Induction of p53-regulated genes in lung cancer cells: implications of the mechanism for adenoviral p53-mediated apoptosis. Oncogene. 2004;23:1300-1307. [PubMed] [DOI] |
| 13. | Jeffers JR, Parganas E, Lee Y, Yang C, Wang J, Brennan J, MacLean KH, Han J, Chittenden T, Ihle JN. Puma is an essential mediator of p53-dependent and -independent apoptotic pathways. Cancer Cell. 2003;4:321-328. [PubMed] [DOI] |
| 14. | Villunger A, Michalak EM, Coultas L, Müllauer F, Böck G, Ausserlechner MJ, Adams JM, Strasser A. p53- and drug-induced apoptotic responses mediated by BH3-only proteins puma and noxa. Science. 2003;302:1036-1038. [PubMed] [DOI] |
| 15. | Callus BA, Ekert PG, Heraud JE, Jabbour AM, Kotevski A, Vince JE, Silke J, Vaux DL. Cytoplasmic p53 is not required for PUMA-induced apoptosis. Cell Death Differ. 2008;15:213-215; author reply 215-216. [PubMed] [DOI] |
| 16. | You X, Boyle DL, Hammaker D, Firestein GS. PUMA-mediated apoptosis in fibroblast-like synoviocytes does not require p53. Arthritis Res Ther. 2006;8:R157. [PubMed] [DOI] |
| 17. | Ito H, Kanzawa T, Miyoshi T, Hirohata S, Kyo S, Iwamaru A, Aoki H, Kondo Y, Kondo S. Therapeutic efficacy of PUMA for malignant glioma cells regardless of p53 status. Hum Gene Ther. 2005;16:685-698. [PubMed] [DOI] |
| 18. | Luo X, He Q, Huang Y, Sheikh MS. Transcriptional upregulation of PUMA modulates endoplasmic reticulum calcium pool depletion-induced apoptosis via Bax activation. Cell Death Differ. 2005;12:1310-1318. [PubMed] [DOI] |
| 19. | Liu FT, Newland AC, Jia L. Bax conformational change is a crucial step for PUMA-mediated apoptosis in human leukemia. Biochem Biophys Res Commun. 2003;310:956-962. [PubMed] [DOI] |
| 20. | Gansauge F, Gansauge S, Schmidt E, Müller J, Beger HG. Prognostic significance of molecular alterations in human pancreatic carcinoma--an immunohistological study. Langenbecks Arch Surg. 1998;383:152-155. [PubMed] [DOI] |
| 21. | Tomaszewska R, Karcz D, Stachura J. An immunohistochemical study of the expression of bcl-2 and p53 oncoproteins in pancreatic intraepithelial neoplasia and pancreatic cancer. Int J Pancreatol. 1999;26:163-171. [PubMed] [DOI] |
| 22. | Liu Q, El-Deiry WS, Gazitt Y. Additive effect of Apo2L/TRAIL and Adeno-p53 in the induction of apoptosis in myeloma cell lines. Exp Hematol. 2001;29:962-970. [PubMed] [DOI] |
| 23. | Schuler M, Herrmann R, De Greve JL, Stewart AK, Gatzemeier U, Stewart DJ, Laufman L, Gralla R, Kuball J, Buhl R. Adenovirus-mediated wild-type p53 gene transfer in patients receiving chemotherapy for advanced non-small-cell lung cancer: results of a multicenter phase II study. J Clin Oncol. 2001;19:1750-1758. [PubMed] |
| 24. | Jenks S. Gene therapy death--"everyone has to share in the guilt". J Natl Cancer Inst. 2000;92:98-100. [PubMed] [DOI] |
| 25. | Zeimet AG, Marth C. Why did p53 gene therapy fail in ovarian cancer? Lancet Oncol. 2003;4:415-422. [PubMed] [DOI] |