修回日期: 2008-01-08
接受日期: 2008-01-15
在线出版日期: 2008-02-08
目的: 探讨血红素氧合酶2(HO-2)在吗啡诱导的结肠慢传输运动小鼠近端结肠组织中的表达, 和其在慢传输型便秘发生发展中的作用.
方法: 将48只小鼠随机分为实验组A, 实验组B和对照组, 每组16只. 实验组小鼠sc不同剂量吗啡, 实验组A: 2.5 mg/(kg·d)和实验组B: 3.5 mg/(kg·d), 共45 d, 建立肠道慢传输运动小鼠模型, 对照组以等量生理盐水处理; 45 d后各组小鼠随机处死一半. 剩余小鼠分别对应作为实验组A2, 实验组B2和对照组2, 不作处理观察15 d, 再全部处死. 用免疫组化技术比较各组小鼠近端结肠组织中HO-2阳性细胞的表达情况.
结果: 在实验组和对照组小鼠结肠组织中HO-2均有表达; 实验组较正常组表达显著减少; 实验组B较实验组A的表达明显减少; 停用吗啡观察15 d后各实验组较45 d时各实验组表达明显减少.
结论: 吗啡诱导的肠道慢传输运动小鼠结肠组织中HO-2表达显著减少, 并与吗啡剂量和时间有关, 提示抑制性神经递质CO异常减少可能是肠道慢传输运动的病因之一.
引文著录: 姜柳琴, 林琳, 张红杰, 胡晔东, 林征, 王美峰. 血红素氧合酶2在吗啡诱导的结肠慢传输型便秘小鼠结肠中的表达及意义. 世界华人消化杂志 2008; 16(4): 422-425
Revised: January 8, 2008
Accepted: January 15, 2008
Published online: February 8, 2008
AIM: To study the expression and changes of heme oxygenase-2 (HO-2) in a mouse model of morphine induced colon slow transit motility and the role of HO-2 in the development of slow transit motility constipation.
METHODS: Forty-eight mice were randomly divided into test A group (n = 16), test B group (n = 16) and control 1 group. A mouse model was established by subcutaneous injection of morphine [2.5 mg/(kg·d) in test A1 and 3.5 mg/(kg·d) in test B1] for 45 days, and the control group 1 was established by normal saline injection at the same dosage. On the 45th day, 8 mice from each group were killed. The remaining as test A2, test B2 and control group 2 mice received no treatment and were observed for 15 days, and then killed. The intestinal transit rate for mice in each group was detected by activated charcoal suspension pushing test, and the expression of HO-2+ cells in proximal colon tissue was determined by immunohistochemistry.
RESULTS: The intestinal transit rate was decreased obviously in all test groups than in the control group, which was lower in test B than in test A. The intestinal transit rate for all test groups was significantly lower 15 days after colon slow transit motility constipation induced by morphine than 45 days before colon slow transit motility constipation induced by morphine.
CONCLUSION: The c-kit+ cells are more obviously decreased in mouse proximal colon tissue with slow-transit motility constipation induced by morphine, and correlated with the dose and time of morphine used, suggesting that changes in nerve transmitter CO are one of the factors for colon slow-transit motility constipation.
- Citation: Jiang LQ, Lin L, Zhang HJ, Hu YD, Lin Z, Wang MF. Expression of heme oxygenase-2 in mouse model of colon slow transit motility constipation induced by morphine and its significance. Shijie Huaren Xiaohua Zazhi 2008; 16(4): 422-425
- URL: https://www.wjgnet.com/1009-3079/full/v16/i4/422.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i4.422
内源性一氧化碳(CO)是肠道非肾上腺素非胆碱能神经(NANC)分泌的抑制性神经递质, 对调节胃肠运动有重要作用[1]. 血红素氧合酶(HO)是CO合成的关键酶, 有三种同工酶[2], 即诱导型HO(HO-1), 原生型HO(HO-2)和HO-3[3](不产生CO, 功能尚不清楚). CO和NO在人体某些功能中的作用较相似, 是重要的化学信号物质, 调节神经递质传导、平滑肌的紧张性及其对细胞损伤的反应[4], 并在细胞功能和信息联络发挥重要的信号转导作用.
清洁级ICR小鼠48只, 雌雄各半, 每只体质量25-30 g, 购于江苏省实验动物中心(南京医科大学实验动物中心).
1.2.1 造模和分组[5]: 将48只小鼠随机分为实验组A, 实验组B和对照组(n = 16). 实验组A和B分别sc吗啡2.5 mg/(kg·d)和3.5 mg/(kg·d), 对照组以等量生理盐水, 处理45 d. 各组随机处死小鼠一半(为实验组A1、B1及对照组1). 其余小鼠继续饲养并停药观察15 d(实验组A2、B2及对照组2). 第60天处死全部小鼠, 处死前予炭末推进法评价结肠传输运动功能符合结肠慢传输运动小鼠模型[5], 取各组小鼠近端及远端结肠组织各0.5 cm. 小鼠粪便性状采用Bristol分级[5].
1.2.2 免疫组织化学检测HO-2表达: HO-2一抗及免疫组化试剂盒均购自Promega公司; 二抗(羊抗兔抗体, 工作液浓度)购自北京中山生物科技公司. 按说明书进行常规免疫组化检测, PBS代替一抗作为阴性对照. 阳性结果判断: 胞质染色呈棕色者判定为阳性细胞.
统计学处理 实验数据采用mean±SD表示, 录入SPSS软件包, 采用两均数t检验, P<0.05为有显著性差异.
第45天各实验组小鼠粪便性状1-2级较对照组4-5级明显干硬. 第60天各实验组小鼠粪便性状较第45天时无明显改变, 但较对照组明显干硬.
第45天各实验组小鼠的肠道碳墨推进率较对照组明显减慢(P<0.01). 第60天各实验组小鼠的肠道碳墨推进率较对照组明显减慢(P<0.01), 且比45 d时相应实验组的肠道碳墨推进率也减慢(P<0.05, 表1).
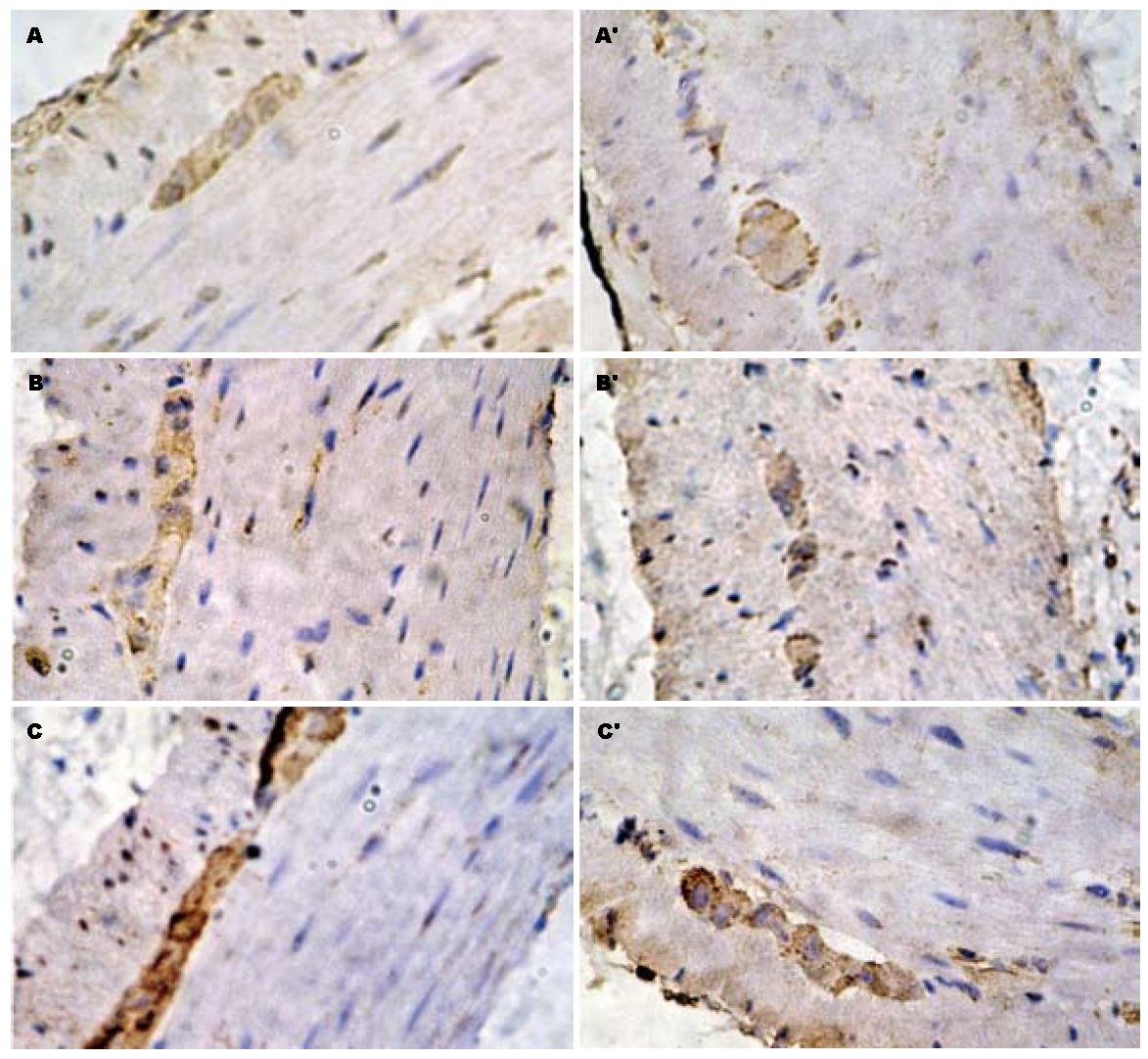
结肠黏膜下神经丛与肌间神经丛可见丰富的深棕色颗粒, 即HO-2阳性神经纤维, 环肌和纵肌内HO-2阳性细胞较黏膜下、肌间层明显减少. 各实验组阳性细胞较对照组明显减少; 大剂量吗啡处理的实验组比小剂量组阳性细胞明显少; 第60天时各实验组较第45天时各实验组HO-2阳性细胞的表达减少(图1).
内源性CO和NO都是气体分子, 两者在理化性质、分子结构和生物学作用上有许多相似之处[1]. NO作为抑制性神经递质, 其在体内的生理病理作用已得到广泛的肯定[1]. 而内源性的CO与NO一样起着抑制性神经递质的作用, 在消化系统影响胃肠运动[1,6]; 其含量异常增多时, 胃肠道有效的推进性收缩幅度、频率减少; 其含量异常减少时, 兴奋性和抑制性神经活动失平衡, 导致胃肠道持续性剧烈地非推进性收缩幅度、频率增加, 使胃肠平滑肌不协调运动.
HO-1和HO-2都位于细胞内质网中[7]; HO-1主要分布于单核-巨噬细胞系统(脾、肝和骨髓)及网状内皮细胞内, HO-2则主要分布于脑和胃肠道平滑肌[8], 胃肠道的HO-2主要分布于肠道黏膜下神经丛与肌间神经丛[9], 应激能提高HO-2活性[10-11].
本实验用吗啡诱导的小鼠结肠慢传输运动模型, 根据大便性状改变及肠道推进率基本符合慢传输型便秘的临床特征[5]. 在本实验中, 各实验组小鼠近端结肠组织内HO-2+细胞面积的表达均较对照组的明显减少, 并且随着吗啡剂量的增加减少更明显, 推测吗啡诱导的结肠慢传输运动小鼠其内源性CO生成减少可能导致结肠运动异常, 胃肠道内源性CO可能参与了结肠慢传输运动的发生, 与NO的作用机制可能相似. 而停药观察15 d后, 各实验组较45 d组进一步减少, 说明短期停药不能逆转吗啡诱导的结肠传输运动障碍, 可能其停药时间过短发生的病理改变尚未恢复, 也可能其改变为不可逆性的.
胃肠道平滑肌细胞HO-2免疫活性阴性, 而其临近的ICC为阳性[12]. 肠道某些非神经细胞也表达HO-2, 包括黏膜上皮细胞、血管平滑肌细胞、血管内皮细胞和ICC[3,13]. CO在ICC与平滑肌间作为第二信使而调节胃肠运动[14]. 本实验中吗啡诱导的结肠慢传输运动小鼠近端结肠组织内HO-2的表达减少, 是否与ICC自身产生减少或与ICC调节CO对胃肠平滑肌的作用减弱有关尚待进一步研究.
慢性便秘是消化系统常见疾病之一, 影响了相当多患者的工作生活. 慢性便秘分类较多, 结肠慢传输型便秘是其中之一. 目前临床越来越关注患者的生活质量, 对功能性疾病的研究不断深入.
李华山, 副主任医师, 中国中医科学院广安门医院肛肠科
目前已经开始在分子水平对慢性便秘疾病进行研究, 临床上已获得一部分成果; 小分子神经递质的研究取得了相当的成绩, 而内源性CO也为其中之一.
通过本实验室以吗啡构建结肠慢传输型便秘小鼠模型, 在此基础上观察内源性CO及HO的变化; 此类模型为本实验室首次应用在便秘研究上.
本文拟说明内源性CO可能在慢传输型便秘中起的重要作用. 对将来治疗慢性便秘带来新的启发和思路.
本课科学性明确, 层次分明, 证据充足, 结论可靠, 具有一定的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Xue L, Farrugia G, Miller SM, Ferris CD, Snyder SH, Szurszewski JH. Carbon monoxide and nitric oxide as coneurotransmitters in the enteric nervous system: evidence from genomic deletion of biosynthetic enzymes. Proc Natl Acad Sci USA. 2000;97:1851-1855. [PubMed] [DOI] |
| 2. | McCoubrey WK, Huang TJ, Maines MD. Isolation and characterization of a cDNA from the rat brain that encodes hemoprotein heme oxygenase-3. Eur J Biochem. 1997;247:725-732. [PubMed] [DOI] |
| 3. | Farrugia G, Miller SM, Rich A, Liu X, Maines MD, Rae JL, Szurszewski JH. Distribution of heme oxygenase and effects of exogenous carbon monoxide in canine jejunum. Am J Physiol. 1998;274:G350-G358. [PubMed] |
| 4. | Gibbons SJ, Farrugia G. The role of carbon monoxide in the gastrointestinal tract. J Physiol. 2004;556:325-336. [PubMed] [DOI] |
| 6. | Farrugia G, Lei S, Lin X, Miller SM, Nath KA, Ferris CD, Levitt M, Szurszewski JH. A major role for carbon monoxide as an endogenous hyperpolarizing factor in the gastrointestinal tract. Proc Natl Acad Sci USA. 2003;100:8567-8570. [PubMed] [DOI] |
| 7. | Chakder S, Cao GY, Lynn RB, Rattan S. Heme oxygenase activity in the internal anal sphincter: effects of nonadrenergic, noncholinergic nerve stimulation. Gastroenterology. 2000;118:477-486. [PubMed] [DOI] |
| 8. | Doré S, Takahashi M, Ferris CD, Zakhary R, Hester LD, Guastella D, Snyder SH. Bilirubin, formed by activation of heme oxygenase-2, protects neurons against oxidative stress injury. Proc Natl Acad Sci USA. 1999;96:2445-2450. [PubMed] [DOI] |
| 9. | Piotrowska AP, Solari V, de Caluwé D, Puri P. Immunocolocalization of the heme oxygenase-2 and interstitial cells of Cajal in normal and aganglionic colon. J Pediatr Surg. 2003;38:73-77. [PubMed] [DOI] |
| 10. | Porcher C, Orsoni P, Berdah S, Monges G, Mazet B. Distribution of heme oxygenase 2 in nerves and c-kit(+) interstitial cells in human stomach. Histochem Cell Biol. 1999;112:317-322. [PubMed] [DOI] |
| 11. | Miller SM, Reed D, Sarr MG, Farrugia G, Szurszewski JH. Haem oxygenase in enteric nervous system of human stomach and jejunum and co-localization with nitric oxide synthase. Neurogastroenterol Motil. 2001;13:121-131. [PubMed] [DOI] |
| 12. | Battish R, Cao GY, Lynn RB, Chakder S, Rattan S. Heme oxygenase-2 distribution in anorectum: colocalization with neuronal nitric oxide synthase. Am J Physiol Gastrointest Liver Physiol. 2000;278:G148-G155. [PubMed] |
| 13. | van Ginneken C, van Meir F, Sys S, Weyns A. Stereologic description of the changing expression of constitutive nitric oxide synthase and heme oxygenase in the enteric plexuses of the pig small intestine during development. J Comp Neurol. 2001;437:118-128. [PubMed] [DOI] |
| 14. | Farrugia G, Szurszewski JH. Heme oxygenase, carbon monoxide, and interstitial cells of Cajal. Microsc Res Tech. 1999;47:321-324. [PubMed] [DOI] |