修回日期: 2008-01-15
接受日期: 2008-01-20
在线出版日期: 2008-02-08
目的: 探讨茶多酚对酒精性肝病大鼠TNF-α表达及肝细胞病变的影响.
方法: 29只大鼠随机分为: 对照组、模型组、茶多酚干预组. 白酒ig建模, 茶多酚干预. 常规切片及特染评价肝组织病变, 检测血清AST、ALT、MDA含量, ELISA法检测血清TNF-α、RT-PCR检测肝组织TNF-α mRNA表达.
结果: 与模型组相比, 茶多酚干预组大鼠肝组织学评分(3.00±1.59 vs 4.50±1.31, P<0.05), 血清AST、MDA绝对值(87.33±61.00 vs 226.40±81.34, 2.75±0.72 vs 7.34±3.06, P<0.05), 肝组织TNF-α mRNA表达与TNF-α血清含量均降低(0.55±0.05 vs 0.73±0.07, 4.45±0.83 vs 14.33±1.87; P<0.05).
结论: 茶多酚保护肝细胞线粒体, 减轻脂质过氧化, 减少TNF-α的合成释放.
引文著录: 李芬, 管小琴, 刘利. 茶多酚对酒精性肝病大鼠TNF-α及肝细胞的影响. 世界华人消化杂志 2008; 16(4): 356-360
Revised: January 15, 2008
Accepted: January 20, 2008
Published online: February 8, 2008
AIM: To investigate the effect of tea polyphenols on tumor necrisis factor-alpha (TNF-α) expression and liver pathological change in rats with alcoholic liver disease.
METHODS: Twenty-nine Wistar rats were randomly divided into normal group, model group, and tea polyphenols-intervened group. A model of alcoholic liver disease was induced by gastric perfusion with alcohol and intervened with tea polyphenols. Liver tissue sections were stained with H&E. Serum levels of AST, ALT and MDA were determined. Serum TNF-α was detected by ELISA. RT-PCR was performed to determine TNF-α expression in liver tissue.
RESULTS: The scores of pathology (3.00 ± 1.59 vs 4.50 ± 1.31, P < 0.05), serum levels of AST and MDA (87.33 ± 61.00 vs 226.4 ± 81.34, 2.75 ± 0.72 vs 7.34 ± 3.06, P < 0.05) as well as TNF-α (0.55 ± 0.05 vs 0.73 ± 0.07, P < 0.05) and TNF-α mRNA expression (0.55 ± 0.05 vs 0.73 ± 0.07, P < 0.05; 4.45 ± 0.83 vs 14.33 ± 1.87, P < 0.05) were lower in the tea polyphenols-intervened group than in the model group.
CONCLUSION: Tea polyphenols can protect hepatocytes from damage, decrease lipid peroxidation and TNF-α release.
- Citation: Li F, Guan XQ, Liu L. Effect of tea polyphenols on TNF-α and hepatocytes in rats with alcoholic liver disease. Shijie Huaren Xiaohua Zazhi 2008; 16(4): 356-360
- URL: https://www.wjgnet.com/1009-3079/full/v16/i4/356.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i4.356
酒精性肝病(ALD)是由于长期大量饮酒所致的肝脏疾病. 临床上分轻症酒精性肝病、酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化、酒精性肝硬化. 由于其机制复杂, 涉及乙醇的直接毒性、乙醛的化学性损伤、氧应激和脂质过氧化、线粒体损伤、遗传等多个方面. 近年来ALD的治疗进展缓慢, 对ALD早期疾病的预防显得尤为重要.
茶多酚(TP)是茶叶的主要活性成分, 其主要成分儿茶素占茶多酚总量的60%-80%, TP经消化道吸收后进入全身各组织, 体内广泛分布[1], 抗氧化是其的主要作用. 本研究在建立大鼠ALD模型的基础上, 利用茶多酚能直接溶于乙醇的物理特性, 建模的同时给与茶多酚干预, 观察茶多酚对肝细胞病变及其对血清、肝组织中TNF-α的影响, 探讨茶多酚用于酒精性肝病早期预防和治疗的可能性.
清洁级成年♀Wistar大鼠29只, 体质量200±50 g, 购自重庆医科大学实验动物中心. 实验期间饲养于重庆医科大学动物中心IVC饲养间. 实验仪器: Thermo Hybaid PCR仪为英国产品, Bio-Rad凝胶成像系统为美国产品, Bio-Tec 酶标仪为美国产品, 透射电镜(Hitachi-7500)为日本产品. 试剂有55度红星二锅头白酒: 北京红星二锅头酒厂生产, 苏丹Ⅳ特染试剂盒购自福州迈新生物技术有限公司, 丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所, TNF-α兔抗鼠多克隆抗体及免疫组化SABC试剂盒购自武汉博士德生物工程有限公司, ELISA定量检测细胞因子TNF-α试剂购自深圳晶美生物工程有限公司, RT-PCR引物、TaKaRa RNA PCR Kit(AMV)Ver.3.0试剂盒、DNA marker购自宝生物工程(大连)有限公司, 茶多酚TP98购自无锡世纪生物药业公司(茶多酚≥98%, 其中儿茶素≥85%).
1.2.1 动物实验: Wistar大鼠29只, 随机分为三组, 对照组5只, ALD模型组11只, 茶多酚干预组13只. 灌胃溶液: (1)ALD模型组: 55度白酒+玉米油. (2)茶多酚干预组: 55度白酒+玉米油+茶多酚. (3)对照组: 玉米油. 每日上午九点ig 1次. 其中: 55%白酒以8-15 mL/(kg·d)剂量, 每周递增. TP: 0.25 g/(kg·d), 玉米油: 2 mL/(kg·d). 实验结束得到大鼠: 对照组5只, 模型组9只、干预组9只. 7 wk末处死大鼠, 下腔静脉穿刺抽血5-6 mL, 分离血清. 取相同部位肝组织40 g/L甲醛固定, 石蜡包埋切片及冰冻切片做脂肪特殊染色, 光镜观察. 取1 mm3肝组织, 固定于4 ℃预冷的20 g/L戊二醛中, 备电镜检测. 另取50-100 mg大小的肝组织若干, 分别用1 mL/L DEPC水处理过的锡箔纸包裹后存放于液氮中, 备RT-PCR检测. 其余肝脏组织保存在-80 ℃冰箱.
1.2.2 光镜观察: 各组动物肝组织病理切片经HE染色, 冰冻切片苏丹Ⅳ染色确认细胞内脂滴储积情况. 依照2006年修订的酒精性肝病诊疗指南[2]标准进行组织评分, 评分主要内容包括: 肝细胞脂变及坏死、肝小叶炎症细胞浸润、纤维化程度.
1.2.3 电镜观察肝细胞超微结构: 按常规透射电镜样品制备方法固定、脱水、浸透、包埋, 光镜半薄切片定位后行超薄切片. 枸橼酸铅电子染色后, 在透射电镜(Hitachi-7500)下观察超微结构.
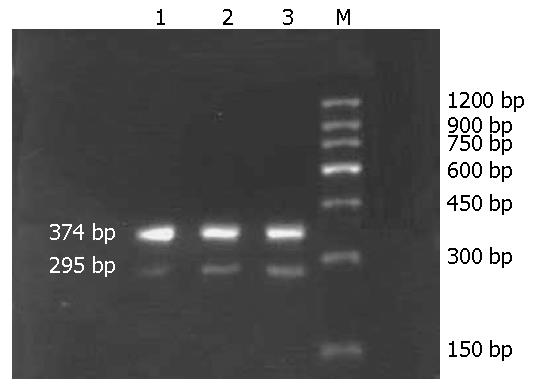
1.2.4 血清和肝组织指标检测: 用全自动生化仪测定大鼠血清ALT、AST水平, 血清MDA检测严格按照说明书进行, ELISA法检测血清TNF-α, 严格按照说明书进行. 肝组织TNF-α mRNA表达检测采用半定量RT-PCR法. 内参: β-actin. 应用TRIzol试剂提取总RNA, 参照RT-PCR试剂盒说明逆转录成cDNA, 10 μL体系. PCR扩增: 50 μL体系: 5×PCR Buffer 10 μL, 灭菌蒸馏水28.75 μL, TaKaRa Taq HS 0.25 μL, TNF-α上下游引物各0.5 μL, 逆转录产物10 μL. 反应条件: (94 ℃ 3 min)1 cycle; (94 ℃ 30 s, 62 ℃ 30 s, 72 ℃ 30 s)40 cycles; (72 ℃ 5 min) 1 cycle, TNF-α上游引物: 5'-TACTGAACTTCGGGGTGATTGGTCC, 下游引物: 3'-CAGCCTTGTCCCTTGAAGAGAACC, 扩增产物295 bp, β-actin: 反应体系同TNF-α, 反应条件: (94 ℃ 3 min)1 cycle; (94 ℃ 30 s, 62 ℃ 30 s, 72 ℃ 30 s)30 cycles; (72 ℃ 5 min)1 cycle, β-actin上游引物: 5'-AGAGCTATGAGCTGCCTGAC-3', 下游引物: 5'-GTACTCCTGCTTGCTGATCC-3', 扩增产物374 bp, PCR产物经琼脂糖凝胶电泳后用Bio-Rad Gel Doc2000型凝胶电泳成像系统照相后并用Quantity One软件计算基因相对表达值. 被检测的目的基因相对表达值 = 目的基因条带灰度值/β-actin基因条带灰度值.
1.2.5 免疫组化检测: SABC法检测肝组织中的TNF-α蛋白表达. 石蜡切片脱蜡至水. 30 mL/L H2O2灭活内源性过氧化物酶. 封闭非特异性抗原. 加1:400稀释的TNF-α一抗. 4 ℃过夜. 二抗、三抗工作液37 ℃孵育各20 min. DAB显色, 苏木素复染, 封片, 以磷酸盐缓冲液代替一抗作阴性对照. 结果判断: 北航CM-2000B型生物医学图像分析系统, 每张切片随机选取10个高倍视野, 取面密度, 以平均值结果统计分析.
统计学处理 结果以mean±SD表示. 各组均数先进行方差齐性检验, 计量资料单因素方差分析. 等级资料采用χ2检验. 多组样本均数之间两两比较采用SNK检验. P<0.05有统计学差异.
对照组被毛光滑, 活泼, 体质量增加, 大便正常. 灌白酒的大鼠精神萎靡、行动迟缓, 皮毛黄、无光泽, 有激惹征象, 部分大鼠大便稀软.
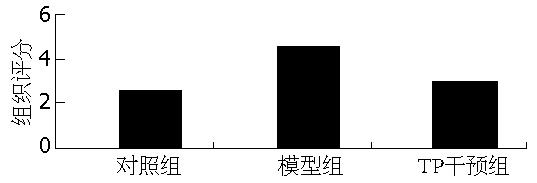
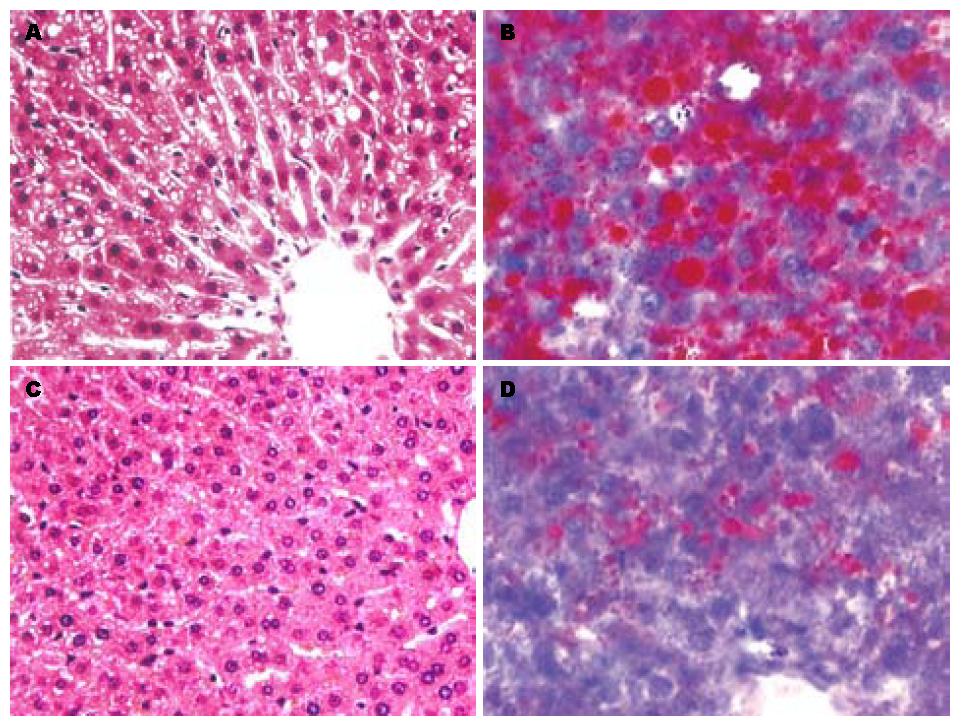
石蜡切片评分: 对照组: 2.60±1.40. 模型组: 4.50±1.31. TP干预组: 3.00±1.59(图1), 模型组与TP干预组有显著性差异. 对照组大鼠肝组织肉眼及光镜下改变不明显, 其他二组肝脏体积稍增大, 边缘变钝, 色泽晦暗, 切面油腻感. 模型组大鼠肝细胞胞质疏松化, 部分细胞气球样变, 胞质内见大小不等的空泡, 苏丹Ⅳ染色证实空泡变性的肝细胞内含大小不等、被染成猩红色的脂质. 偶见Mallory小体, 小叶内少量点状坏死, 汇管区及小叶内少量淋巴细胞、嗜中性粒细胞浸润, 但纤维增生不明显. 茶多酚组上述改变明显轻于模型组, 未见纤维增生(图2).
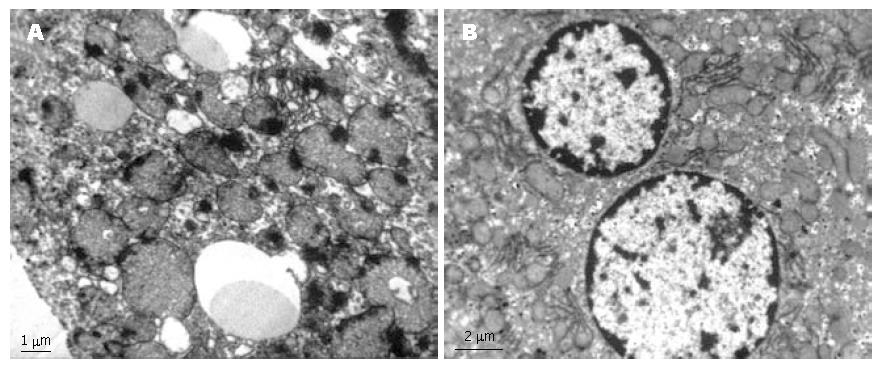
模型组大鼠肝细胞内易见脂滴, 线粒体肿胀, 并能见到环状线粒体、内质网扩张, 而茶多酚干预组肝细胞超微结构基本正常(图3).
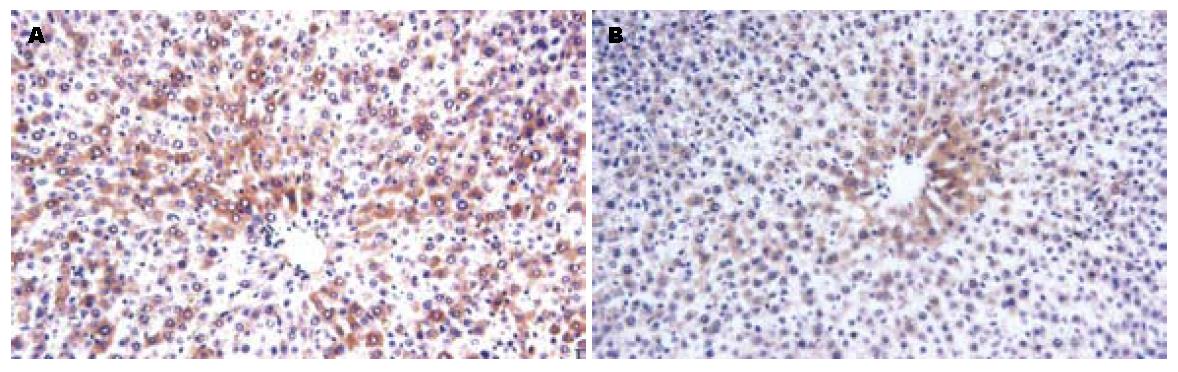
肝组织TNF-α mRNA RT-PCR琼脂糖凝胶电泳图见图4; 肝组织TNF-α蛋白表达, 免疫组化结果见表1. 免疫组化结果显示: 模型组肝组织TNF-α阳性细胞数明显多于茶多酚组, 表达强度(面密度)明显高于茶多酚组(P<0.05). 阳性细胞在肝小叶内弥漫分布, 小叶中央静脉周围细胞数相对较多. 枯否细胞有表达(图5). 各组血清ALT、AST、MDA含量比较见表2, 表3.
| 分组 | 肝组织mRNA | 血清含量(ng/L) | 免疫组化 |
| 对照 | 0.43±0.09 | 3.77±1.02 | 0.03±0.02 |
| 模型 | 0.73±0.07 | 14.33±1.87 | 0.39±0.19 |
| 茶多酚 | 0.55±0.05 | 4.45±0.83 | 0.09±0.07 |
| 处理 | 比值>2 | 比值<2 | 合计 |
| 酒精 | 7 | 2 | 9 |
| 茶多酚组 | 1 | 8 | 9 |
| 合计 | 8 | 10 | 18 |
乙醇进入细胞内, 除了经线粒体氧化代谢, 还可以活化细胞色素P4502E1, 产生大量ROS. 当ROS的量超出机体抗氧化系统的清除能力时, 发生氧应激, 氧应激达到一定强度, ROS氧化细胞膜上不饱和脂肪酸, 导致脂质过氧化, 损伤膜结构. 线粒体是细胞内重要的膜性细胞器, 线粒体膜结构的异常与细胞功能损伤相关联. 肝细胞中AST大约有80%存在于线粒体中. 而ALT主要位于肝细胞的细胞质中, 临床上对酒精性肝病患者血清检测结果呈现AST/ALT>2的特点, 也提示ALD中肝细胞的超微损伤主要在线粒体. 我们的实验结果显示: 茶多酚组血清AST明显低于模型组, 同时组内动物血清AST/ALT>2的比例小于模型组. 超微结构显示虽然实验动物给与高浓度的白酒7 wk, 但线粒体的结构未见明显异常, 说明同时给予的茶多酚对线粒体有保护作用. 病理切片及特染结果提示该组大鼠肝细胞脂变程度、肝小叶内炎症情况也轻于模型组, 同时血清中脂质过氧化产物丙二醛的含量也低于模型组. 提示茶多酚可减轻ALD病程中的脂质过氧化损伤.
茶多酚抗氧化作用与结构有关, 他的几种主要成分物质中都含多个羟基, 其B环上的邻二羟基 (3', 4'_OH), A环上5和7位上的二个羟基, 以及C环上的3位上的羟基, 提供氢与活性氧的孤电子结合. 儿茶素结构上的3', 4邻二羟基可将游离金属离子螯合, 减少金属离子活化而产生的活性氧离子[3]. 另外, 茶多酚还可以保护抗氧化酶, 提高抗氧化酶的活性[4], 减少酒精代谢造成的抗氧化剂的过度消耗, 提高细胞抗脂质过氧化能力.
我们的实验还发现: 茶多酚对肝细胞的保护作用不仅直观地体现在形态学上, 还影响ALD病程中的炎症介质. TNF-α是ALD病程中多效能的前炎症因子, 处于肝细胞损伤的细胞因子网络的核心, 当机体处于应激损伤、急慢性感染情况下, 机体的多种细胞可以合成分泌. 他介导肝细胞的炎症反应, 免疫反应及肝细胞的凋亡和扩增, 肝纤维化等多种病理生理活动[5]. 应用TNF-α抑制剂降低TNF-α水平可减轻酒精性肝损伤[6-7]. 由于血清中TNF-α的量并不能完全说明TNF-α对肝细胞的作用, 近年来人们越来越关心其在不同组织中的表达和变化.
本研究应用RT-PCR、免疫组化、ELISA法分别检测了肝组织及血清中TNF-α的含量, 从mRNA与蛋白水平证明了茶多酚可以减少ALD病程中TNF-α的合成和释放. 这与张宇、周晓蓉et al的研究结果相近[8-9]. 同时发现这三种方法检测出的TNF-α的变化方向一致. 相对于肝组织中的TNF-α的量的变化, 血清中TNF-α变化更加敏感. 分析的茶多酚使TNF-α减少的原因: (1)茶多酚的抗氧化作用直接减少活性氧, 减少ROS引起的转录因子NF-κB活化, 减少受NF-κB转录调节TNF-α的基因表达. (2)ALD肠源性内毒素血症也是TNF-α增多的原因[10-11]. 过量酒精摄入, 不仅会改变肠黏膜的通透性, 而且会增加肠道内细菌的移位, 影响枯否细胞, 导致来源于枯否细胞NADPH氧化酶的超氧阴离子以及其他种类的活性氧增多, 而茶多酚本身还有抑菌杀菌调节免疫的功能, 抑制肠道细菌的过度生长, 降低ALD大鼠血清中内毒素含量. 减轻LPS对枯否细胞的刺激, 减少他所产生的氧自由基. 茶多酚可以通过阻断内毒素诱导的枯否细胞NF-κB的活化而减少TNF-α的量[12-13].
茶多酚作为一种安全高效的抗氧化剂, 大量存在于茶叶特别是绿茶中, 而现在抗TNF-α治疗在酒精性肝病的治疗越来越引起人们的重视, 我们的研究结果提示: 茶多酚对ALD病程中TNF-α和肝细胞病变有影响, 这为茶多酚预防性的应用ALD发病的早期阶段或者将他用作抗炎治疗的辅助剂, 减轻肝脏的病损程度提供一定的理论依据.
酒精性肝病是长期大量饮酒引起的肝脏疾病, 近年来发病率不断上升. 其病因复杂, 虽然近年来研究颇多, 但在酒精性肝炎、肝硬化的的临床治疗上进展缓慢.
朴熙绪, 教授, 延边大学医院消化内科
本研究着眼于肝脏病变的早期干预和预防, 选用与日常生活相关的茶多酚作为干预药物, 源于其较强的抗氧化特性, 本文研究其对于肝细胞结构及功能的影响, 较全面地了解茶多酚对重要作用的细胞因子TNF-α的影响.
本研究结果为将茶多酚应用酒精性肝病发病的早期阶段, 也可将他用作抗炎治疗的辅助剂, 减轻肝脏的病损程度提供了一定的理论依据.
本文设计合理, 方法先进, 逻辑性较强, 具有一定实验价值和理论依据.
编辑: 李东辉 电编: 何基才
| 1. | Suganuma M, Okabe S, Oniyama M, Tada Y, Ito H, Fujiki H. Wide distribution of [3H](-)-epigallocatechin gallate, a cancer preventive tea polyphenol, in mouse tissue. Carcinogenesis. 1998;19:1771-1776. [PubMed] [DOI] |
| 4. | Kaviarasan S, Ramamurthy N, Gunasekaran P, Varalakshmi E, Anuradha CV. Epigallocatechin-3-gallate(-)protects Chang liver cells against ethanol-induced cytotoxicity and apoptosis. Basic Clin Pharmacol Toxicol. 2007;100:151-156. [PubMed] [DOI] |
| 6. | Ponnappa BC, Israel Y, Aini M, Zhou F, Russ R, Cao QN, Hu Y, Rubin R. Inhibition of tumor necrosis factor alpha secretion and prevention of liver injury in ethanol-fed rats by antisense oligonucleotides. Biochem Pharmacol. 2005;69:569-577. [PubMed] [DOI] |
| 7. | Day CP. Treatment of alcoholic liver disease. Liver Transpl. 2007;13:S69-S75. [PubMed] [DOI] |
| 10. | Bode C, Bode JC. Effect of alcohol consumption on the gut. Best Pract Res Clin Gastroenterol. 2003;17:575-592. [PubMed] [DOI] |
| 11. | 韩 德五. 肠源性内毒素血症与肝病: 肝衰竭的IETM学说. 第1版. 北京: 中国科学技术出版社 2004; 78-109. |
| 12. | Yang F, de Villiers WJ, McClain CJ, Varilek GW. Green tea polyphenols block endotoxin-induced tumor necrosis factor-production and lethality in a murine model. J Nutr. 1998;128:2334-2340. [PubMed] |
| 13. | McVicker BL, Tuma DJ, Kharbanda KK, Kubik JL, Casey CA. Effect of chronic ethanol administration on the in vitro production of proinflammatory cytokines by rat Kupffer cells in the presence of apoptotic cells. Alcohol Clin Exp Res. 2007;31:122-129. [PubMed] [DOI] |