修回日期: 2008-11-30
接受日期: 2008-12-01
在线出版日期: 2008-12-28
目的: 系统评价微生态制剂做为溃疡性结肠炎缓解期维持治疗方案的疗效.
方法: 采用计算机检索和手工检索两种方法查阅文献, 采用Cochrane系统评价员手册4.2.2推荐的方法纳入文献, 并对其进行Meta分析.
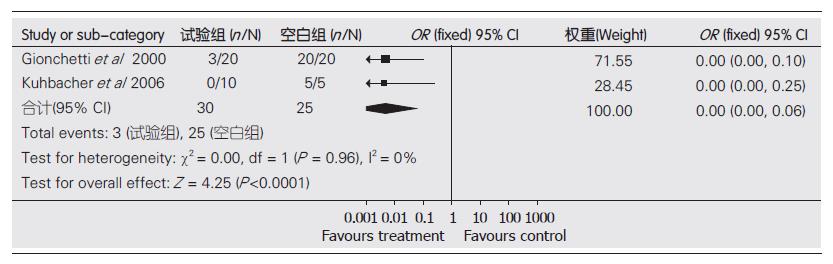
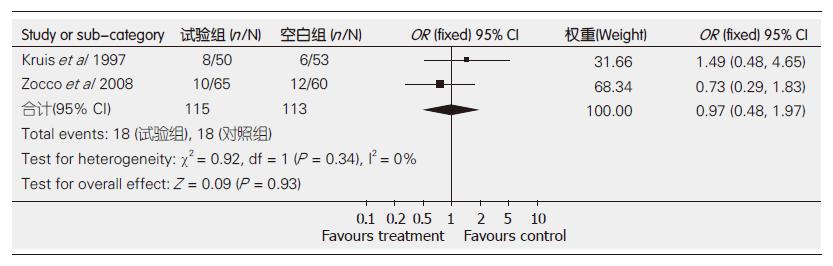
结果: 共纳入4个随机对照试验(randomized controlled trials, RCT), 包括263例患者. Meta分析结果显示: 临床复发率: 微生态制剂治疗优于安慰剂(OR = 0.00, 95%CI: 0.00-0.06, P<0.0001); 与美沙拉嗪无显著性差异(OR = 0.97, 95%CI: 0.48, -1.97, P = 0.93).
结论: 微生态制剂是有效的溃疡性结肠炎缓解期维持治疗方案, 控制疾病复发率与美沙拉嗪相当, 在延长缓解期方面可能优于美沙拉嗪.
引文著录: 麻继臣, 张晓岚. 微生态制剂做为溃疡性结肠炎缓解期维持治疗药物的系统评价. 世界华人消化杂志 2008; 16(36): 4123-4127
Revised: November 30, 2008
Accepted: December 1, 2008
Published online: December 28, 2008
AIM: To evaluate the efficacy of probiotic agents as a maintenance treatment for ulcerative colitis.
METHODS: Computerized and manual search methods were used to retrieve literature, and literature was included in accordance with Cochrane systematic review guideline 4.2.2. Meta analysis was performed to evaluate the data.
RESULTS: Four randomized controlled trials involving 263 patients were included. Meta analysis showed that in terms of clinical relapse rate, probiotic agents were superior to placebo (OR = 0.00, 95%CI: 0.00 to 0.06, P < 0.0001) and that no significant differences were observed between probiotic agents and Mesalazine (OR = 0.97, 95%CI: 0.48 to 1.97, P = 0.93).
CONCLUSION: Probiotic agents could be a treatment of choice in maintaining remission of ulcerative colitis with a better effect than Mesalazine in the long run.
- Citation: Ma JC, Zhang XL. Efficacy of probiotic agents in maintaining remission of ulcerative colitis: a meta analysis. Shijie Huaren Xiaohua Zazhi 2008; 16(36): 4123-4127
- URL: https://www.wjgnet.com/1009-3079/full/v16/i36/4123.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i36.4123
溃疡性结肠炎(ulcerative colitis, UC)是一种较常见的消化道疾病, 近年我国UC的发病呈加快趋势, 最近10年报道的病例数目是过去10年的3.8倍, 而患者构成以慢性反复发作型为主[1]. 在缓解期如不进行干预, UC患者1年内的复发率则可能高达70%[2]. Moum et al[3]和Langholz et al[4]分别观察了接受缓解期维持治疗的846例挪威和1161例丹麦患者, 其1年内复发率下降为50%. 这表明缓解期的维持治疗对控制UC的复发具有重要作用. 目前UC缓解期维持治疗的现状是: (1)国际公认的循证医学刊物《Cochrane Reviews》总结大量随机对照试验(Randomized controlled trial, RCT)得出结论认为所有5-氨基水杨酸(5-aminosalicylic acid, 5-ASA)类药物或柳氮磺吡啶(SASP)均能比安慰剂更有效地维持缓解, 二者作用相当[2]; (2)低剂量、常规糖皮质激素对维持缓解无效[5]; (3)由于严重的副作用, 免疫抑制疗法并不为医生和患者接受. 目前存在的主要问题是: (1)治疗效果差: 即使5-ASA及SASP也仅能将1年内复发率降为50%; (2)患者不能接受长期应用5-ASA类药物的不良反应. 近年关于肠腔内源性微生物在炎症性肠病发病中的地位获得越来越广泛的认同, 利用益生菌调节肠道菌群可能是缓解期维持治疗的一个替代措施, 已经有数篇关于益生菌与炎症性肠病的RCT发表, 非常有限的临床观察和RCT关注到益生菌对缓解期维持治疗的作用. 我们总结了国内外主要医学数据库关于此方面的RCT研究, 并进行了系统分析(Meta-analysis), 希望对应用益生菌进行缓解期维持治疗提供一些依据.
不分语种, 有关微生态制剂治疗溃疡性结肠炎的缓解期维持治疗的随机对照试验(randomized controlled trials, RCT)的文章均予纳入. 纳入/排除标准: (1)纳入标准: 成年、性别不限; 所有既往经内镜及组织学确诊为溃疡性结肠炎, 进入缓解期患者, 临床缓解标准为临床活动指数(clinical activity index, CAI)低于4[6]. (2)排除标准: 结肠炎处于活动期, 感染性结肠炎、应用除试验药物外对结肠炎有影响药物的患者, 严重心、肝、肺疾病、药物过敏、孕期或哺乳者及曾有重大腹部外伤手术史者. 采取的干预措施: 试验组采用微生态制剂治疗, 治疗开始时间、疗程、剂量、给药途径不限; 对照组可采用安慰剂或其他治疗方法. 其疗效评价指标为临床复发率.
1.2.1 检索策略: 计算机检索MEDLINE/PubMed (1978-2008)维普中文科技期刊全文数据库colitis, inflammatory bowel disease, maintenance therapy, ulcerative rectocolitis, ulcerative proctocolitis, Probiotic. 中文检索词包括: 溃疡性结肠炎、炎症性肠病、直肠乙状结肠炎、溃疡性直肠炎、益生菌、益生元、合生元. 手工检索《中华消化杂志》(1978-2008)、《中华内科杂志》(1978-2008)、《世界华人消化杂志》(1978-2008)和《胃肠病学与肝病学杂志》(1978-2008). 查阅所获资料的参考文献索引, 手检相关文献.
1.2.2 资料提取和质量评价: 纳入文献的方法学质量评价采用Cochrane系统评价员手册4.2.2推荐的方法, 文献质量评价内容主要包括: (1)随机分配方法; (2)分配方法的隐藏; (3)盲法; (4)是否描述退出及失访的发生情况.
统计学处理 采用Cochrane协作网提供的RevMan4.2软件. 各临床试验的异质性检验采用χ2检验, 若无异质性, 选择固定效应模型进行Meta分析, 否则选择随机效应模型或进行定性的系统评价. 计数资料计算OR及其95%CI. 将各种处理后Meta分析的结果进行比较, 观察有无统计学差异, 若无统计学差异, 则报道合并的Meta分析结果. 采用漏斗图分析是否存在发表偏倚.
国内文献检索到77篇, 阅读文题及摘要后, 排除综述类文献及信件, 对可能符合纳入标准的文献14篇仔细查阅全文后, 无国内文献进入本系统评价. 国外文献检索到43篇, 其中8篇临床观察, 阅读全文后, 最终仅有4篇进入本系统, 共计263例患者, 其中2篇为与安慰剂的对照[7-8], 2篇为与5-ASA类的美沙拉嗪(Mesalazine)比较[9-10](表1). 所有纳入试验均有明确的诊断、排除标准, 各组基础资料对比无差异.
纳入的4个试验均表明为随机分组, 具体描述了随机序列产生的方法; 4个试验明确指出两组基线情况具有可比性, 对受试者退出失访的情况进行了详细说明. 有2个试验采用了双盲法; 2个试验对随机分配方案进行了充分隐藏.
2.3.1 益生菌组与安慰剂组(对照组)临床复发率的比较: 各试验间无异质性(P = 0.96), 采用固定效应模型进行Meta分析. 结果显示, 治疗组临床复发率为10.00%, 空白剂组为100.00%, 两组间差异有统计学意义(OR = 0.00, 95% CI: 0.00-0.06, P<0.0001, 图1). 表明益生菌的疗效优于安慰剂.
2.3.2 益生菌组与Mesalazine组(对照组)临床复发率的比较: 各试验间无异质性(P = 0.96), 采用固定效应模型进行Meta分析. 结果显示, 治疗组临床复发率为15.65%, Mesalazine组为15.93%, 两组间差异无统计学意义(OR = 0.97, 95% CI: 0.48-1.97, P = 0.93, 图2). 表明益生菌的疗效与Mesalazine相当.
各组试验均提供了不良反应发生的资料, 各试验均具有良好的耐受性, 基础资料无异质性, 未发生逆转事件.
UC的自然病程以反复交替的发作和缓解为特征, 诱导和维持缓解是UC的治疗目标. 但是诱导缓解后, 如无干预措施, 70%的患者会在1年内复发. 但是即使使用标准的5-ASA疗法, 仍有30%-50%的病例在1年内复发. 事实上, 大量RCT证实至少在预防复发方面, 5-ASA的疗效并不优于最古老的SASP. 临床专家们希望能找出一种高效低毒的替代措施, 近年对菌群失调在炎症性肠病发病机制的新认识给了人们希望. 研究表明, 肠腔黏膜表面共生菌可能参与了炎症的调节[11], 大量的动物实验使人们倾向于益生菌减少、致病菌增多触发了肠道的炎症反应, "无菌则无炎症性肠病"[12-16]. 对人类的观察发现, UC患者肠道菌群的构成确实不同于正常人[17], 其肠道微生物总量较正常人群增加, 但"保护性"菌群如乳酸杆菌、双岐杆菌却较正常人群减低.
益生菌发挥作用的机制包括局部对肠腔细菌的直接作用与激活机体保护性免疫反应[18]; 进一步的研究证实, 益生菌可以诱导Th1细胞因子表达, 下调炎症因子刺激上皮细胞分泌黏液素, 维持肠黏膜屏障的完整[19]. 他还可以与致病菌竞争上皮细胞的位点而发挥抗炎作用[20]. 目前益生菌在临床主要用于活动期的辅助治疗. 通过对上述RCT的系统分析表明, 相对于空白对照组, 益生菌和Mesalazine均可显著降低缓解期UC的复发率, 二者无显著性差异. 再次说明UC缓解期应当给予干预, 益生菌和Mesalazine具有统计学上相同的效力, 虽然支持的证据规模有限, 但我们还是能够从中看到益生菌做为维持治疗治疗明显的良好趋势, 对于不适合用5-ASA的患者, 临床医生将多一种选择. 特别值得提出的是, 在所有使用益生菌的病例中未出现不良反应, 相对于Mesalazine, 益生菌具有突出的安全性. 考虑到我国患者相对于欧美患者具有明显的高复发率, 其主要原因是患者对维持治疗顺应性差, 而患者不能坚持用药原因之一是出于对长期使用水杨酸药物副作用的担心, 在这个意义上益生菌就更加值得关注. 我们还注意到, 其中一项研究所进行的生存分析发现在延长缓解期方面益生菌显著优于Mesalazine(P<0.05), 维持缓解是临床医生治疗UC的根本目的.
鉴于上述结果的重要性, 而累积的证据存在不足, 我们希望我们的初步结果能引发临床医生的兴趣, 期望能对此展开一个多个医疗中心合作的随机对照研究, 为益生菌的作用、用法、用量做出更准确的定位.
溃疡性结肠炎(UC)是一种复发性疾病, 突出的临床特征是缓解和复发交替. 由于根本病因不明确, 目前无根治措施. 临床治疗的目的是诱导和维持缓解, 消除症状, 提高患者生活质量. UC在我国近年呈明显高发趋势, 与西方国家相比, 我国UC的突出特征是复发率高. 寻找作用更好, 副作用更小的维持缓解药物是临床亟待解决的问题之一.
江学良, 主任医师, 中国人民解放军济南军区总医院消化科
一些新制剂肿瘤坏死因子单克隆抗体(如英夫利昔)等的临床应用, 给患者带来了新的希望, 但价格昂贵, 使其临床应用收到很大限制, 而且目前无证据表明他优于传统治疗措施, 目前全球范围对溃疡性结肠炎治疗应用最广泛的仍然是5-氨基水杨酸(5-ASA).
通过本研究发现将微生态制剂的应用外延到缓解期, 对一些不能耐受5-ASA患者, 为临床医生提供一种新选择.
微生态制剂: 亦称微生态调节剂, 根据微生态学原理, 利用对宿主有益的正常微生物成员或促进物质制成的制剂, 通过调整微生态失调, 保持微生态平衡, 提高宿主健康水平或增进健康状态, 对消化系统许多疾病都有一定治疗和预防作用, 根据所含成分属性分为益生菌(probiotics)、益生元(prebiotics)、合生元(snybio-tics).
本文采用比较科学的文献比较方法, 对微生态制剂做为溃疡性结肠炎缓解期维持治疗药物的进行系统评价, 结论相对客观, 对临床应用有一定指导意义.
编辑: 史景红 电编: 吴鹏朕
| 1. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] |
| 2. | An oral preparation of mesalamine as long-term maintenance therapy for ulcerative colitis. A randomized, placebo-controlled trial. The Mesalamine Study Group. Ann Intern Med. 1996;124:204-211. [PubMed] |
| 3. | Moum B, Ekbom A, Vatn MH, Aadland E, Sauar J, Lygren I, Schulz T, Stray N, Fausa O. Clinical course during the 1st year after diagnosis in ulcerative colitis and Crohn's disease. Results of a large, prospective population-based study in southeastern Norway, 1990-93. Scand J Gastroenterol. 1997;32:1005-1012. [PubMed] |
| 4. | Langholz E, Munkholm P, Davidsen M, Binder V. Course of ulcerative colitis: analysis of changes in disease activity over years. Gastroenterology. 1994;107:3-11. [PubMed] |
| 5. | Lennard-jones JE, Misiewicz JJ, Connell AM, Baron JH, Jones FA. Prednisone as maintenance treatment for ulcerative colitis in remission. Lancet. 1965;1:188-189. [PubMed] |
| 6. | Rachmilewitz D. Coated mesalazine (5-aminosalicylic acid) versus sulphasalazine in the treatment of active ulcerative colitis: a randomised trial. BMJ. 1989;298:82-86. [PubMed] |
| 7. | Kuhbacher T, Ott SJ, Helwig U, Mimura T, Rizzello F, Kleessen B, Gionchetti P, Blaut M, Campieri M, Folsch UR. Bacterial and fungal microbiota in relation to probiotic therapy (VSL#3) in pouchitis. Gut. 2006;55:833-841. [PubMed] |
| 8. | Gionchetti P, Rizzello F, Venturi A, Brigidi P, Matteuzzi D, Bazzocchi G, Poggioli G, Miglioli M, Campieri M. Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial. Gastroenterology. 2000;119:305-309. [PubMed] |
| 9. | Kruis W, Schutz E, Fric P, Fixa B, Judmaier G, Stolte M. Double-blind comparison of an oral Escherichia coli preparation and mesalazine in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther. 1997;11:853-858. [PubMed] |
| 10. | Zocco MA, dal Verme LZ, Cremonini F, Piscaglia AC, Nista EC, Candelli M, Novi M, Rigante D, Cazzato IA, Ojetti V. Efficacy of Lactobacillus GG in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther. 2006;23:1567-1574. [PubMed] |
| 11. | Sartor RB. The influence of normal microbial flora on the development of chronic mucosal inflammation. Res Immunol. 1997;148:567-576. [PubMed] |
| 12. | Llopis M, Antolin M, Guarner F, Salas A, Malagelada JR. Mucosal colonisation with Lactobacillus casei mitigates barrier injury induced by exposure to trinitronbenzene sulphonic acid. Gut. 2005;54:955-959. [PubMed] |
| 13. | Schultz M, Veltkamp C, Dieleman LA, Grenther WB, Wyrick PB, Tonkonogy SL, Sartor RB. Lactobacillus plantarum 299V in the treatment and prevention of spontaneous colitis in interleukin-10-deficient mice. Inflamm Bowel Dis. 2002;8:71-80. [PubMed] |
| 14. | McCarthy J, O'Mahony L, O'Callaghan L, Sheil B, Vaughan EE, Fitzsimons N, Fitzgibbon J, O'Sullivan GC, Kiely B, Collins JK. Double blind, placebo controlled trial of two probiotic strains in interleukin 10 knockout mice and mechanistic link with cytokine balance. Gut. 2003;52:975-980. [PubMed] |
| 15. | Mao Y, Nobaek S, Kasravi B, Adawi D, Stenram U, Molin G, Jeppsson B. The effects of Lactobacillus strains and oat fiber on methotrexate-induced enterocolitis in rats. Gastroenterology. 1996;111:334-344. [PubMed] |
| 16. | Fabia R, Ar'Rajab A, Johansson ML, Willen R, Andersson R, Molin G, Bengmark S. The effect of exogenous administration of Lactobacillus reuteri R2LC and oat fiber on acetic acid-induced colitis in the rat. Scand J Gastroenterol. 1993;28:155-162. [PubMed] |
| 17. | Cummings JH, Macfarlane GT, Macfarlane S. Intestinal bacteria and ulcerative colitis. Curr Issues Intest Microbiol. 2003;4:9-20. [PubMed] |
| 18. | Reid G, Burton J. Use of Lactobacillus to prevent infection by pathogenic bacteria. Microbes Infect. 2002;4:319-324. [PubMed] |
| 19. | Dotan I, Rachmilewitz D. Probiotics in inflammatory bowel disease: possible mechanisms of action. Curr Opin Gastroenterol. 2005;21:426-430. [PubMed] |
| 20. | Di Caro S, Tao H, Grillo A, Elia C, Gasbarrini G, Sepulveda AR, Gasbarrini A. Effects of Lactobacillus GG on genes expression pattern in small bowel mucosa. Dig Liver Dis. 2005;37:320-329. [PubMed] |