修回日期: 2008-12-01
接受日期: 2008-12-08
在线出版日期: 2008-12-28
目的: 分离、鉴定小鼠骨髓基质干细胞(MSCs)并探讨在体外多种细胞因子的诱导下分化为肝细胞的可行性.
方法: 获取小鼠骨髓干细胞, 进行体外贴壁培养、纯化, 观察不同传代次数细胞形态特点. 流式细胞法检测不同传代细胞的表面标志物CD45和CD90. 分离后的MSCs再经含有HGF, FGF-4, EGF三种细胞因子的诱导体系继续培养21 d, 分别以半定量逆转录聚合酶链反应(RT-PCR)和Western blot方法检测诱导后细胞的白蛋白(ALB)、细胞角化蛋白18(CK18)、以及甲胎蛋白(AFP)在基因和蛋白水平的表达.
结果: 培养的骨髓干细胞随传代次数增多细胞形态趋向为长梭形. 传代到第5代, 基质干细胞的表面标志CD90阳性细胞从原代的25.42%增加到93.47%, 造血干细胞的表面标志CD45表达阳性细胞从原代的86.49%降低到2.77%. 通过RT-PCR可检测出诱导第7天细胞表达AFP mRNA, ALB mRNA及CK18 mRNA; 通过Western blot可检测出诱导第21天的细胞表达ALB和CK18.
结论: 小鼠MSCs可以在体外被有效地分离纯化, 可以被诱导为表达肝细胞表面标志的肝细胞样细胞.
引文著录: 刘焱, 李江利, 施晓雷, 方胜, 仇毓东. 小鼠骨髓基质干细胞的鉴定及体外诱导分化为肝细胞的可行性. 世界华人消化杂志 2008; 16(36): 4051-4055
Revised: December 1, 2008
Accepted: December 8, 2008
Published online: December 28, 2008
AIM: To isolate and identify mouse marrow stromal stem cells (MSCs), then to explore whether MSCs cultured in the directed differentiation media including HGF, EGF and FGF-4 could differentiate into hepatocytes.
METHODS: Bone marrow cells were collected from C57BL/6 mouse by density gradient centrifugalization, and were purified by adherent culture. Cell morphology was observed, and cell surface markers were identified by flow cytometry. MSCs were cultured in the directed differentiation media including HGF, EGF and FGF-4, and the expression patterns of some genes of the hepatocytes, AFP, ALB and CK18 were validated and confirmed by RT-PCR. The ALB and CK18 expressed cells were confirmed by Western blot.
RESULTS: Cell morphology tended to be uniform fusiform shape with passage. The percentage of hematopoietic lineage marker CD45 decreased from 86.49% to 2.77% while the percentage of CD90 increased obviously from 25.42% in primary culture cells to 93.47% at the fifth generation. AFP mRNA expression appeared on culture day 7 and decreased in the later days; ALB and CK18 mRNA expression also appeared on culture day 7, but increased with the differentiation of MSCs. ALB and CK18 were confirmed to express in the differentiated MSCs by Western blot analysis.
CONCLUSION: MSCs can be isolated and purified in vitro, then induced to differentiate into hepatocytes or hepatocyte-like cells by directed differentiation media including HGF, EGF and FGF-4.
- Citation: Liu Y, Li JL, Shi XL, Fang S, Qiu YD. Identification and differentiation into hepatocyte-like cells of mouse marrow stromal stem cells in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(36): 4051-4055
- URL: https://www.wjgnet.com/1009-3079/full/v16/i36/4051.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i36.4051
大量的实验研究表明, 骨髓中存在着多种类型成体干细胞, 可以在特定的条件下分化为不同功能的细胞[1-3]. 但是, 对于其中重要成分之一的骨髓基质干细胞(marrow stromal stem cells, MSCs)能否在体外诱导分化为肝细胞, 目前研究尚少. 本实验旨在通过骨髓干细胞体外培养、分离、纯化, 获得小鼠MSCs并进行鉴定. 同时研究小鼠MSCs在体外诱导分化为肝细胞的可能性.
SPF级C57BL/6小鼠, ♂, 3-4周龄, 体质量10-12 g, 由南京大学模式动物中心提供. MEM-LG, FBS, L-谷氨酰胺(Hyclone公司); MCDB-201、ITS、纤维连接蛋白、胰蛋白酶(Sigma公司); 重组小鼠肝细胞生长因子(rmHGF)、重组小鼠碱性成纤维样细胞生长因子4(rmFGF-4)、重组小鼠表皮生长因子(rmEGF)购于RD公司. CD90-FITC, CD-45PE(Caltag公司); 抗小鼠白蛋白抗体(Dako公司); 抗小鼠CK18抗体(Pharmingen公司); AFP mAb(Sigma公司); TRIzol RNA抽提试剂(Sigma公司); RT-PCR两步法试剂盒(BD Biosciences公司).
SPF级3-4周龄♂C57BL/6小鼠行乙醚麻醉后, 无菌条件下取出股骨和胫骨, 剪去骨两端, 用含500 U/mL肝素的L-DMEM培养液从骨髓腔冲出骨髓, 制成单细胞悬液; 细胞悬液用密度为1.077淋巴细胞分离液分离, 收集两液中间的"白膜层"; 培养液重悬两次后计数细胞, 按2×105/cm2的密度接种在25 mL的培养瓶中. 培养液为基础培养液: 540 mL/L L-DMEM, 360 mL/L MCDB201, 100 mL/L FCS, 1×ITS, 10-8 mol/L地塞米松, 10-1抗坏血酸, 100 U/mL青霉素, 100 mg/L链霉素, 2 mmol/L L-谷氨酰胺. 37 ℃, 50 mL/L CO2培养. 以细胞生长情况1-2 d换液1次, 去除非贴壁细胞; 细胞生长到80%融合时, 用20 ℃ 2.5 g/L的胰酶消化后, 按1:3比例进行传代. 将传第5代的MSCs细胞用2.5 g/L的胰酶消化, DMEM-LG重悬后, 按2×105/cm2的密度接种在25 mL的培养瓶中. 培养液为含有三种细胞因子的条件培养基, 成分为: 基础培养液内添加细胞因子: HGF 40 μg/L, FGF-4 20 μg/L, EGF 10 μg/L. 37 ℃, 50 mL/L CO2培养箱培养, 根据细胞生长情况1-2 d换液1次.
1.2.1 MSCs形态观察: 原代及不同传代细胞及诱导后细胞, 在倒置相差显微镜下观察细胞的形态变化.
1.2.2 MSCs表面标志物检测: 取不同传代次数的细胞用于流式细胞分析. 细胞先后与一抗和荧光标记的二抗结合, 20 g/L多聚甲醛固定后, 进行检测. 一抗包括抗小鼠细胞膜CD90(动物干细胞表面标志)抗体和CD45(造血细胞表面标志)抗体. 二抗均与FITC-连接, 实验方法参照试剂说明书.
1.2.3 RT-PCR检测目标基因: 取C57BL/6小鼠肝细胞, 传第5代的MSCs及诱导第0, 7, 14, 21天的细胞, 采用TRIzol法抽提收集细胞总RNA, 逆转录为cDNA后, 取1 µg cDNA采用PCR法扩增目标基因ALB, CK18, AFP及内参β-actin的相应片段. 反应条件如下: 94 ℃ 5 min后, 40个循环, 94 ℃变性30 s, 60 ℃退火1 min, 72 ℃延伸1 min, 再延伸5 min. 相应引物为上海生物公司合成: AFP(196 bp): 5'-GTGAAACAGACTTCCTGGTCCT-3', 5'-GCCCTACAGACCATGAAACAAG-3'; CK-18(142 bp): 5'-TGGTACTCTCCTCAATCTGCTG-3', 5'-CTCTGGATTGACTGTGGAAGTG-3'; ALB(167 bp): 5'-TCAACTGTCAGAGCAGAGAAGC-3', 5'-AGACTGCCTTGTGTGGAAGACT-3'; β-actin(569 bp): 5'-CCAAGGCCAACCGCGAGAAGATGAC-3', 5'-AGGGTACATGGTGGTGCCGCCAGAC-3'. 扩增产物在含有5 g/L溴化乙锭的17 g/L琼脂糖凝胶上电泳, 电泳结果应用紫外成像分析对各条带进行成像.
1.2.4 Western blot检测: 取C57BL/6小鼠肝细胞, 第5代的MSCs及诱导第21天的细胞; PBS中充分洗涤后, 用细胞裂解液充分裂解; 离心后加入等体积2×SDS上样缓冲液于蛋白裂解上清液中, 100 ℃中煮沸5 min后进行聚丙烯酰胺电泳; 利用半干转移电泳将蛋白转移至PVDF膜上; 室温用TBS稀释的30 g/L脱脂牛奶(含0.5 mL/L Tween-20)封闭膜30 min后, 加入一抗; 振摇1 h, TBS-Tween 20洗膜2次, 再加入山羊抗兔、山羊抗鼠HRP抗体稀释液室温振摇1 h; 将膜浸入DAB显色液中, 室温显色2-3 min, PBS洗涤后观察.
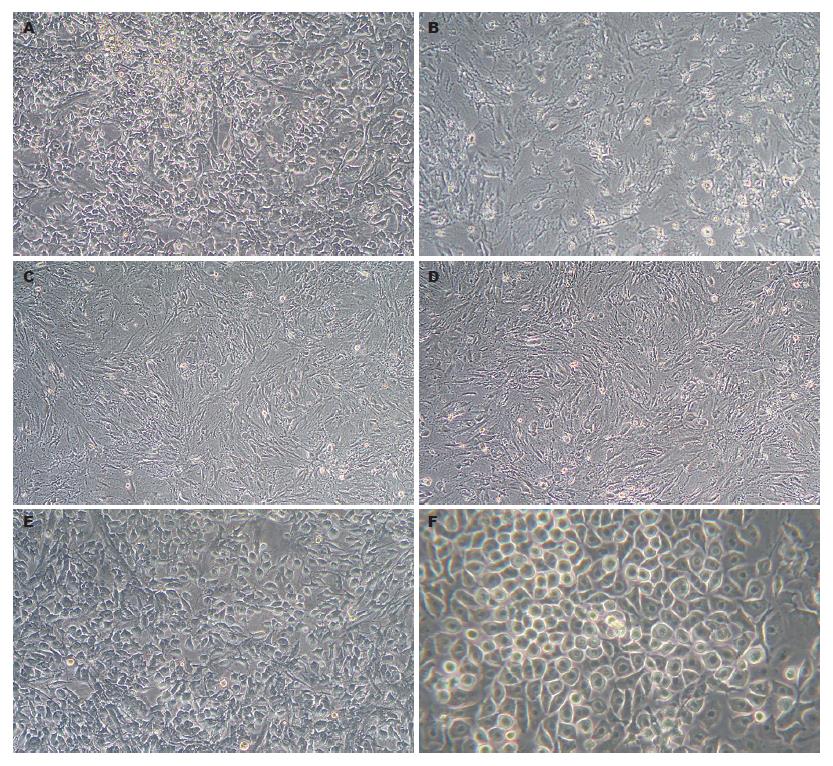
当细胞接种密度为2×105/cm2, 24 h后去除非黏附的细胞后, 发现贴壁细胞密度适中, 细胞生长良好. 传代培养后可见细胞单层贴壁生长, 成梭形, 椭圆形, 不规则形等, 遮光性强(图1A). 随着传代次数增多, 细胞形态趋向为均一的长梭形(图1B-D). 诱导第21天, 镜下可见大多数细胞成类似于肝细胞的多极样形态(图1E-F). 而在缺少细胞因子HGF, FGF-4, EGF的培养细胞中并没有发现此类细胞.
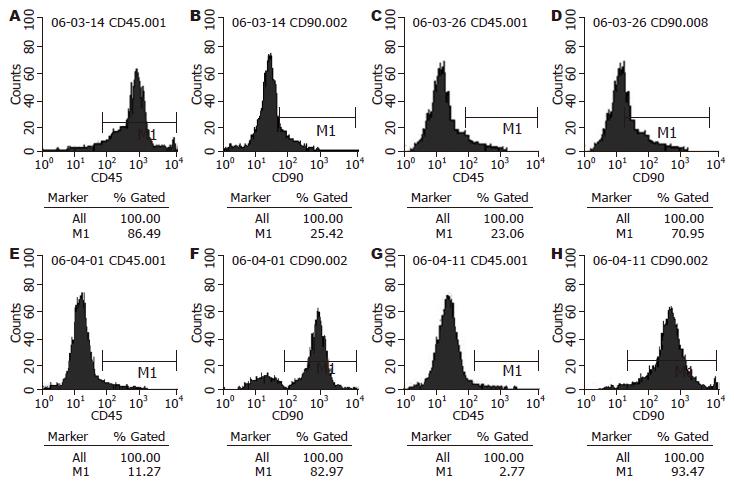
原代和第5代细胞中CD90+细胞的表达分别为25.42%, 93.47%, CD45+的表达分别为86.49%, 2.77%. 培养的MSCs传到第5代纯度已达93%以上(图2).
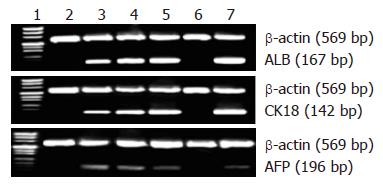
诱导的第5代细胞第7天出现AFP基因表达, 第14天表达增强, 第21天表达减弱; 第14天开始表达白蛋白基因, 第21天表达增强; 第14天开始表达CK18基因, 第21天表达增强(图3).
未诱导的第5代MSCs无ALB, CK18蛋白的表达. 诱导21 d后的细胞表达ALB, CK18蛋白(图4).
我国是肝病大国, 统计结果显示超过1.3亿人口感染过乙型肝炎病毒. 乙型肝炎中, 1%-3%会发展成为急性或亚急性重型肝炎. 重型肝炎及其他原因所导致的肝功能衰竭病死率极高, 一般治疗不能有效的改善患者预后. 虽然肝移植是治疗肝功能衰竭的最有效手段, 但由于供肝的缺乏, 许多患者因无法及时得到供肝中而死亡. 近年来大量研究证实, 生物人工肝(bioartificial liver, BAL)和肝细胞移植可有效改善肝功能衰竭患者的病情并过渡到肝移植, 对提高患者的生存率有很大的帮助. 在生物人工肝的构建中, 人源化的肝细胞是最理想的生物反应细胞, 但其同样存在来源受限的问题. 近年来, 骨髓干细胞诱导分化为肝细胞的研究成为细胞生物学领域的热点[4-7]. 实验研究表明, MSCs作为骨髓中一种具有多向分化潜能的成体干细胞[8-9], 经过培养和诱导, 可分化为具有肝细胞功能的细胞, 为BAL和细胞移植提供新的细胞来源. 采用自体骨髓干细胞, 还可避免异基因或异种细胞所致的免疫问题, 是组织工程的理想种子细胞.
目前用于初筛分离MSCs的方法主要有: 密度梯度离心法, 贴壁筛选法, 流式细胞仪分选法, 免疫磁珠分选法等. 本实验中我们先采用密度梯度离心, 获取目的细胞. 再利用MSCs具有贴壁生长的特性, 去除非贴壁生长的杂质细胞, 再经反复传代得到较高纯度的MSCs. 目前, MSCs的鉴定主要是采用细胞形态观察结合分化表型检测的方法. MSCs表达CD90, CD71及CD44, 而缺乏CD34, CD45和CD11b等造血干细胞表面标志[1,10]. 本实验中, 随着传代次数的增加, 细胞形态趋向均一的长梭形, 类似于成纤维样细胞, 异形细胞明显减少. 原代细胞中CD90+细胞25.42%, CD45-细胞86.49%; 培养到第3代时CD90+细胞达93.47%, CD45-细胞仅有2.77%. 结果表明, 通过密度梯度离心及贴壁培养可以在体外有效的纯化MSCs.
目前有关MSCs诱导为肝细胞的方法有较多报道, 本实验室曾报道骨髓单个核细胞在细胞因子诱导下可分化为有功能的肝细胞样细胞[11]. 骨髓干细胞分化成肝细胞受多种生长因子或细胞因子的调控, 其中确切机制还不太清楚. 有关研究发现, 肝细胞生长因子(HGF)作为一种多能细胞因子, 通过与其受体c-MET结合, 能促进多种细胞的有丝分裂, 在肝脏的成熟过程中发挥重要作用[12-13]; 心源性中胚层表达的一系列成纤维细胞生长因子(FGF-4), 可于肝脏发生的起始阶段发挥作用, 参与内胚层向肝脏的转化[14]; 表皮生长因子(EGF)在肝脏发育及再生过程中也有重要功能要作用[15]. 本实验中, 我们在培养液中加入细胞因子HGF, FGF-4和EGF来建立诱导体系, 通过预试验确定了各因子的浓度. 培养体系中加入的小剂量地塞米松及ITS, 有刺激肝细胞DNA合成及促使肝细胞增殖和存活的作用[16]. 实验结果证实, 我们的诱导体系简单、有效, 可重复性好, 有利于规模应用. 肝细胞的特异性标志物有甲胎蛋白(AFP)、白蛋白(ALB)、细胞角蛋白(CK18)等[17-18], AFP是胚胎肝细胞的肝标记, 在成熟肝细胞中表达下调. CK18是成熟肝细胞的特异性表面抗原. 白蛋白始于胚肝发育, 肝细胞成熟时表达量达到高峰. 我们将纯度较高的第5代细胞诱导培养21 d后, 不仅从形态上可以观察到肝细胞样细胞的产生和变化, 而且从基因和蛋白水平都检测到AFP、ALB、及CK-18的表达. 从而初步证实了我们在体外诱导的小鼠MSCs可以分化为肝细胞.
本实验中我们将小鼠骨髓细胞通过密度梯度离心及贴壁培养后, 获的具有较高纯度MSCs, 建立了以细胞因子HGF、FGF-4、EGF为主要诱导因子的诱导体系, 有效的将MSCs诱导分化成为肝样细胞. 但肝样细胞代谢、合成功能如何, 在生物人工肝和肝细胞移植中能否有效发挥功能, 尚需进一步实验证实.
生物人工肝(BAL)和肝细胞移植可有效改善肝功能衰竭患者的病情并过渡到肝移植, 对提高患者的生存率有很大的帮助. 在生物人工肝的构建中, 人源化的肝细胞是最理想的生物反应细胞, 但其同样存在来源受限的问题.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
近年来, 骨髓干细胞诱导分化为肝细胞的研究成为细胞生物学领域的热点.
目前有关MSCs诱导为肝细胞的方法有较多报道, 本实验室曾报道骨髓单个核细胞在细胞因子诱导下可分化为有功能的肝细胞样细胞.
本文针对小鼠骨髓基质干细胞的鉴定及体外诱导为肝细胞进行研究, 具有一定新意和参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284:143-147. [PubMed] [DOI] |
| 2. | Friedenstein AJ, Chailakhyan RK, Gerasimov UV. Bone marrow osteogenic stem cells: in vitro cultivation and transplantation in diffusion chambers. Cell Tissue Kinet. 1987;20:263-272. [PubMed] |
| 3. | Deng W, Obrocka M, Fischer I, Prockop DJ. In vitro differentiation of human marrow stromal cells into early progenitors of neural cells by conditions that increase intracellular cyclic AMP. Biochem Biophys Res Commun. 2001;282:148-152. [PubMed] [DOI] |
| 4. | Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, Henegariu O, Krause DS. Liver from bone marrow in humans. Hepatology. 2000;32:11-16. [PubMed] [DOI] |
| 5. | Lagasse E, Connors H, Al-Dhalimy M, Reitsma M, Dohse M, Osborne L, Wang X, Finegold M, Weissman IL, Grompe M. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med. 2000;6:1229-1234. [PubMed] [DOI] |
| 6. | Libbrecht L, Desmet V, Van Damme B, Roskams T. Deep intralobular extension of human hepatic 'progenitor cells' correlates with parenchymal inflammation in chronic viral hepatitis: can 'progenitor cells' migrate? J Pathol. 2000;192:373-378. [PubMed] [DOI] |
| 7. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 8. | Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science. 1997;276:71-74. [PubMed] [DOI] |
| 9. | Wang PP, Wang JH, Yan ZP, Hu MY, Lau GK, Fan ST, Luk JM. Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction. Biochem Biophys Res Commun. 2004;320:712-716. [PubMed] [DOI] |
| 10. | Conget PA, Minguell JJ. Phenotypical and functional properties of human bone marrow mesenchymal progenitor cells. J Cell Physiol. 1999;181:67-73. [PubMed] [DOI] |
| 11. | Shi XL, Qiu YD, Wu XY, Xie T, Zhu ZH, Chen LL, Li L, Ding YT. In vitro differentiation of mouse bone marrow mononuclear cells into hepatocyte-like cells. Hepatol Res. 2005;31:223-231. [PubMed] [DOI] |
| 12. | Somerset DA, Afford SC, Strain AJ, Kilby MD. Fetal growth restriction and hepatocyte growth factor. Arch Dis Child Fetal Neonatal Ed. 1997;77:F244-F248. [PubMed] |
| 13. | Kamiya A, Kinoshita T, Miyajima A. Oncostatin M and hepatocyte growth factor induce hepatic maturation via distinct signaling pathways. FEBS Lett. 2001;492:90-94. [PubMed] [DOI] |
| 14. | Wells JM, Melton DA. Vertebrate endoderm development. Annu Rev Cell Dev Biol. 1999;15:393-410. [PubMed] [DOI] |
| 16. | Block GD, Locker J, Bowen WC, Petersen BE, Katyal S, Strom SC, Riley T, Howard TA, Michalopoulos GK. Population expansion, clonal growth, and specific differentiation patterns in primary cultures of hepatocytes induced by HGF/SF, EGF and TGF alpha in a chemically defined (HGM) medium. J Cell Biol. 1996;132:1133-1149. [PubMed] [DOI] |
| 17. | Fiegel HC, Kluth J, Lioznov MV, Holzhüter S, Fehse B, Zander AR, Kluth D. Hepatic lineages isolated from developing rat liver show different ways of maturation. Biochem Biophys Res Commun. 2003;305:46-53. [PubMed] [DOI] |
| 18. | Fiegel HC, Lioznov MV, Cortes-Dericks L, Lange C, Kluth D, Fehse B, Zander AR. Liver-specific gene expression in cultured human hematopoietic stem cells. Stem Cells. 2003;21:98-104. [PubMed] [DOI] |