修回日期: 2008-11-24
接受日期: 2008-12-01
在线出版日期: 2008-12-28
目的: 探讨选择性环氧合酶-2(cyclooxy-genase-2, COX-2)抑制剂Nimesulide联合奥沙利铂(Oxaliplatin, L-OHP)对人肝癌细胞株SMMC-7721增殖与凋亡的影响, 为肝癌的药物治疗提供依据.
方法: 预实验筛选Nimesulide有效终浓度与不同浓度L-OHP(0.5、1.0、2.0、5.0 mg/L)联合处理肝癌细胞48 h; 另外选取L-OHP有效终浓度与Nimesulide筛选的浓度单独或联合处理肝癌细胞24 h、48 h、72 h; 采用倒置显微镜观察细胞形态学改变, 四氮唑盐比色法(MTT法)观察细胞增殖活力的改变, 流式细胞仪检测细胞凋亡率.
结果: 不同浓度Nimesulide及L-OHP对SMMC-7721表现出一定程度的生长抑制作用, 并呈剂量依赖性. Nimesulide(50 mmol/L)或L-OHP(1 mg/L)单用时可显著抑制SMMC-7721细胞的增殖, 选用Nimesulide 50 mmol/L与L-OHP(0.5、1.0、2.0、5.0 mg/L)联合使用时, 联合抑制作用呈现协同作用(Q>1.15). L-OHP 1 mg/L、Nimesulide 50 mmol/L及两药联合处理SMMC-7721细胞24 h、48 h、72 h, 各处理组各时间点对肝癌细胞的抑制作用随着时间的延长而增大, 并且两药联合作用有协同作用(Q>1.15). 流式细胞仪检测分析发现两种药物均可有效诱导SMMC-7721细胞的凋亡, 且在上述浓度联合应用时具协同效应.
结论: Nimesulide与L-OHP对人肝癌细胞株SMMC-7721均有抑制增殖和促进凋亡作用, 而且两者联合应用有协同作用.
引文著录: 刘利珍, 简捷, 吴建兵, 黄龙璋, 史芳. Nimesulide联合奥沙利铂对人肝癌细胞增殖与凋亡的影响. 世界华人消化杂志 2008; 16(36): 4041-4045
Revised: November 24, 2008
Accepted: December 1, 2008
Published online: December 28, 2008
AIM: To investigate the effects of cycloxy-genase-2 (COX-2) selective inhibitor Nimesulide combined with Oxaliplatin(L-OHP) on cell proliferation and apoptosis of human liver cancer cell line SMMC-7721.
METHODS: Nimesulide at the effective final concentration determined by pre-screen test, combined with different concentrations of L-OHP (0.5, 1.0, 2.0, 5 mg/L) was used to treat liver cancer cells for 48 hours. L-OHP final concentration and the final concentration of Nimesulide alone or jointly were used to treat liver cancer cells 24 h, 48 h, 72 h. Cell morphology changes was detected using inverted microscopy; cell proliferation changes was determined using MTT; cell apoptosis was determined using flow cytometry.
RESULTS: Nimesulide at different concentrations combined with L-OHP demonstrated growth inhibitory effect on SMMC-7721 with a dosage dependence effect. Nimesulide (50 mmol/L) or L-OHP (1 mg/L) alone significantly inhibited SMMC-7721 cell proliferation. The inhibitory effect of 50 mmol/L Nimesulide combined with L-OHP (0.5, 1.0, 2.0, 5.0 mg/L) was a joint synergy (Q > 1.15). After SMMC-7721 cells were treated with L-OHP 1.0 mg/L, Nimesulide 50 mmol/L, alone or jointly at 24 h, 48 h, 72 h, inhibitory effect of liver cancer cells was increased with time and a synergic effect was observed (Q > 1.15). Flow cytometry showed that both of the two drugs induced SMMC-7721 cells apoptosis, and the combined use resulted in synergic effect.
CONCLUSION: Both Nimesulide and L-OHP can inhibit cell proliferation and promote cell apoptosis of human liver cancer cell line SMMC-7721, and combined use shows a synergic effect.
- Citation: Liu LZ, Jian J, Wu JB, Huang LZ, Shi F. Effects of Nimesulide combined with Oxaliplatin on the proliferation and apoptosis of human liver cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(36): 4041-4045
- URL: https://www.wjgnet.com/1009-3079/full/v16/i36/4041.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i36.4041
目前原发性肝癌仍旧是肿瘤防治难题之一, 根治性手术切除后5年生存率在50%左右, 且仅有不超过10%的患者可行手术治疗; 治疗后复发、转移问题仍未解决, 影响了其远期生存率. 寻找有效的治疗药物、联合化疗方案来丰富和发展肝癌的综合治疗已成为肿瘤防治研究中的热点之一.
环氧化酶-2(cyclooxygenase-2, COX-2)是前列腺素(prostaglandin, PG)生物合成过程中的一个重要限速酶, 可将花生四烯酸代谢为各种PG产物, 从而维持机体的病理生理过程. 近年来大量的研究资料表明, 在人类多种肿瘤的癌前病变、原位癌及癌组织中, COX-2均有过度表达, 并已被证实参与了众多肿瘤的发生、发展过程[1-5]. 奥沙利铂(Oxaliplatin, L-OHP)作为第3代铂类化合物, 与其他铂类药物相似, 其作用机制主要是使肿瘤细胞内DNA形成链间和链内交联, 从而中断DNA合成, 最终产生细胞毒诱导细胞凋亡; 且因其水溶性好、高效、低毒的特点备受临床推崇; 近年来国内外相继报道L-OHP用于结、直肠癌的治疗, 用于肝癌治疗较少. 本研究观察选择性COX-2抑制剂Nimesulide及其联合L-OHP抑制肝癌细胞株SMMC-7721增殖, 诱导凋亡作用, 为肝癌的药物治疗提供基础相关依据.
Nimesulide、L-OHP、四甲基偶氮唑蓝(MTT)、胰酶、二亚基亚砜(DMSO)等购自美国Sigma公司, RPMI 1640培养基购自美国Gibco公司, 胎牛血清购自杭州四季青公司. Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司. SMMC-7721由江西省重点医学分子中心提供.
1.2.1 细胞培养和药物配制: SMMC-7721细胞用含100 mL/L胎牛血清的RPMI 1640培养基, 在37 ℃、50 mL/L CO2培养箱中培养, 细胞长满至瓶底80%左右时传代. Nimesulide、L-OHP均用二甲基亚砜(DMSO)溶解, Nimesulide配制成4.0×105 mmol/L、L-OHP 0.5×105 mg/L配制成的储备液, 需要时用培养液稀释至所需浓度. DMSO稀释后在各组培养液中的终浓度均小于1 mL/L.
1.2.2 实验分组: 根据预实验结果Nimesulide单药浓度设25、50、100、200、400 mmol/L 5组; 筛选Nimesulide一个有效终浓度与不同浓度L-OHP组成联合用药组. L-OHP浓度参照其常用剂量在人体达到的血浆峰浓度(L-OHP为5 mg/L), 选择其血浆峰浓度的1/10-1倍范围设为0.5、1.0、2、5 mg/L. 无药物处理组设为对照组. 另外选取L-OHP有效终浓度与Nimesulide筛选的浓度单独及联合处理肝癌细胞, 设24、48、72 h三个时间组.
1.2.3 倒置显微镜观察细胞形态变化: 倒置显微镜下观察各组细胞处理前后的形态变化.
1.2.4 MTT法检测细胞增殖的抑制作用: 取对数生长期细胞, 用2.5 g/L胰蛋白酶消化接种于96孔板, 每孔7×103个细胞, 培养24 h后加入各实验组药物使其终浓度符合实验要求, 每组设6个复孔; Nimesulide单药组及联合用药组再培养所需时间后每孔加入MTT溶液(5 g/L)20 mL, 37 ℃继续孵育4 h后, 小心吸去孔内上清液并倒置于滤纸上约5 min, 每孔加入150 mL DMSO, 轻轻振荡10 min, 使结晶物(Fomazan颗粒)充分溶解, 用酶标仪在波长492 nm下测定每孔的吸光值(A值), 记录结果, 以每组6个孔的平均值作为相应组的平均值, 实验重复3次. 根据公式计算细胞生长抑制率(E): E = (1-实验组平均A值/对照组平均A值)×100%. 按以下公式计算Q值并判断两药的联合效应: Q = E(A+B)/[EA+(1-EA)×EB], 其中, E(A+B)为两药合用的抑制率, EA、EB为两药单用的抑制率. Q为0.85-1.15表示两药作用相加, Q>1.15表示两药作用协同, Q<0.85表示两药作用相互拮抗.
1.2.5 流式细胞仪检测细胞凋亡率: 细胞培养24 h后加入各实验组药物使其终浓度符合实验要求, 实验组和对照组各3瓶. 置37 ℃、50 mL/L CO2培养箱中贴壁培养, 加药作用48 h后2.5 g/L的胰酶消化制成单细胞悬液. 1000 r/min离心5 min, 弃上清, 用PBS洗涤1次, 然后细胞垂悬于PBS中, 调密度为1×109/L, 用400目筛网过滤2次, 700 mL/L乙醇固定, 4 ℃保存, 按碘化丙啶(PI)法染色后上机检测. 记录激发波长488 nm处红色荧光. 记数1000细胞, 检测凋亡率.
统计学处理 所有数据均采用mean±SD表示, 采用SPSS12.0统计软件进行单因素方差分析, 相关性采用Pearson相关分析, 检验水准α = 0.05, P<0.05为差异有显著性.
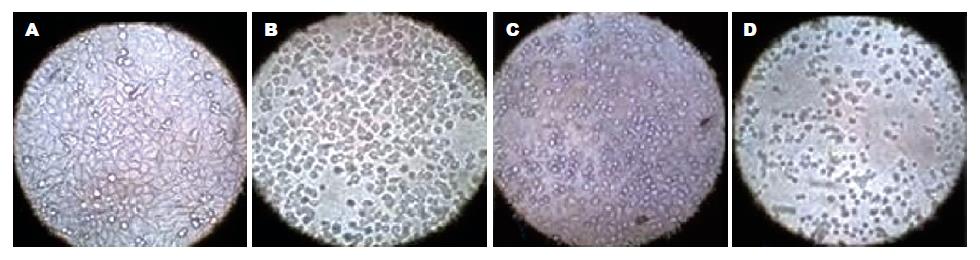
在倒置显微镜下观察, 正常细胞呈现弥漫均匀, 细胞边缘整齐, 凋亡细胞变圆、体积缩小, 核碎裂呈大小不等的圆形小体. 本实验对照组偶见凋亡细胞且活细胞满视野, 而各处理组则可见较多的凋亡细胞而活细胞较少, 并且奥沙利铂组及其联合用药组凋亡细胞明显较Nimesulide单药组增多而活细胞数正好相反(图1).
不同浓度Nimesulide对SMMC-7721细胞的生长抑制率分别为4.69%、12.31%、22.29%、51.03%及62.52%, 在一定浓度范围内呈量-效关系(r = 0.978, P<0.01). Nimesulide单用时浓度为50 mmol/L可显著抑制SMMC-7721细胞的增殖. 因此, 根据Nimesulide对SMMC-7721细胞的抑制效应结果, 选用50 mmol/L作为联合用药的处理浓度.
当L-OHP单用时, 浓度为1.0 mg/L可显著抑制SMMC-7721细胞的增殖, 随着 L-OHP浓度的增加, 抑制作用增大, 呈量-效关系(r = 0.959, P<0.01), Nimesulide与L-OHP联合作用与L-OHP单用相比对SMMC-7721细胞增殖的抑制率均显著增加, 差别均有显著意义(P<0.01), 且两药联用有协同作用(Q>1.15, 表1).
根据联合作用结果, 选用L-OHP 1 mg/L、Nimesulide 50 mmol/L及两药的联合进行生长抑制实验, 所得吸光值及抑制率见表2.
各处理组对肝癌细胞的抑制作用随着时间的延长而增大(r = 0.981, P<0.01), 各时间点两药联合作用与单药相比对SMMC-7721细胞增殖的抑制率均显著增加, 差别均有显著意义(P<0.01), 并且两药联合作用有协同作用(Q>1.15, 表2).
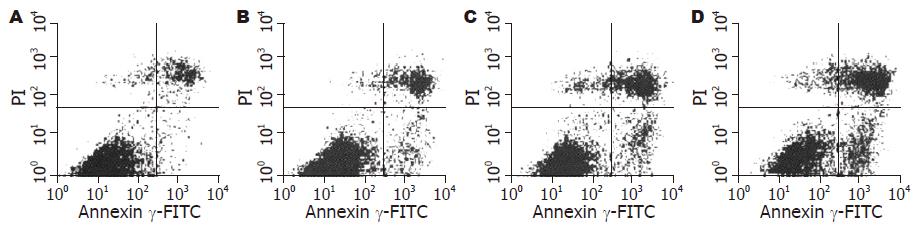
各干预组处理SMMC-7721细胞48 h后凋亡率: 对照组为0.98%±1.7%, Nimesulide(50 mmol/L)为12.45%±4.6%, L-OHP(5 mg/L)为23.27%±6.5%, Nimesulide(50 mmol/L)+ L-OHP(5 mg/L)组为44.12%±7.1%与单药比较差异有统计意义(P<0.01, 图2).
COX-2参与了众多肿瘤的发生、发展过程的主要机制有以下5个方面: 抑制细胞凋亡、刺激肿瘤血管形成、免疫抑制、参与异质物代谢、增加肿瘤细胞的侵袭力. COX-2抑制剂能抑制肿瘤细胞的生长, 诱导其凋亡, 并能对抗肿瘤血管的生成, 抑制肿瘤的侵袭性. 一直是目前肿瘤治疗的热点之一. Chan et al[6]按COX-2表达不同将结直肠癌患者分为两组并都使用阿司匹林, 参与者以问卷方式每两年提供相关数据; 研究结果表明: 高度表达COX-2的结直肠癌经有规律地服用阿司匹林后危险明显降低, 低表达和无表达者不能降低其危险性. Singh et al[7]用全身癌细胞萤光成像技术研究乳腺癌骨转移的小鼠模型中的COX-2的作用发现乳腺癌细胞表达COX-2可能是乳腺癌患者发展至为骨转移的重要因素而COX-2抑制剂可能有效地制止这一进程. 在原发性肝癌方面, Park et al[8]应用NS-398对肝癌细胞株Hep3b研究发现COX-2直接参与原发性肝癌细胞的增殖.
本实验结果显示, Nimesulide及L-OHP对人肝癌细胞株SMMC-7721的生长均有抑制作用, 在一定浓度范围内随浓度增加其抑制作用增强, 呈量-效关系; 并且Nimesulide与L-OHP单用及联合作用时, 随着时间的延长对细胞的抑制作用增大. 我们观察到Nimesulide及L-OHP联合应用时有协同作用, 表明两种药物对人肝癌细胞株SMMC-7721的联合作用优于单独用药的效果. Nimesulide及L-OHP抑制肿瘤生长的机制各异, 尽管两者联合应用呈现协同增强效果, 但在具体环节尚不清楚. 有研究结果提示, 部分细胞毒药物可作用于某些细胞信号转导机制而诱导COX-2的表达, 因此COX-2抑制剂可以增强细胞毒药物的作用. 也有人认为COX-2抑制剂可能作用于多药耐药基因而和细胞毒药物产生协同作用[9].
Nimesulide联合L-OHP对人肝癌细胞生长的高效抑制作用是否能成为肝癌治疗的一个联合化疗方案, 其作用机制以及COX-2抑制剂潜在的心血管事件[10]的处理有待进一步研究.
人类多种肿瘤的癌前病变、原位癌及癌组织中, COX-2均有过度表达, 并已被证实参与了众多肿瘤的发生、发展过程. 因此, 近年来高选择性COX-2抑制剂抗肿瘤的作用一直是研究热点.
黄志勇, 副教授, 华中科技大学同济医院普外科
COX-2抑制剂能抑制肿瘤细胞的生长, 诱导其凋亡, 并能对抗肿瘤血管的生成, 抑制肿瘤的侵袭性, 对COX-2过表达的患者来说COX-2抑制剂可能是联合化疗的一个理想的选择, 可能为肿瘤的防治和靶向治疗提供新的策略和途径.
研究已发现COX-2抑制剂能明显降低高度表达COX-2直肠癌患者的危险性, 能有效地制止乳腺癌细胞骨转移的进程.
本文探讨高选择性COX-2抑制剂Nimesulide联合奥沙利铂(L-OHP)对人肝癌细胞株SMMC-7721增殖与凋亡的影响, 为肝癌的药物治疗提供基础相关依据.
本研究能够运用成熟的实验方法研究Nimesulide联合奥沙利铂在体外对人肝癌细胞株增殖与凋亡的影响, 对当前关于COX-2抑制剂的抗癌作用这一研究热点问题进行探索, 具有一定可读性和参考价值.
编辑: 史景红 电编: 何基才
| 1. | Mohammed SI, Knapp DW, Bostwick DG, Foster RS, Khan KN, Masferrer JL, Woerner BM, Snyder PW, Koki AT. Expression of cyclooxygenase-2 (COX-2) in human invasive transitional cell carcinoma (TCC) of the urinary bladder. Cancer Res. 1999;59:5647-5650. [PubMed] |
| 2. | Shiotani H, Denda A, Yamamoto K, Kitayama W, Endoh T, Sasaki Y, Tsutsumi N, Sugimura M, Konishi Y. Increased expression of cyclooxygenase-2 protein in 4-nitroquinoline-1-oxide-induced rat tongue carcinomas and chemopreventive efficacy of a specific inhibitor, nimesulide. Cancer Res. 2001;61:1451-1456. [PubMed] [DOI] |
| 3. | Soslow RA, Dannenberg AJ, Rush D, Woerner BM, Khan KN, Masferrer J, Koki AT. COX-2 is expressed in human pulmonary, colonic, and mammary tumors. Cancer. 2000;89:2637-2645. [PubMed] |
| 4. | Lim HY, Joo HJ, Choi JH, Yi JW, Yang MS, Cho DY, Kim HS, Nam DK, Lee KB, Kim HC. Increased expression of cyclooxygenase-2 protein in human gastric carcinoma. Clin Cancer Res. 2000;6:519-525. [PubMed] |
| 5. | Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM, Edwards DA, Flickinger AG, Moore RJ, Seibert K. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors. Cancer Res. 2000;60:1306-1311. [PubMed] |
| 6. | Chan AT, Ogino S, Fuchs CS. Aspirin and the risk of colorectal cancer in relation to the expression of COX-2. N Engl J Med. 2007;356:2131-2142. [PubMed] [DOI] |
| 7. | Singh B, Berry JA, Shoher A, Ayers GD, Wei C, Lucci A. COX-2 involvement in breast cancer metastasis to bone. Oncogene. 2007;26:3789-3796. [PubMed] [DOI] |
| 8. | Park JW, Park JE, Lee JA, Lee CW, Kim CM. Cyclooxygenase-2 (COX-2) is directly involved but not decisive in proliferation of human hepatocellular carcinoma cells. J Cancer Res Clin Oncol. 2006;132:184-192. [PubMed] [DOI] |
| 9. | Soriano AF, Helfrich B, Chan DC, Heasley LE, Bunn PA Jr, Chou TC. Synergistic effects of new chemopreventive agents and conventional cytotoxic agents against human lung cancer cell lines. Cancer Res. 1999;59:6178-6184. [PubMed] |
| 10. | Bertagnolli MM, Eagle CJ, Zauber AG, Redston M, Solomon SD, Kim K, Tang J, Rosenstein RB, Wittes J, Corle D. Celecoxib for the prevention of sporadic colorectal adenomas. N Engl J Med. 2006;355:873-884. [PubMed] [DOI] |