修回日期: 2008-10-09
接受日期: 2008-10-27
在线出版日期: 2008-12-18
目的: 探讨胆囊癌肉瘤患者的诊断与鉴别诊断, 以及治疗方法和预后.
方法: 我院收治1例胆囊癌肉瘤患者, 研究其临床表现及诊疗经过, 并进行随访, 同时对标本进行病理学检查, 再结合有关文献, 探讨该病的特点.
结果: 肿瘤侵犯肝脏并侵犯结肠至肌层. 病理可见上皮源性肿瘤成分与间叶源性肿瘤成分同时存在且没有移行现象, 且该病预后极差.
结论: 胆囊癌肉瘤是一种罕见的高度恶性肿瘤, 需要与肉瘤样癌等并相鉴别, 预后与肿瘤分期有关.
引文著录: 李柏峰, 刘永锋, 石蕊, 刘作良. 胆囊癌肉瘤的临床病理学特征分析. 世界华人消化杂志 2008; 16(35): 4008-4011
Revised: October 9, 2008
Accepted: October 27, 2008
Published online: December 18, 2008
AIM: To study the clinical and pathological feature of gallbladder carcinosarcoma and to investigate its differential diagnosis, treatment and prognosis.
METHODS: One case of gallbladder carcinosarcoma was treated in our hospital. We studied this disease with its clinical data, histopathology and immunohistochemistry, and relative literature were reviewed, in order to reveal the characteristics of this disease.
RESULTS: The tumor had infiltrated into liver and muscular layer of colon. Histopathology and immunohistochemistry showed neoplasm of carcinoma and sarcoma simultaneously co-existed, and no transitional areas were detected between carcinoma and sarcoma. The prognosis of this disease was poor.
CONCLUSION: Gallbladder carcinosarcoma is a rare tumor with high malignant neoplasm, which needs to be discriminated from several similar diseases. Its prognosis is correlated with the stage of the tumor.
- Citation: Li BF, Liu YF, Shi R, Liu ZL. Clinicopathologic features of gallbladder carcinosarcoma. Shijie Huaren Xiaohua Zazhi 2008; 16(35): 4008-4011
- URL: https://www.wjgnet.com/1009-3079/full/v16/i35/4008.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i35.4008
胆囊癌肉瘤(gallbladder carcinosarcoma)是一种恶性上皮成分与恶性间叶成分交织混合生长的恶性肿瘤, 恶性度高, 预后差, 十分罕见. 上皮成分主要为腺癌、鳞状细胞癌或两者均有; 间叶成分表现多样, 包括纤维肉瘤、平滑肌肉瘤、横纹肌肉瘤、血管肉瘤、骨肉瘤、软骨肉瘤和神经肉瘤等[1-5]. 肿瘤可以呈弥漫性生长或呈巨大的息肉样凸入胆囊腔内生长, 并有坏死[3,6-7]. 本文报道1例我院治疗的胆囊癌肉瘤病例, 并结合以往文献探讨该病的发生发展、临床表现、病理学特征, 以及诊断治疗和预后转归.
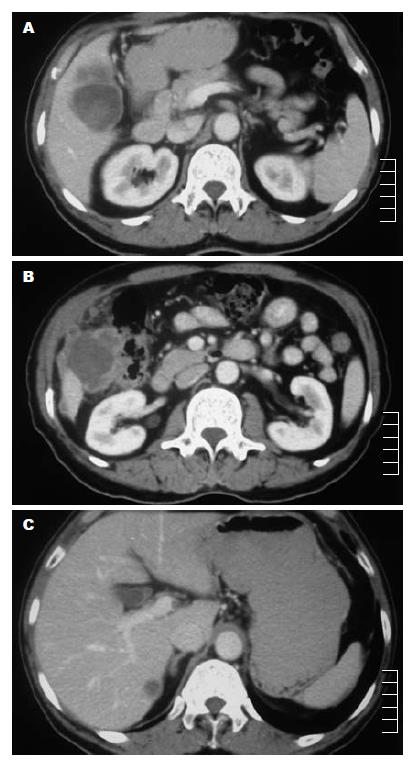
患者, 男, 64岁, 因"右季肋部疼痛2 mo"于2007-11入院. 疼痛为阵发性胀痛, 进行性加重, 无明显诱因, 可放散至右肩背部, 消瘦明显, 无发热, 无黄疸. 既往有胆囊结石病史10年, 保守治疗. 体检: 一般状态可, 皮肤巩膜无黄染, 右上腹肋下4 cm可触及肿大胆囊, 质硬, 不活动, 无压痛. 行增强CT. 肿瘤系列: CA19-9: 399.45 kU/L(0-37 kU/L), CEA: 5.75 μg/L(0-5 μg/L), AFP: 2.54 kIU/L(0-9 kIU/L). 治疗: 行胆囊切除, 右半结肠切除, 肝脏转移病灶切除. 术后12 d, CA19-9降至94.17 kU/L. 术后1 mo入我院肿瘤内科开始正规化疗, 同时增强CT发现肝脏再次出现多发转移病灶, 伴有脊椎转移, CA19-9再次升高达283.2 kU/L. 患者术后3 mo死于脑转移.
手术结合术中超声, 将胆囊、肝脏Ⅵ段, 和所有肝脏转移病灶(共10处), 以及右半结肠整块切除. 肿瘤经40 g/L甲醛溶液固定, 石蜡包埋, HE染色. 免疫组化采用EnVison方法, 一抗为CK(H), CK(L), CEA, CD68, Vimentin.
胆囊大小约13 cm×6 cm×5 cm, 内有两枚直径约2.5 cm结石; 肿瘤位于胆囊底, 大小约4 cm×3 cm×3 cm, 黄白色, 质脆, 向胆囊腔内生长, 占据囊腔大部分, 并沿胆囊壁向肝脏浸润生长, 范围约2 cm, 同时向下侵及结肠肝曲, 形成一大小约10 cm×8 cm×8 cm质硬肿块; 肝脏转移病灶共10处, 最大者3 cm×3 cm×2 cm, 位于肝Ⅱ段, 其余病灶直径约1-2 cm, 散在分布肝脏各段, 均为灰白色结节; 结肠肝曲浆膜面被肿瘤侵及, 界限不清, 黏膜未见明显异常, 肠系膜有一枚直径约1.5 cm质硬结节.
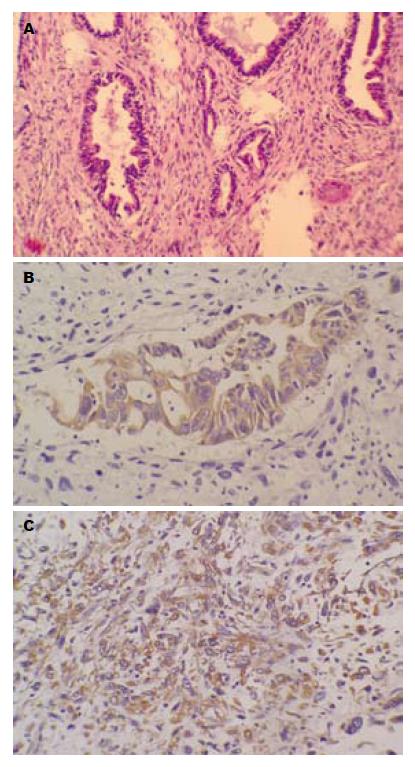
肿瘤由两种成分组成: 一种是排列呈不规则形腺管状、实性团片状, 弥漫分布, 瘤细胞胞质较丰富、核大深染、卵圆形或不规则形, 染色质粗, 有清楚的核仁, 核异形性明显, 并可见较多病理性核分裂象, 呈腺癌表现; 另一种为梭形细胞, 排列成束状交织, 细胞大小不一, 异型性明显, 边界不清, 核染色深, 核分裂多见, 具有肉瘤特征. 癌和肉瘤之间无过度现象. 肿瘤侵犯肝脏并侵犯结肠至肌层(图2).
上皮源性肿瘤成分CK(L)(+), CEA(±), 肉瘤成分Vimentin(+), 两者同时存在, 无过渡现象. 病理诊断为胆囊癌肉瘤.
1907年Huguet et al[4]报道了第1例原发于胆囊的癌肉瘤, 截至2005年国外报道不足100例[5], 国内仅10余例. Kubota et al[1]总结了文献报道的18例胆囊癌肉瘤的临床病理特征, 发现恶性上皮成分中腺癌占50%, 腺癌伴鳞癌或鳞化占28%, 鳞状细胞癌占11%; 50%的病例间质成分为同源性肉瘤, 另50%的病例中出现恶性骨、软骨及其他异源性间质组织. 患者多为女性, 是男性的4.3倍; 发病年龄从45-90岁, 平均69.8岁. 82%的患者伴有胆囊结石. 术后患者生存时间0.5-8 mo, 平均生存时间2.9 mo. 本例患者手术后1 mo即有肿瘤复发并远隔转移, 术后生存时间为3 mo, 与以往文献报道相一致.
胆囊癌的高危因素考虑与胆囊结石的长期刺激有关, 胆囊癌肉瘤的发生是否与慢性胆囊炎、胆囊结石有关尚无相关文献报道. 但从以往文献中可以看出, 胆囊癌肉瘤患者多伴有多年胆囊结石、慢性胆囊炎病史. 本例患者有胆囊结石病史10年, 术中发现胆囊内2枚直径约2.5 cm结石, 故考虑该病可能与结石长期刺激有关.
癌肉瘤在其他部位(如宫颈、肺、膀胱等)也有报道[8-10], 但限于病例数少, 所以癌肉瘤确切的发生机制尚不清楚. 目前关于癌肉瘤的发生主要有两种假说, 一是"聚合"假说(convergence hypothesis), 认为该肿瘤由两种或多种干细胞分化而来, 不同来源的细胞相互混合生长, 肿瘤为多克隆性; 二是"发散"假说(divergence hypothesis), 认为癌肉瘤中的两种异质性成分是由全能干细胞向上皮及间叶两种不同方向分化的结果, 肿瘤为单克隆性.
近年来由于分子生物学及分子遗传学技术的发展, 许多学者就这两种假说做了定量的研究, 提出了一些有利的证据. 有研究者通过分子生物学手段检测相关的基因片段, 证明发生于子宫、乳腺、肺和胃肠道的癌肉瘤均为单克隆性[11]. Dacic et al[12]利用显微切割技术分别获得了纯度较高的癌细胞和肉瘤细胞, 发现两者具有部分相同的染色体等位基因缺失位点, 从而证实癌肉瘤中的两种异质性成分来源于全能干细胞, 肿瘤为单克隆性; 同时还发现肉瘤细胞具有更丰富的遗传学变异, 提示在癌肉瘤的形成过程中全能干细胞很可能先转化为癌细胞, 继而转化为肉瘤细胞. 尚需更多的病例以及检测更多的染色体等位基因缺失位点, 才能明确全能干细胞如何转化为癌细胞和上皮细胞, 阐明癌肉瘤的发生机制.
胆囊癌肉瘤多发生于中、老年女性, 早期发现困难, 发病时常已与周围组织粘连, 就诊时多已发生周围器官、淋巴结或远处器官的转移. 本病例就诊时肿瘤已经侵及结肠肝曲, 伴有肝脏广泛转移. 本病临床表现及影像学检查与胆囊癌类似, 可以表现为反复发作的上腹疼痛或饱胀不适, 食欲下降, 也有体检时无意中发现胆囊肿物; B超或CT提示胆囊腔内息肉状或结节状肿物, 可伴有或不伴胆囊结石.
CA19-9作为胆道系统恶性肿瘤的标志物已经得到一定的认识. 在本例胆囊癌肉瘤的诊疗经过中, 术前CA19-9显著高于正常值(399.45 kU/L). 随着肿瘤及其转移病灶的切除, CA19-9迅速下降(94.17 kU/L); 而当肿瘤复发时, 该标记再次升高(283.2 kU/L). 这提示CA19-9在胆囊癌肉瘤的诊断和判断复发方面, 有一定意义.
胆囊癌肉瘤的诊断几乎全部为手术后病理诊断. 其组织学诊断比较困难, 要明确诊断胆囊癌肉瘤, 尚需和以下几种疾病鉴别: (1)胆囊肉瘤样癌(sarcomatoid carcinoma, 梭形细胞癌或未分化癌), 属上皮源性肿瘤, 本质上属于分化差的癌. 肿瘤的部分区域由于细胞分化程度低而呈梭形或多形性, 而貌似肉瘤. 肉瘤样癌上皮样恶性细胞与肉瘤样恶性细胞之间有过渡现象, 电镜下其肉瘤成分具有桥粒连接, 胞质内有张力微丝等上皮细胞的超微结构特征, 并可清晰显示两种成分的移行形态[3,13]. 免疫组织化学肉瘤成份既表达上皮性标志物, 也可表达间叶性标记. 而癌肉瘤没有上述电镜特征, 且癌肉瘤上皮与间叶成份两者分界清楚无过渡现象. 梭形细胞角蛋白染色阴性有助于癌肉瘤与肉瘤样癌鉴别. (2)胆囊肉瘤中夹杂陷入的正常胆囊上皮成份, 仔细观察可以发现, 夹杂的上皮成分无组织结构和细胞型态异型性, 无病理性核分裂象. (3)胆囊癌中出现偶见的化生性改变, 如鳞化、软骨化、骨化, 化生病灶为成熟间质结构, 无细胞异型性; 还有反应性间质纤维组织增生, 如果间质增生活跃, 也可似肉瘤样结构, 但细胞无异型性, 也无病理性核分裂象, 均为成熟的间叶结构. (4)胆囊腺肌瘤病(腺肌瘤性增生, adenomyomatosis), 该病是一种获得性良性变病, 以表面上皮广泛延伸至增厚的胆囊肌层, 常常达浆膜层为特征. 腺上皮形成腺管长入肌层, 有时位置可以深达胆囊浆膜层, 腺管周围纤维级织、平滑肌组织不同程度的增生, 腺上皮及间叶组织成份均无异型性. 而癌肉瘤的上皮和间叶成份均为恶性, 细胞异型性明显.
目前的治疗方式依然以手术为主, 但远期疗效并不理想. Kubota et al[1]指出该病的临床表现与生物学行为与胆囊癌相似, 分期相同时生物学行为相同, 当癌肉瘤局限在胆囊浆膜时, 外科治疗后可长期存活.
胆囊癌肉瘤的预后主要与肿瘤分期有关[14], 分期可参考胆囊癌TNM系统分期标准[15-16]. 根据不同的T、N、M分类将胆囊癌分5期: 0期指原位癌; Ⅰ期指侵犯局限于黏膜层或黏膜肌层, 无淋巴结转移; Ⅱ期指肿瘤侵犯全层, 未侵犯周围脏器, 无淋巴结转移; Ⅲ期指肿瘤突破浆膜层或直接侵犯一个邻近脏器(肝脏浸润深度<2 cm)或N1淋巴结转移; Ⅳ期指出现远处转移或侵犯两个以上的邻近脏器, 或N2淋巴结转移. 本病例术前肿瘤就已经侵及肝脏和结肠肝曲, 可归为Ⅳ期, 恶性程度很高.
胆囊肉瘤就诊时多处于晚期, 因此往往错过了手术根治肿瘤的最佳时机, 预后更差. 典型病例多死于诊断后6 mo内, 生存期很少超过20 mo.
胆囊癌肉瘤是一种发生在胆囊的, 恶性上皮成分与恶性间叶成分交织混合生长的恶性肿瘤, 恶性度高, 预后差. 该病十分罕见, 至今国外报道不足100例, 国内仅10余例. 胆囊癌肉瘤的诊断几乎全部为手术后病理诊断, 预后主要与肿瘤分期有关.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
研究表明, 胆囊癌肉瘤的临床表现与生物学行为与胆囊癌相似, 当癌肉瘤局限在胆囊浆膜时, 外科治疗后可长期存活.
胆囊癌肉瘤患者多伴有多年胆囊结石、慢性胆囊炎病史, 故考虑该病的高危因素可能与胆囊结石的长期刺激有关.
本文报告1例胆囊癌肉瘤, 并复习了相关文献, 对于系统了解该病的临床病理特点有一定实用价值.
编辑: 李军亮 电编: 何基才
| 1. | Kubota K, Kakuta Y, Kawamura S, Abe Y, Inamori M, Kawamura H, Kirikoshi H, Kobayashi N, Saito S, Nakajima A. Undifferentiated spindle-cell carcinoma of the gallbladder: an immunohistochemical study. J Hepatobiliary Pancreat Surg. 2006;13:468-471. [PubMed] [DOI] |
| 2. | Ajiki T, Nakamura T, Fujino Y, Suzuki Y, Takeyama Y, Ku Y, Kuroda Y, Ohbayashi C. Carcinosarcoma of the gallbladder with chondroid differentiation. J Gastroenterol. 2002;37:966-971. [PubMed] [DOI] |
| 3. | Kim MJ, Yu E, Ro JY. Sarcomatoid carcinoma of the gallbladder with a rhabdoid tumor component. Arch Pathol Lab Med. 2003;127:e406-e408. [PubMed] [DOI] |
| 4. | Huguet KL, Hughes CB, Hewitt WR. Gallbladder carcinosarcoma: a case report and literature review. J Gastrointest Surg. 2005;9:818-821. [PubMed] [DOI] |
| 5. | Sodergren MH, Silva MA, Read-Jones SL, Hubscher SG, Mirza DF. Carcinosarcoma of the biliary tract: two case reports and a review of the literature. Eur J Gastroenterol Hepatol. 2005;17:683-685. [PubMed] [DOI] |
| 6. | de Aretxabala X, Roa I, Burgos L, Losada H, Roa JC, Mora J, Hepp J, Leon J, Maluenda F. Gallbladder cancer: an analysis of a series of 139 patients with invasion restricted to the subserosal layer. J Gastrointest Surg. 2006;10:186-192. [PubMed] [DOI] |
| 7. | Takahashi Y, Fukushima J, Fukusato T, Shiga J. Sarcomatoid carcinoma with components of small cell carcinoma and undifferentiated carcinoma of the gallbladder. Pathol Int. 2004;54:866-871. [PubMed] [DOI] |
| 8. | Laterza R, Seveso A, Zefiro F, Formenti G, Mellana L, Donadello N, Ghezzi F, Bolis P, Riva C. Carcinosarcoma of the uterine cervix: case report and discussion. Gynecol Oncol. 2007;107:S98-S100. [PubMed] [DOI] |
| 9. | Wright JL, Black PC, Brown GA, Porter MP, Kamat AM, Dinney CP, Lin DW. Differences in survival among patients with sarcomatoid carcinoma, carcinosarcoma and urothelial carcinoma of the bladder. J Urol. 2007;178:2302-2306; discussion 2307. [PubMed] [DOI] |
| 10. | Venissac N, Pop D, Lassalle S, Berthier F, Hofman P, Mouroux J. Sarcomatoid lung cancer (spindle/giant cells): an aggressive disease? J Thorac Cardiovasc Surg. 2007;134:619-623. [PubMed] [DOI] |
| 11. | Sung MT, Wang M, MacLennan GT, Eble JN, Tan PH, Lopez-Beltran A, Montironi R, Harris JJ, Kuhar M, Cheng L. Histogenesis of sarcomatoid urothelial carcinoma of the urinary bladder: evidence for a common clonal origin with divergent differentiation. J Pathol. 2007;211:420-430. [PubMed] [DOI] |
| 12. | Dacic S, Finkelstein SD, Sasatomi E, Swalsky PA, Yousem SA. Molecular pathogenesis of pulmonary carcinosarcoma as determined by microdissection-based allelotyping. Am J Surg Pathol. 2002;26:510-516. [PubMed] [DOI] |
| 14. | Zhang L, Chen Z, Fukuma M, Lee LY, Wu M. Prognostic significance of race and tumor size in carcinosarcoma of gallbladder: a meta-analysis of 68 cases. Int J Clin Exp Pathol. 2008;1:75-83. [PubMed] [DOI] |
| 15. | Principe A, Del Gaudio M, Ercolani G, Golfieri R, Cucchetti A, Pinna AD. Radical surgery for gallbladder carcinoma: possibilities of survival. Hepatogastroenterology. 2006;53:660-664. [PubMed] [DOI] |
| 16. | Chijiiwa K, Kai M, Nagano M, Hiyoshi M, Ohuchida J, Kondo K. Outcome of radical surgery for stage IV gallbladder carcinoma. J Hepatobiliary Pancreat Surg. 2007;14:345-350. [PubMed] [DOI] |