修回日期: 2008-11-11
接受日期: 2008-11-17
在线出版日期: 2008-12-18
目的: 探讨分泌型Frizzled相关蛋白2(Secreted Frizzled-related proteins 2, SFRP2)和β-连接素(β-catenin)在大肠癌发生、发展中的作用.
方法: 采用免疫组化SP法检测20例正常大肠黏膜、20例非腺瘤性息肉、36例大肠腺瘤和42例大肠癌组织中的SFRP2和β-catenin蛋白的表达情况, 分析二者表达的差异及其与临床病理参数的关系.
结果: 大肠癌和大肠腺瘤组SFRP2的阳性表达率显著低于正常大肠黏膜和非腺瘤性息肉组(28.57% vs 100.0%, 95.0%; 36.11% vs 100.0%, 95.0%, 均P<0.05); 大肠癌中β-catenin膜表达缺失率显著高于正常大肠黏膜、非腺瘤性息肉及大肠腺瘤组(52.4% vs 0%, 0%, 11.1%, 均P<0.05); 大肠癌和大肠腺瘤组β-catenin异位表达率显著高于正常大肠黏膜和非腺瘤性息肉组(64.3% vs 0%, 0%; 30.6% vs 0%, 0%, 均P<0.05), 大肠癌β-catenin异位表达率高于大肠腺瘤(P<0.05); SFRP2表达、β-catenin膜表达缺失及异位表达与大肠癌患者的肿瘤部位、大体形态、肿瘤直径、淋巴转移和Dukes分期无明显关系, 而与大肠癌的分化程度密切相关, 其中SFRP2表达还与大肠癌的浸润深度密切相关; SFRP2表达与β-catenin膜表达缺失、异位表达均呈明显负相关(r = -0.452, P = 0.003; r = -0.519, P = 0.000), 而β-catenin膜表达缺失与异位表达呈明显正相关(r = 0.782, P = 0.000).
结论: SFRP2和β-catenin的表达与大肠癌的发生、发展密切相关, 可能是大肠癌发生的早期事件, 且SFRP2表达与β-catenin膜表达缺失、异位表达均呈负相关, 前者起抑癌作用, 后者起促癌作用.
引文著录: 刘宁, 姜海行, 黄振宁, 覃山羽, 李信. SFRP2和β-catenin在大肠癌中的表达及其临床意义. 世界华人消化杂志 2008; 16(35): 3963-3969
Revised: November 11, 2008
Accepted: November 17, 2008
Published online: December 18, 2008
AIM: To investigate the role of Secreted Frizzled-related proteins 2 (SFRP2) and β-catenin in carcinogenesis and progression of colorectal carcinoma.
METHODS: Expression of SFRP2 and β-catenin proteins were examined immunohistochemically in 20 cases of normal colorectal mucosa, 20 cases of colorectal polyp, 36 cases of colorectal adenomas and 42 cases of colorectal carcinoma. The corresponding clinical data between the expression of SFRP2 and β-catenin proteins were analyzed retrospectively.
RESULTS: The positive expression rates of SFRP2 were significantly lower in colorectal carcinoma and colorectal adenoma than in normal colorectal mucosa and colorectal polyp (28.57% vs 100.0%, 95.0%; 36.11% vs 100.0%, 95.0%, all P < 0.05). The reduced membranous β-catenin expression rate was significantly higher in colorectal carcinoma than in normal colorectal mucosa, colorectal polyp and colorectal adenoma (52.4% vs 0%, 0%, 11.1%, all P < 0.05). The cytoplasmic and nuclear β-catenin expression rates were significantly higher in colorectal carcinoma and colorectal adenomas than in normal colorectal mucosa and colorectal polyp (64.3% vs 0%, 0%; 30.6% vs 0%, 0%, all P < 0.05), higher in colorectal carcinoma than in colorectal adenomas (P < 0.05). The positive expression of SFRP2, reduced membranous β-catenin expression and cytoplasmic and nuclear β-catenin expression in colorectal carcinoma were significantly correlated with the tumor differentiation, but not with the tumor position, morphology or size, lymph node metastasis or Duke's stage. Besides, the positive expression of SFRP2 was significantly correlated with the depth of invasion in colorectal carcinoma. The positive expression of SFRP2 was negatively correlated with the reduced membranous β-catenin expression (r = -0.452, P = 0.003) and cytoplasmic and nuclear β-catenin expression (r = -0.519, P = 0.000). There existed positive correlation between the reduced membranous β-catenin expression and cytoplasmic and nuclear β-catenin expression (r = 0.782, P = 0.000).
CONCLUSION: The expression of SFRP2 and β-catenin are closely correlated with the carcinogenesis and progression of colorectal carcinoma, and may be an early event. The positive expression of SFRP2 is negatively correlated with the reduced membranous β-catenin expression and cytoplasmic and nuclear β-catenin expression. The former may inhibit carcinogenesis and latter may promote carcinogenesis.
- Citation: Liu N, Jiang HX, Huang ZN, Qin SY, Li X. Expression of SFRP2 and β-catenin in the carcinogenesis and progression of colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(35): 3963-3969
- URL: https://www.wjgnet.com/1009-3079/full/v16/i35/3963.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i35.3963
大肠癌(colorectal cancer, CRC)是世界第三大常见的恶性肿瘤, 在欧美国家居恶性肿瘤死因的第二位[1-2]. 随着我国饮食结构、生活习惯和环境的改变, 其发病率逐年上升[3], 和大多数恶性肿瘤一样, 大肠癌的发病机制尚不清楚. 新近研究发现, 90%以上的结肠癌和直肠癌存在Wnt/β-catenin信号转导通路的激活, 以及继发于此的β-catenin蛋白在细胞内的集聚[4]. Wnt信号通路控制着细胞的生长、运动和分化, 已被确认是与肿瘤相关的一个关键性信号通路[5]. 本研究应用免疫组化技术检测Wnt信号通路拮抗剂SFRP2和Wnt信号通路关键蛋白β-catenin在大肠癌发生、发展过程中的表达及相互关系, 以探讨二者在大肠癌发生、发展中的作用.
病例标本来源于广西医科大学第一附属医院2004-2007手术切除或内镜活检的病理确诊组织118例, 分为4组: (1)大肠癌组42例, 男24例, 女18例, 年龄30-87(中位年龄61)岁. 所有病例术前均未经放疗和化疗. 其中结肠癌23例, 直肠癌19例; 肿瘤局限于黏膜下层/肌层12例, 浸润至浆膜/浆膜外30例; 有淋巴结转移18例, 无淋巴结转移24例; Duke's分期A期9例, B期13例, C+D期20例. (2)大肠腺瘤组36例. (3)非腺瘤性息肉组20例, 其中炎症性息肉8例, 增生性息肉10例, 幼年性息肉1例, P-J息肉1例. (4)正常大肠黏膜组20例, 均为内镜下活检的正常大肠黏膜.
兔抗人SFRP2多克隆抗体购自美国Santa Cruz公司, 兔抗人β-catenin抗体购自美国Thermo公司, 免疫组化SP试剂盒、DAB显色试剂盒购自福州迈新生物技术有限公司.
采用免疫组化SP法. 所有操作严格按产品说明书进行. PBS代一抗作阴性对照, 分别以已知的SFRP2, β-catenin表达阳性的正常大肠黏膜作阳性对照. 免疫组化染色阳性信号为棕黄色细小颗粒. SFRP2染色结果依据染色强度和阳性细胞率综合计算评分. 染色强度分级: 无染色为0, 淡黄色为1, 棕黄色及更深颜色为3; 阳性细胞率: ≤50%为0, 51%-75%为1, ≥76%为2. 两项得分相加结果>2为阳性表达[6]. β-catenin染色结果的判断标准按照Maruyama et al[7]方法, 分别从细胞膜、细胞质、细胞核三方面判断其在细胞内的分布情况. 细胞膜>70%细胞阳性为正常表达, 反之为膜表达缺失; 细胞质或细胞核>10%细胞阳性为胞质或胞核阳性表达, 即异位表达.
统计学处理 应用SPSS13.0统计软件对所得数据进行χ2检验和Spearman相关分析, P<0.05为差异有统计学意义.
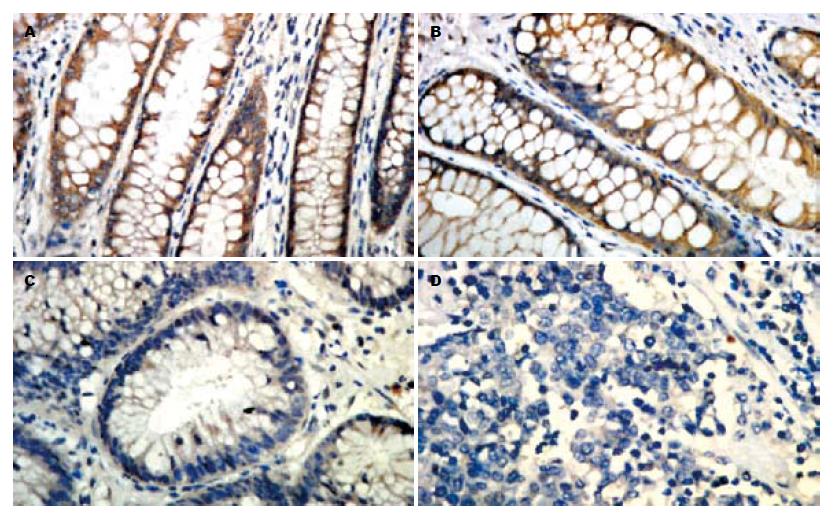
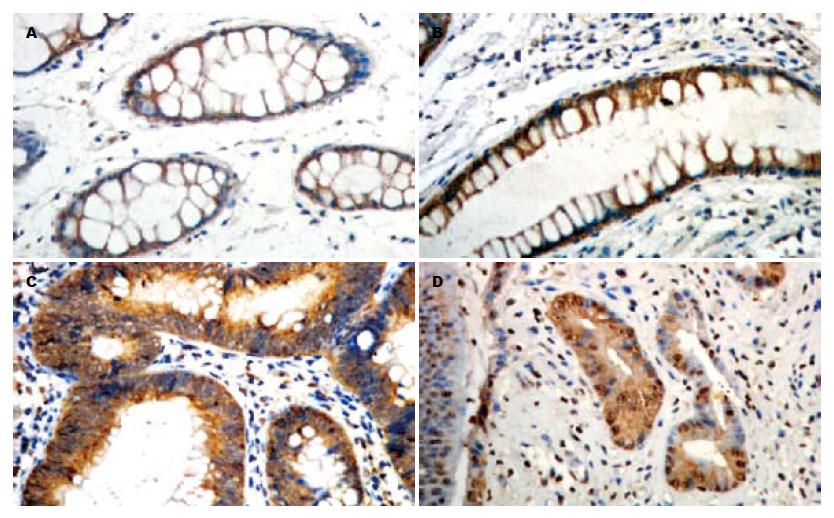
正常大肠黏膜和非腺瘤性息肉组中SFRP2阳性信号主要定位于胞质(图1A-B), β-catenin主要定位于细胞膜(图2A-B), 而大肠癌和大肠腺瘤组SFRP2表达降低(图1C-D), β-catenin呈不同程度的膜表达缺失和胞质/胞核异位表达(图2C-D). 大肠癌和大肠腺瘤组SFRP2阳性率均显著低于正常大肠黏膜和非腺瘤性息肉组(P<0.05, 表1), 其二者之间无显著性差异. 大肠癌中β-catenin膜表达缺失率显著高于正常大肠黏膜、非腺瘤性息肉和腺瘤组(P<0.05, 表1), 腺瘤组与正常大肠黏膜、非腺瘤性息肉组之间无显著性差异. 大肠癌和腺瘤组β-catenin异位表达率均显著高于正常大肠黏膜和非腺瘤性息肉组, 大肠癌中β-catenin异位表达率也高于腺瘤组(P<0.05, 表1).
SFRP2表达与大肠癌患者肿瘤部位、大体形态、肿瘤直径、淋巴结转移和Duke's分期均无明显关系, 与分化程度、浸润深度密切相关(P<0.05, 表2); β-catenin膜表达缺失、异位表达与大肠癌患者肿瘤部位、大体形态、肿瘤直径、浸润深度、淋巴结转移和Duke's分期均无明显关系, 与大分化程度密切相关(P<0.05, 表2); 随着大肠癌恶性程度的增高SFRP2表达逐渐减少, β-catenin膜表达缺失及异位表达越来越明显.
| n | SFRP2阳性表达 | β-catenin | ||
| 膜表达缺失 | 异位表达 | |||
| 肿瘤部位 | ||||
| 结肠 | 23 | 5(21.74) | 10(43.48) | 15(65.22) |
| 直肠 | 19 | 7(36.84) | 12(63.16) | 12(63.16) |
| P | >0.05 | >0.05 | >0.05 | |
| 大体形态 | ||||
| 溃疡 | 11 | 2(18.18) | 6(54.55) | 7(63.64) |
| 肿块 | 27 | 9(33.33) | 14(51.85) | 17(62.96) |
| 浸润 | 4 | 1(25.00) | 2(50.00) | 3(75.00) |
| P | >0.05 | >0.05 | >0.05 | |
| 肿瘤直径(cm) | ||||
| ≥5 | 27 | 5(18.52) | 16(59.26) | 20(74.07) |
| <5 | 15 | 7(46.67) | 6(40.00) | 7(46.67) |
| P | >0.05 | >0.05 | >0.05 | |
| 分化程度 | ||||
| 高 | 14 | 7(50.00) | 4(28.57) | 6(42.86) |
| 中 | 14 | 4(28.57) | 7(50.00) | 8(57.14) |
| 低 | 14 | 1(7.14) | 11(78.57) | 13(92.86) |
| P | <0.05 | <0.05 | <0.05 | |
| 浸润深度 | ||||
| 黏膜下层/肌层 | 12 | 7(58.33) | 6(50.00) | 6(50.00) |
| 浆膜/浆膜外 | 30 | 5(16.67) | 16(53.33) | 21(70.00) |
| P | <0.05 | >0.05 | >0.05 | |
| 淋巴结转移 | ||||
| 有 | 18 | 3(16.67) | 11(61.11) | 13(72.22) |
| 无 | 24 | 9(37.50) | 11(45.83) | 14(58.33) |
| P | >0.05 | >0.05 | >0.05 | |
| Duke's分期 | ||||
| A | 9 | 5(55.56) | 5(55.56) | 5(55.56) |
| B | 13 | 4(30.77) | 6(46.15) | 7(53.85) |
| C+D | 20 | 3(15.00) | 11(55.00) | 15(75.00) |
| P | >0.05 | >0.05 | >0.05 | |
Spearman相关分析显示, SFRP2表达与β-catenin膜表达缺失、异位表达均呈明显负相关(r = -0.452, P = 0.003; r = -0.519, P = 0.000, 表3); β-catenin膜表达缺失、异位表达间呈明显正相关(r = 0.782, P = 0.000, 表3).
| SFRP2表达 | β-catenin异位表达 | |||
| + | - | + | - | |
| β-catenin膜表达缺失 | ||||
| + | 2 | 20 | 22 | 0 |
| - | 10 | 10 | 5 | 15 |
| r = -0.452 | r = 0.782 | |||
| P = 0.003 | P = 0.000 | |||
| β-catenin异位表达 | ||||
| + | 3 | 24 | ||
| - | 9 | 6 | ||
| r = -0.519 | P = 0.000 | |||
Wnt/β-catenin信号转导通路在肿瘤的发生、发展、侵袭、转移中起着非常重要的作用[8], 其异常活化与肿瘤的发生、发展密切相关. 在成熟机体此通路是关闭的, 体内几乎没有Wnt信号, 绝大部分(约90%)的β-catenin都被束缚在E-钙粘素(E-cadherin, E-Cad)分子上形成β-catenin-E-cadherin复合体, 介导同型细胞间相互黏附. 胞质内极少量游离态的β-catenin与APC等结合形成"破坏复合体"被泛素-蛋白酶体系统(ubiquitin-proteasome systerm)降解. SFRP2含有与Wnt受体Frizzled(Fz)相似的半胱氨酸富集区(cysteine-rich domain, CRD), CRD是Wnt蛋白与Fz受体结合的区域, 这样SFRP2借CRD与Wnt蛋白结合阻止Wnt结合到Fz受体上, 或者与Fz受体形成无功能的复合物来封闭Wnt信号[9]. 肿瘤发生时该通路重要的拮抗剂SFRP2表达消失或减少使Wnt/β-catenin信号转导通路保持激活状态, 或通路中某成分突变(如APC或β-catenin突变), 致使β-catenin不能被降解而在胞质内积聚, 积聚的游离β-catenin可进入胞核与Tcf/Lef转录因子协调作用, 激活Wnt靶基因CyclinD1, c-myc等, 导致细胞增殖而发生癌变[10-12]. 近来有研究表明, β-catenin异常表达与结直肠癌、乳腺癌和胃癌等多种肿瘤发生有关[13-15]. Bafico et al[16]研究表明, SFRP2的表达沉默将很可能提供生长优势. 据Suzuki et al报道, 在大肠癌中频繁出现SFRP2启动子甲基化及表达沉默[17-19]. Huang et al报道, 在大肠癌、大肠腺瘤、增生性息肉和溃疡性结肠炎中SFRP2的甲基化率分别为94.2%、52.4%、37.5%和16.7%[20-21]. Qi et al[22]在对不同阶段结直肠癌SFRP2基因甲基化及表达的研究中发现, 正常大肠黏膜不存在SFRP2基因甲基化, 在结直肠腺癌、腺瘤、变性隐窝灶(ACF)中甲基化率分别为83.3%、81.8%和77.8%. SFRP2基因在ACF中已出现高频率甲基化, 可能导致其表达下调, 是结直肠肿瘤发生常见的早期事件. 本研究检测了大肠不同病变组织中SFRP2和β-catenin的表达, 结果显示, 在正常大肠黏膜→非腺瘤性息肉→腺瘤→大肠癌发展过程中, SFRP2表达逐渐减少, 而β-catenin的膜表达缺失及异位表达变得越来越明显. 大肠癌和大肠腺瘤组SFRP2阳性率分别为28.6%、36.1%显著低于正常大肠黏膜(100.0%)和非腺瘤性息肉组(95.0%, P<0.05), 与Qi et al[22]所测结直肠腺癌、腺瘤中SFRP2基因甲基化率83.3%、81.8%大致相符. 大肠癌和腺瘤组β-catenin异位表达率分别为64.3%、30.6%, 顾国利 et al[23]研究发现β-catenin在60例大肠癌中的异位表达率为66.7%(40/60), 这与我们的研究结果是基本一致的, 说明β-catenin在大肠癌中出现异位表达是很普遍的现象. 以上结果提示β-catenin从胞膜转位到胞质/胞核在大肠癌发生的早期就已经存在, 是大肠癌发生的一个早期事件.
本研究还发现SFRP2表达、β-catenin膜表达缺失及异位表达与患者的肿瘤部位、大体形态、肿瘤直径、淋巴结转移和Duke's分期无明显相关, 而与分化程度密切相关. SFRP2表达还与肿瘤的浸润深度相关. 马思平 et al[24]研究发现, β-catenin异常表达只与大肠癌分化程度呈负相关, 其异常表达越明显, 癌细胞分化越差. 顾国利 et al[23]研究发现β-catenin异位表达与肿瘤的侵犯深度和是否转移密切相关. 结果的差别考虑与患者的选择、免疫组化的方法、抗体的来源、免疫染色的判断标准等不同有关. Bànkfalvi et al[25]对乳腺癌研究发现, β-catenin主要在正常乳腺管腔及基底细胞、良性增生和腺管内早期肿瘤病灶有强阳性表达, 而在伴有淋巴转移的病灶表达明显下降. Brabletz et al[26]认为β-catenin胞核表达与大肠癌淋巴结转移及Duke's分期有关. 总的来说, 较多研究发现β-catenin的异常表达与肿瘤不良分化、分期增高、淋巴结及远隔转移有相关性. 这些分化不良、分期高、有转移的肿瘤趋向于一种向周围组织侵袭和脱离原发灶的潜能, 提示β-catenin异常表达与肿瘤侵袭和转移存在相关性. 这可能由于β-catenin从胞膜移位导致β-catenin-E-cadherin复合体解离, 使同型细胞间黏附能力下降, 从而增强了肿瘤细胞的转移能力[27]. 研究证实, 细胞间黏附的紊乱是肿瘤侵袭和转移到先决条件, 核内β-catenin高表达可使癌细胞具备上皮-间质转化(epithelial mesen-chymal transition, EMT)和干细胞形成的能力, 这两种能力可能导致肿瘤干细胞扩散, 进而导致肿瘤的侵袭与转移. 本研究显示, 大肠癌中SFRP2表达与β-catenin膜表达缺失、异位表达均呈明显负相关, β-catenin膜表达缺失与异位表达呈明显正相关. 提示SFRP2表达减低是β-catenin表达异常的重要前提.
总之, SFRP2和β-catenin的表达异常贯穿于大肠癌发生、发展的全过程. 因此, 检测SFRP2、β-catenin对大肠癌早期诊断和预后评估有重要的临床价值. 研究表明, 除粪便标本DNA突变分析和蛋白质分析外, SFRP2甲基化检测是早期诊断大肠癌的敏感方法之一[28-31]. Müller et al[28]发现SFRP2甲基化检测诊断大肠癌的敏感性和特异性分别为77%-99%和77%. 粪便SFRP2基因甲基化检测具有标本收集简便、无创的特点, 是早期诊断大肠癌的一种新策略. Elzagheid et al[32]和Suzuki et al[33]提出β-catenin胞核内异位可作为大肠癌预后评估及治疗模式选择的重要参考指标. 除此之外, Wnt信号转导通路可以作为大肠癌分子靶向治疗的潜在靶点[34-36], 一些非甾体抗炎药、植物类化合物、酪氨酸激酶抑制剂和血管生成抑制剂等能抑制Wnt/β-catenin信号转导通路过度激活, 这些都为大肠癌的治疗提供了新的思路.
大肠癌(CRC)是世界第三大常见的恶性肿瘤, 在欧美国家居恶性肿瘤死因的第二位. 但其发病机制尚不清楚. 研究证实Wnt/β-catenin信号通路在大肠癌的发生发展中起着重要的作用.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
针对Wnt/β-catenin信号通路的分子靶向治疗是目前研究热点、重点.
Suzuki报道在大肠癌中频繁出现SFRP2启动子甲基化, β-catenin胞核内异位可作为大肠癌预后评估及治疗模式选择的重要参考指标; Muller发现SFRP2甲基化检测诊断大肠癌的敏感性和特异性分别为77%-99%和77%.
本研究将SFRP2和β-catenin放在一起研究, 阐明了二者在大肠癌发生、发展中的相互作用及对大肠癌的影响.
针对Wnt/β-catenin信号通路的检测及分子靶向治疗是诊断、治疗大肠癌的一种新策略.
Wnt/β-catenin信号通路:"Wnt经典通路", 是Wnt信号通路中研究得最为深入的的一条分支. 他通过激活β-catenin在核内的功能来调节靶基因的表达水平, 影响细胞增殖、细胞存活和细胞命运.
本研究科研性较好, 希望作者能够采用更加深的方法来研究SFRP2和β-catenin在大肠癌和大肠腺癌群组中的不同表达.
编辑: 史景红 电编: 吴鹏朕
| 1. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA. Cancer J Clin. 2007;57:43-66. [PubMed] |
| 2. | Ferlay J, Autier P, Boniol M, Heanue M, Colombet M, Boyle P. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol. 2007;18:581-592. [PubMed] [DOI] |
| 4. | Giles RH, van Es JH, Clevers H. Caught up in a Wnt storm: Wnt signaling in cancer. Biochim Biophys Acta. 2003;1653:1-24. [PubMed] |
| 5. | Behrens J, Lustig B. The Wnt connection to tumorigenesis. Int J Dev Biol. 2004;48:477-487. [PubMed] [DOI] |
| 6. | 于 敏, 李 姝玉, 于 湛, 邱 雪杉, 侯 萍, 王 恩华, Pecker Iris. 肝素酶和碱性成纤维细胞生长因子与非小细胞肺癌转移和预后的关系. 中华病理学杂志. 2005;34:36-41. |
| 7. | Maruyama K, Ochiai A, Akimoto S, Nakamura S, Baba S, Moriya Y, Hirohashi S. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer. Oncology. 2000;59:302-309. [PubMed] [DOI] |
| 8. | Reya T, Clevers H. Wnt signalling in stem cells and cancer. Nature. 2005;434:843-850. [PubMed] [DOI] |
| 9. | Kawano Y, Kypta R. Secreted antagonists of the Wnt signalling pathway. J Cell Sci. 2003;116:2627-2634. [PubMed] [DOI] |
| 10. | Mazieres J, He B, You L, Xu Z, Jablons DM. Wnt signaling in lung cancer. Cancer Lett. 2005;222:1-10. [PubMed] [DOI] |
| 11. | Prasad CP, Gupta SD, Rath G, Ralhan R. Wnt signaling pathway in invasive ductal carcinoma of the breast: relationship between beta-catenin, dishevelled and cyclin D1 expression. Oncology. 2007;73:112-117. [PubMed] [DOI] |
| 12. | Ravindranath A, O'Connell A, Johnston PG, El-Tanani MK. The role of LEF/TCF factors in neoplastic transformation. Curr Mol Med. 2008;8:38-50. [PubMed] [DOI] |
| 13. | Kawasaki T, Nosho K, Ohnishi M, Suemoto Y, Kirkner GJ, Dehari R, Meyerhardt JA, Fuchs CS, Ogino S. Correlation of beta-catenin localization with cyclooxygenase-2 expression and CpG island methylator phenotype (CIMP) in colorectal cancer. Neoplasia. 2007;9:569-577. [PubMed] [DOI] |
| 14. | Zhang YG, DU J, Tian XX, Zhong YF, Fang WG. Expression of E-cadherin, beta-catenin, cathepsin D, gelatinases and their inhibitors in invasive ductal breast carcinomas. Chin Med J (Engl). 2007;120:1597-1605. [PubMed] |
| 15. | Udhayakumar G, Jayanthi V, Devaraj N, Devaraj H. Interaction of MUC1 with beta-catenin modulates the Wnt target gene cyclinD1 in H. pylori-induced gastric cancer. Mol Carcinog. 2007;46:807-817. [PubMed] [DOI] |
| 16. | Bafico A, Liu G, Goldin L, Harris V, Aaronson SA. An autocrine mechanism for constitutive Wnt pathway activation in human cancer cells. Cancer Cell. 2004;6:497-506. [PubMed] [DOI] |
| 17. | Suzuki H, Gabrielson E, Chen W, Anbazhagan R, van Engeland M, Weijenberg MP, Herman JG, Baylin SB. A genomic screen for genes upregulated by demethylation and histone deacetylase inhibition in human colorectal cancer. Nat Genet. 2002;31:141-149. [PubMed] [DOI] |
| 18. | Suzuki H, Watkins DN, Jair KW, Schuebel KE, Markowitz SD, Chen WD, Pretlow TP, Yang B, Akiyama Y, Van Engeland M. Epigenetic inactivation of SFRP genes allows constitutive WNT signaling in colorectal cancer. Nat Genet. 2004;36:417-422. [PubMed] [DOI] |
| 19. | Suzuki H, Toyota M, Nojima M, Mori M, Imai K. [SFRP, a family of new colorectal tumor suppressor candidate genes]. Nippon Rinsho. 2005;63:707-719. [PubMed] |
| 20. | Huang ZH, Li LH, Yang F, Wang JF. Detection of aberrant methylation in fecal DNA as a molecular screening tool for colorectal cancer and precancerous lesions. World J Gastroenterol. 2007;13:950-954. [PubMed] |
| 21. | Huang Z, Li L, Wang J. Hypermethylation of SFRP2 as a potential marker for stool-based detection of colorectal cancer and precancerous lesions. Dig Dis Sci. 2007;52:2287-2291. [PubMed] [DOI] |
| 22. | Qi J, Zhu YQ, Luo J, Tao WH. Hypermethylation and expression regulation of secreted frizzled-related protein genes in colorectal tumor. World J Gastroenterol. 2006;12:7113-7117. [PubMed] |
| 23. | 顾 国利, 魏 学明, 王 石林, 任 力, 郑 爱民, 黄 蓉蓉, 胡 益云. 大肠癌E-cadherin, β-catenin, MMP-7表达及其临床意义. 世界华人消化杂志. 2007;15:375-380. [DOI] |
| 25. | Bànkfalvi A, Terpe HJ, Breukelmann D, Bier B, Rempe D, Pschadka G, Krech R, Lellè RJ, Boecker W. Immunophenotypic and prognostic analysis of E-cadherin and beta-catenin expression during breast carcinogenesis and tumour progression: a comparative study with CD44. Histopathology. 1999;34:25-34. [PubMed] [DOI] |
| 26. | Brabletz T, Jung A, Kirchner T. Beta-catenin and the morphogenesis of colorectal cancer. Virchows Arch. 2002;441:1-11. [PubMed] [DOI] |
| 27. | Bonitsis N, Batistatou A, Karantima S, Charalabopoulos K. The role of cadherin/catenin complex in malignant melanoma. Exp Oncol. 2006;28:187-193. [PubMed] |
| 28. | Müller HM, Oberwalder M, Fiegl H, Morandell M, Goebel G, Zitt M, Mühlthaler M, Ofner D, Margreiter R, Widschwendter M. Methylation changes in faecal DNA: a marker for colorectal cancer screening? Lancet. 2004;363:1283-1285. [PubMed] [DOI] |
| 29. | Davies RJ, Freeman A, Morris LS, Bingham S, Dilworth S, Scott I, Laskey RA, Miller R, Coleman N. Analysis of minichromosome maintenance proteins as a novel method for detection of colorectal cancer in stool. Lancet. 2002;359:1917-1919. [PubMed] [DOI] |
| 30. | Wang DR, Tang D. Hypermethylated SFRP2 gene in fecal DNA is a high potential biomarker for colorectal cancer noninvasive screening. World J Gastroenterol. 2008;14:524-531. [PubMed] [DOI] |
| 31. | Oberwalder M, Zitt M, Wöntner C, Fiegl H, Goebel G, Zitt M, Köhle O, Mühlmann G, Ofner D, Margreiter R. SFRP2 methylation in fecal DNA--a marker for colorectal polyps. Int J Colorectal Dis. 2008;23:15-19. [PubMed] [DOI] |
| 32. | Elzagheid A, Buhmeida A, Korkeila E, Collan Y, Syrjanen K, Pyrhonen S. Nuclear beta-catenin expression as a prognostic factor in advanced colorectal carcinoma. World J Gastroenterol. 2008;14:3866-3871. [PubMed] [DOI] |
| 33. | Suzuki H, Masuda N, Shimura T, Araki K, Kobayashi T, Tsutsumi S, Asao T, Kuwano H. Nuclear beta-catenin expression at the invasive front and in the vessels predicts liver metastasis in colorectal carcinoma. Anticancer Res. 2008;28:1821-1830. [PubMed] |
| 34. | Paul S, Dey A. Wnt signaling and cancer development: therapeutic implication. Neoplasma. 2008;55:165-176. [PubMed] |
| 35. | Bordonaro M, Lazarova DL, Sartorelli AC. Hyperinduction of Wnt activity: a new paradigm for the treatment of colorectal cancer? Oncol Res. 2008;17:1-9. [PubMed] |
| 36. | Takemaru KI, Ohmitsu M, Li FQ. An oncogenic hub: beta-catenin as a molecular target for cancer therapeutics. Handb Exp Pharmacol. 2008;261-284. [PubMed] |