修回日期: 2008-11-07
接受日期: 2008-11-10
在线出版日期: 2008-12-08
目的: 初步研究多个大肠癌相关基因p53、malat1、ki-67和β-catenin在大肠癌分子诊断中的意义.
方法: 收集手术切除的新鲜大肠癌组织标本47例、大肠腺瘤组织标本13例, 以及分别和大肠癌、大肠腺瘤对应的正常大肠黏膜组织标本53例, 用实时荧光定量RT-PCR方法检测各基因的Ct值.
结果: p53、malat1在大肠癌组表达量均高于大肠腺瘤组(P = 0.026, P = 0.034), 但是p53在正常大肠黏膜组、大肠腺瘤组和大肠癌组中表达依次增高, 而malat1在大肠腺瘤组、正常大肠黏膜组和大肠癌组中表达量依次增高, 大肠腺瘤组mRNA表达最低. ki-67在大肠癌组的表达量是正常黏膜组表达量的1.42倍(P = 0.007). β-catenin基因在三组间的表达差异无统计学意义. 各基因的表达量均和大肠癌的分期无关. 经ROC曲线分析, p53的曲线下面积是0.755(P<0.05), 在大肠腺瘤组和大肠癌组的最佳Cut-off值分别是2.585、3.215, malat1的曲线下面积是0.748(P<0.05), 在大肠腺瘤组和大肠癌组的最佳Cut-off值分别是0.925、1.395; 二元Logistic回归分析, p53和malat1进入回归模型(P<0.05). 联合检测p53和malat1在大肠腺瘤组和大肠癌组的ROC曲线下面积为0.785(P = 0.01), 在大肠腺瘤组的和大肠癌组的最佳Cut-off值分别是0.750、0.790. p53和malat1联合检测的ROC曲线下面积均高于单独检测的ROC曲线下面积.
结论: p53和malat1在大肠癌的分子诊断中有一定的应用价值, 可为鉴别大肠腺瘤和大肠癌提供有效的参考; 和单独检测相比, 二者联和检测的准确性高于单独检测的准确性.
引文著录: 常建兰, 李祖国, 王晓燕, 杨敏慧. p53、malat1、ki-67和β-catenin基因mRNA检测在大肠癌分子诊断中的意义. 世界华人消化杂志 2008; 16(34): 3849-3854
Revised: November 7, 2008
Accepted: November 10, 2008
Published online: December 8, 2008
AIM: To detect p53, malat1, ki-67 and β-catenin mRNA expression in colorectal carcinoma and to evaluate its significance in molecular diagnosis of colorectal carcinoma.
METHODS: Real-time RT-PCR was used to detect p53, malat1, ki-67 and β-catenin mRNA expression in samples from 47 colorectal carcinomas, 13 colorectal adenomas and 53 normal colorectal tissues.
RESULTS: The expression levels of p53 and malat1 were significantly different between colorectal carcinoma, colorectal adenoma and normal colorectal tissue (P < 0.05). p53 expression levels showed an average 1.61-fold (P = 0.000) and 2.62-fold (P = 0.000) increase in colorectal adenoma and colorectal carcinoma tissues when compared with normal colorectal tissues respectively, and 1.77-fold (P = 0.026) increase in colorectal carcinoma compared with colorectal adenoma. Similarly, malat1 expression levels were 0.55-fold (P = 0.001), 1.48-fold (P = 0.002) and 1.78-fold (P = 0.034) respectively. However, there were no significant differences among colorectal carcinoma, colorectal adenoma and normal colorectal tissues in ki-67 and β-catenin. The expression levels of p53, malat1, ki-67 and β-catenin mRNA were not associated with the staging of colorectal carcinoma. The AUC (area under curve) of p53 and malat1 were 0.755 and 0.748, respectively. The cut-off value for p53 in colorectal adenoma and colorectal carcinoma was 2.582 and 3.215 respectively; for malat1, 0.925, 1.395 respectively. Logistic regression analysis showed that p53 and malat1 entered the regression equation (P < 0.05). The combined determination showed, the AUC were 0.785, the cut-off values in colorectal adenoma and colorectal carcinoma were 0.750, 0.790 respectively. Thus, the AUC of combined determination was larger than that of single detection for p53 and malat1.
CONCLUSION: The present study demonstrates that p53 and malat1 have certain application value in molecular diagnosis of colorectal carcinoma to identify colorectal carcinoma and colorectal adenoma. Furthermore, the accuracy in diagnosis of colorectal cancer is improved by combined assaying of p53 and malat1.
- Citation: Chang JL, Li ZG, Wang XY, Yang MH. Detection of p53, malat1, ki-67 and β-catenin mRNA expression and its significance in molecular diagnosis of colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(34): 3849-3854
- URL: https://www.wjgnet.com/1009-3079/full/v16/i34/3849.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i34.3849
大肠癌是一种常见恶性肿瘤, 随着生活水平的提高, 生活习惯的改变, 大肠癌的发病有逐年增高的趋势, 大肠癌的病死率在美国上升到恶性肿瘤死亡率的第三位, 在中国上升到恶性肿瘤死亡率的第五位[1]. 尽管近些年临床对大肠癌的诊治水平有明显提高, 但手术仍旧是主要的治疗方法, 若早期发现并进行手术治疗, 可以大大提高肿瘤患者的生存率[2], 因此治疗癌症的关键是早期诊断.
目前已证实有许多癌基因和抑癌基因如p53、malat1、ki-67和β-catenin等在大肠癌发病过程中表达量发生显著的变化, 对这些相关基因表达量进行定量分析, 分析其在大肠癌变过程中基因表达量的变化, 有可能揭示大肠癌相关基因量变和癌变发生的规律, 从而可以确立大肠癌分子诊断的标志物及分子诊断标准. 本研究运用实时荧光定量RT-PCR技术, 对大肠癌相关基因p53、malat1、ki-67和β-catenin分别在正常大肠黏膜、大肠腺瘤和大肠癌mRNA的表达量进行了检测, 进而分析他们在大肠癌分子诊断中的意义.
1.1.1 标本采集: 收集正常大肠黏膜、大肠腺瘤和大肠癌的手术后新鲜组织标本, 每个标本收集相同的2份, 其中1份切成5 mm3的小块, 立即保存在液氮中备用, 1份做常规的病理诊断(经3位资深的专家确诊); 选择其中诊断为大肠癌, 大肠腺瘤及正常大肠黏膜的标本作为本实验的研究对象. 收集2007-06/2007-12南方医院普外科手术切除的新鲜大肠癌组织标本47例为大肠癌组, 男31例, 女16例, 平均年龄57.0±14.2岁, 大肠腺瘤组织标本13例为大肠腺瘤组, 男9例, 女4例, 平均年龄55.8±18.7岁, 分别取和大肠癌以及大肠腺瘤对应的正常大肠黏膜组织53例为正常黏膜组, 男32例, 女21例, 平均年龄56.2±15.3岁; 其中47例大肠癌患者中早期和中晚期患者[3]分别占17.0%(8/47)、83.0%(39/47). 手术前均未接收化疗.
1.1.2 主要试剂与仪器: TRIzol(购自Invitrogen公司), SYBR PrimeScript Real Time RT-PCR kit(购自大连TaKaRa生物工程公司), MX3000p定量PCR仪(购自Stratagene公司).
1.2.1 引物设计与合成: 登陆GenBank获得各个基因的mRNA序列, 利用Primer Premier 5.0软件设计特异性引物, 并使上下游引物跨越2个内含子, 以避免基因组DNA的污染, 引物均由上海英俊生物有限公司合成(引物序列见表1).
| 基因 | GenBank索取号 | 上、下游链 | 引物序列(5'-3') | 产物长度(bp) |
| β-actin | NM_001101 | 上游 | ACTCGTCATACTCCTGCT | 255 |
| 下游 | GAAACTACCTTCAACTCC | |||
| β-catenin | NM_001098209 | 上游 | ATGGCTTGGAATGAGAC | 189 |
| 下游 | AACTGGATAGTCAGCACC | |||
| p53 | NM_000546 | 上游 | CCACCATCCACTACAACTACAT | 146 |
| 下游 | AGGACAGGCACAAACACG | |||
| ki-67 | NM_002417 | 上游 | GGGTTACCTGGTCTTAGTT | 244 |
| 下游 | ATGGTTGAGGCTGTTCC | |||
| malat1 | NR_002819 | 上游 | GAAGATAGGCATTTGAGTGGCT | 136 |
| 下游 | CTGAAGAGCATTGGAGATCAGC |
1.2.2 RNA提取及cDNA合成: 提取每份组织标本的总RNA, 所有标本通过光密度分析结果260 nm/280 nm的比值在1.9-2.1之间, RNA电泳出现28S、18S与5S三条带, 取RNA 2 µL, 逆转录成cDNA 20 µL, 反应体系包括: 5×PrimeScriptTM Buffer 4 µL, PrimeScriptTM RT Enzyme MixⅠ 1 µL, Oligo dT Primer(50 µmol/L)1 µL, Random 6 mers(100 µmol/L) 1 µL, Total RNA 2 µL, RNase Free dH2O 11 µL. 反应条件为: 37 ℃ 15 min, 85 ℃ 5 s.
1.2.3 实时荧光定量PCR: 反应体系包括: SYBR@ Premix Ex TaqTM(2×) 10.0 µL, PCR Forward Primer(10 µmol/L) 0.8 µL, PCR Reverse Primer(10 µmol/L) 0.8 µL, cDNA 2 µL, dH2O 6.4 µL. 反应条件为: 95 ℃ 5 min 变性, 95 ℃ 10 s, 58 ℃ 20 s, 72 ℃ 5 s, 40个循环. 扩增完毕后, 进行溶解曲线分析.
1.2.4 基因mRNA表达水平相对定量分析: 应用MX3000p定量PCR仪, 以β-actin为内参, 进行Real-time RT-PCR扩增, 检测各模板的Ct值. 通过Ct值进行相对定量, 实验组和对照组的基因表达相对定量用2-ΔΔCt表示, 即2-ΔΔCt值表示实验组(大肠癌组、大肠腺瘤组)和正常对照组(正常黏膜组)目的基因表达的倍数关系. 其中ΔΔCt = ΔCt (实验组)-ΔCt(对照组), ΔCt = Ct(目的基因)-Ct(内参基因).
统计学处理 对p53、malat1、ki-67和β-catenin在正常黏膜组、大肠腺瘤组和大肠癌组3组间及组间的两两比较进行Kruskal-Wallis检验; 用ROC曲线分析评价各基因在大肠腺瘤和大肠癌诊断中的价值, 找出适宜的临界点值; 对大肠腺瘤组和大肠癌组进行Logistic回归分析; 以上统计均使用统计软件SPSS13.0. 用Excel分别绘制有意义基因p53、malat1及二者联合检测在大肠腺瘤组和大肠癌组的ROC曲线.
p53、ki-67和malat1基因在正常黏膜组、大肠腺瘤组和大肠癌组的表达均具有统计学意义(P<0.05); β-catenin基因在3组间的表达无统计学意义. p53和ki-67在大肠腺瘤组和大肠癌组表达均上调, malat1在大肠腺瘤组表达下调而在大肠癌组表达上调(表2).p53在大肠腺瘤组的表达量是正常黏膜组表达量的1.61倍(P = 0.000), 在大肠癌组的表达量是正常黏膜组表达量的2.62倍(P = 0.000), 在大肠癌组的表达量是大肠腺瘤组表达量的1.77倍(P = 0.026); malat1在大肠腺瘤组的表达量是正常黏膜组表达量的0.55倍(P = 0.001), 在大肠癌组的表达量是正常黏膜组表达量的1.48倍(P = 0.002), 在大肠癌组的表达量是大肠腺瘤组表达量的1.78倍(P = 0.034); ki-67在大肠癌组的表达量是正常黏膜组表达量的1.42倍(P = 0.007), 在正常黏膜组和大肠腺瘤组及大肠腺瘤组和大肠癌组差异无统计学意义(表3). p53、malat1、ki-67和β-catenin中有意义基因p53、malat1在大肠癌组的表达量均和大肠癌的分期无关(P>0.05, 表4).
| 基因 | 正常黏膜组(平均秩) | 大肠腺瘤组(平均秩) | 大肠癌组(平均秩) | P值 |
| β-catenin | 38.50 | 36.39 | 41.44 | 0.766 |
| p53 | 20.50 | 38.89 | 55.29 | 0.000 |
| ki-67 | 32.50 | 37.00 | 45.90 | 0.031 |
| malat1 | 32.50 | 20.75 | 47.07 | 0.001 |
| 分组 | 正常黏膜组(平均秩) | 大肠腺瘤组(平均秩) | P值 | 正常黏膜组(平均秩) | 大肠癌组(平均秩) | P值 | 大肠腺瘤组(平均秩) | 大肠癌组(平均秩) | P值 |
| p53 | 20.50 | 33.00 | 0.000 | 18.50 | 48.50 | 0.000 | 10.89 | 19.29 | 0.026 |
| ki-67 | 22.50 | 25.00 | 0.465 | 28.50 | 40.39 | 0.007 | 16.94 | 21.53 | 0.300 |
| malat1 | 24.50 | 13.50 | 0.001 | 26.50 | 39.33 | 0.002 | 11.81 | 20.98 | 0.034 |
| 基因 | 早期大肠癌组(平均秩) | 中晚期大肠癌组(平均秩) | P值 |
| p53 | 9.13 | 14.19 | 0.098 |
| malat1 | 9.75 | 15.79 | 0.071 |
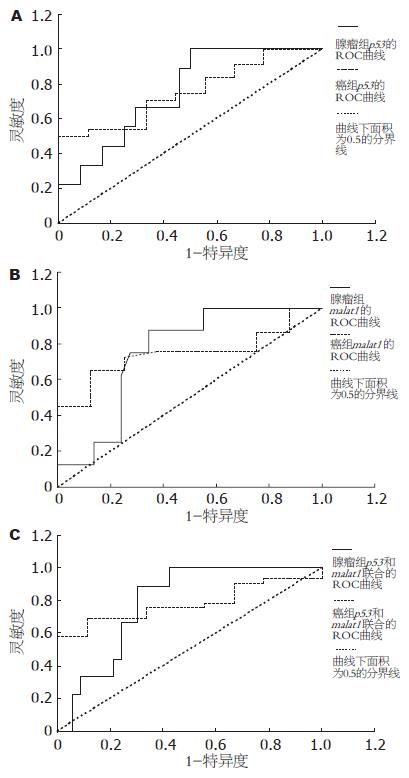
对于鉴别大肠腺瘤和大肠癌, p53、malat1和ki-67的ROC曲线下面积(AUC)见表5. p53的ROC曲线下面积为0.755, p53在大肠腺瘤组的最佳Cut-off值取2.585, 敏感性为70.8%, 特异性为66.7%, p53在大肠癌组的最佳Cut-off值取3.215, 敏感性为88.9%, 特异性为54.2%(图1A); malat1的ROC曲线下面积为0.748, 在大肠腺瘤组的最佳Cut-off值取0.925, 敏感性为72.4%, 特异性为75.0%, malat1在大肠癌组的最佳Cut-off值取1.395, 敏感性为87.5%, 特异性为65.5%(图1B). ki-67的ROC曲线下面积无统计学意义. 二元Logistic回归分析, p53和malat1进入回归模型(P<0.05). 联合检测p53和malat1在大肠腺瘤组和大肠癌组的ROC曲线下面积为0.785(P = 0.01), 在大肠腺瘤组的最佳Cut-off值取0.750, 敏感性为66.7%, 特异性为75.8%, 在大肠癌组的最佳Cut-off值取0.790,敏感性为66.7%, 特异性为88.9%(图1C).
| 基因 | AUC | SE | 95%CI | P值 |
| p53 | 0.755 | 0.087 | 0.585-0.924 | 0.026 |
| malat1 | 0.748 | 0.083 | 0.586-0.910 | 0.034 |
| ki-67 | 0.615 | 0.093 | 0.433-0.796 | 0.300 |
大肠癌发生是涉及多步骤, 多基因改变的过程. 几乎所有大肠癌都是由正常肠上皮细胞发展成息肉样腺瘤, 然后在腺瘤的基础上发展而来的, 符合大肠腺瘤-不典型增生-癌的发展规律[4]. 大肠癌发病过程的不同阶段, 同时涉及多个基因表达量的变化. 研究表明, 89%的高分化腺癌在其侵袭前的肿瘤细胞中核内β-catenin表达增加, 同时伴有一定程度的胞内β-catenin弥漫表达[5], β-catenin蛋白表达异常可能是大肠腺瘤癌变的重要环节[6]. 野生型p53可以诱导细胞凋亡, 目前的研究已充分证实p53在大肠癌发生发展中的重要作用[7], 他在大肠从腺瘤到癌变的过程中发生突变[8], 在大多数腺瘤中过表达[4]. ki-67在正常肠黏膜组织中, 表达弱而有规律, 多集中在肠腺基底部的增殖区细胞核内; 在癌旁黏膜组织中, 表达增强, 黏膜上皮增殖活性升高, 并出现增殖带上移现象; 而在大肠癌细胞中, ki-67表达明显增多[9]. malat1是新发现的高度保守的非编码RNA, 在结肠组织中表达, 目前的研究证明他和癌的转移高度相关[10], 可以作为肿瘤诊断的分子标记物[11].
本研究通过检测p53、malat1、ki-67和β-catenin分别在正常黏膜组、大肠腺瘤组和大肠癌组mRNA的表达, 统计分析结果表明: p53在大肠腺瘤组的表达量是正常黏膜组表达量的1.61倍, 在大肠癌组的表达量是正常黏膜组表达量的2.62倍, 在大肠癌组的表达量是大肠腺瘤组表达量的1.77倍; malat1在大肠腺瘤组的表达量是正常黏膜组表达量的0.55倍, 在大肠癌组的表达量是正常黏膜组表达量的1.48倍, 在大肠癌组的表达量是大肠腺瘤组表达量的1.78倍; ki-67在大肠癌组的表达量是正常黏膜组表达量的1.42倍, 在正常黏膜组和大肠腺瘤组及大肠腺瘤组和大肠癌组的表达差异无统计学意义; β-catenin在3组中的表达差异无统计学意义. 4个基因p53、malat1、ki-67和β-catenin中, 其中有意义基因p53、malat1在大肠癌组的表达量均和大肠癌的分期无关. p53和malat1在正常黏膜组、大肠腺瘤组和大肠癌组mRNA的表达量均不同(P<0.05), 二者可能作为大肠癌的分子诊断标志物.
ROC曲线是肿瘤标志物临床应用中一种全面、准确评价诊断试验非常有效的方法. ROC曲线以良、恶性疾病为研究对象, 是敏感性和特异性的综合反映, 曲线下面积能较好反映一个诊断试验的诊断能力, 并能确定最佳临界值[12-15]. 根据Swets报道, 面积在0.5以下时无诊断价值; 面积在(0.5-0.7)时有较低的准确性; 面积在(0.7-0.9)时有较高的准确性; 面积在0.9以上时准确性最高[16]. Logistic回归分析可用来衡量联合分析的价值大小[14,17-19], 因此本文采用回归分析方法对有意义的p53和malat1基因进行了联合分析.
本文通过SPSS13.0统计软件分析, 利用Excel绘制ROC曲线, 并比较不同基因曲线下面积大小, 同时按照曲线下面积最大原则提供最佳临界值, 以区别良、恶性疾病[20]. 对于鉴别大肠腺瘤和大肠癌, p53的曲线下面积是0.755(P<0.05), 在大肠腺瘤组的最佳Cut-off值取2.585, 敏感性为70.8%, 特异性为66.7%, 在大肠癌组的最佳Cut-off值取3.215, 敏感性为88.9%, 特异性为54.2%;malat1的曲线下面积是0.748(P<0.05), 在大肠腺瘤组的最佳Cut-off值取0.925, 敏感性为72.4%, 特异性为75.0%, 在大肠癌组的最佳Cut-off值取1.395, 敏感性为87.5%, 特异性为65.5%. ki-67和β-catenin的ROC曲线下面积无统计学意义. p53和malat1的曲线下面积均大于0.7, 对大肠腺瘤和大肠癌的诊断有较高的准确性, 可用于大肠腺瘤和大肠癌的鉴别诊断中. 而且p53的曲线下面积大于malat1的曲线下面积, 所以就单一肿瘤标志物鉴别大肠腺瘤和大肠癌的能力而言, p53要优于malat1.
联合检测p53和malat1在大肠腺瘤组和大肠癌组的ROC曲线下面积为0.785(P = 0.01), 在大肠腺瘤组的最佳Cut-off值取0.750, 敏感性为66.7%, 特异性为75.8%, 在大肠癌组的最佳Cut-off值取0.790, 敏感性为66.7%, 特异性为88.9%. 和单独检测相比, p53和malat1联合检测的曲线下面积大于单独检测的曲线下面积, 表明p53和malat1联合检测的效果优于单独检测.
大肠癌是严重威胁着人类健康的疾病之一. 肿瘤治疗方案的确定依赖于对患者病情的准确诊断. 病理组织活检和免疫组化是常用的肿瘤诊断方法, 免疫组化法检测的对象是与肿瘤相关的蛋白, 而样本处理方式对蛋白的稳定性影响很大, 因此免疫组化的检测结果的稳定性受到一定的影响. 检测组织特异标志物的mRNA比病理学、免疫组化等方法有几个优点: (1)RNA 在细胞外环境中是很不稳定的, 因此检测到标志物mRNA应当表示所检测的组织或体液中有肿瘤细胞; PCR检测法已达到检测单个分子的能力, 而其他方法还达不到; (2)在免疫组化等方法结果为阴性时, 仍可用组织特异性标志物的mRNA检测来表明肿瘤细胞的存在[21]. 分子诊断灵敏度高, 特异性强, 需要的组织标本少.
分子诊断技术是具有划时代意义的检测手段, 分子病理诊断是将来病理诊断不可缺少重要指标, 分子病理诊断研究拓宽了医学研究的范围[22], 但本研究设计属于诊断试验准确度评价的初步"探索"阶段[12], 用于临床之前尚需要大量的后续研究来进行证实和完善.
大肠癌是一种常见恶性肿瘤, 发病率和死亡率有逐年增高的趋势, 早期诊断、准确的诊断对大肠癌的治疗和预后判断都有重要的指导意义.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科; 蔡开琳, 副教授, 华中科技大学同济医学院附属协和医院普通外科
目前尚未见关于大肠癌多个标志基因mRNA表达在腺瘤与癌病理早期鉴别诊断中的研究, 如果制定正常大肠黏膜、大肠腺瘤与大肠癌的基因分子诊断标准, 将有助于病理医师做出准确的诊断, 有助于临床医生选择合理的治疗方案.
Dominique Desvaux et al用Real-time PCR方法证明肾脏急性排斥反应中几个基因在分子诊断中的意义.
本文初步制定适合临床应用的正常大肠黏膜、大肠腺瘤与大肠癌的分子诊断标准, 减少大肠癌诊断中的主观性误差, 增加客观指标, 更好地为临床医生治疗肿瘤提供指导.
该文证实了大肠癌相关基因p53、malat1在大肠癌分子诊断的应用价值, 为大肠癌与大肠腺瘤的鉴别诊断提供一定的实验依据, 对临床工作有一定参考价值.
编辑: 史景红 电编: 吴鹏朕
| 2. | Wilkinson N, Scott-Conner CE. Surgical therapy for colorectal adenocarcinoma. Gastroenterol Clin North Am. 2008;37:253-267, ix. [PubMed] [DOI] |
| 3. | 陈 杰, 李 甘地. 病理学. 第1版. 北京: 人民卫生出版社 2005; 274. |
| 4. | Rubio CA, Rodensjö M. p53 overexpression in flat serrated adenomas and flat tubular adenomas of the colorectal mucosa. J Cancer Res Clin Oncol. 1995;121:571-576. [PubMed] [DOI] |
| 5. | Brabletz T, Jung A, Reu S, Porzner M, Hlubek F, Kunz-Schughart LA, Knuechel R, Kirchner T. Variable beta-catenin expression in colorectal cancers indicates tumor progression driven by the tumor environment. Proc Natl Acad Sci USA. 2001;98:10356-10361. [PubMed] [DOI] |
| 8. | Sheikh RA, Min BH, Yasmeen S, Teplitz R, Tesluk H, Ruebner BH, Tobi M, Hatfield J, Fligiel S, Lawson MJ. Correlation of Ki-67, p53, and Adnab-9 immunohistochemical staining and ploidy with clinical and histopathologic features of severely dysplastic colorectal adenomas. Dig Dis Sci. 2003;48:223-229. [PubMed] [DOI] |
| 10. | Ji P, Diederichs S, Wang W, Böing S, Metzger R, Schneider PM, Tidow N, Brandt B, Buerger H, Bulk E. MALAT-1, a novel noncoding RNA, and thymosin beta4 predict metastasis and survival in early-stage non-small cell lung cancer. Oncogene. 2003;22:8031-8041. [PubMed] [DOI] |
| 11. | Lin R, Maeda S, Liu C, Karin M, Edgington TS. A large noncoding RNA is a marker for murine hepatocellular carcinomas and a spectrum of human carcinomas. Oncogene. 2007;26:851-858. [PubMed] [DOI] |
| 12. | Zhou XH, Obuchowshi NA, McClish DK, 宇 传华. 诊断医学统计学. 第1版. 北京: 人民卫生出版社 2005; 31. |
| 14. | Rai AJ, Zhang Z, Rosenzweig J, Shih IeM, Pham T, Fung ET, Sokoll LJ, Chan DW. Proteomic approaches to tumor marker discovery. Arch Pathol Lab Med. 2002;126:1518-1526. [PubMed] |
| 15. | Rasouli M, Okhovatian A, Enderami A. Serum proteins profile as an indicator of malignancy: multivariate logistic regression and ROC analyses. Clin Chem Lab Med. 2005;43:913-918. [PubMed] [DOI] |
| 17. | 李 招云, 戴 岳楚, 张 黎明, 吴 晓宇. 荧光定量PCR检测大肠癌患者外周血CK19mRNA、CK20mRNA和CEAmRNA的意义. 中国实验诊断学. 2006;10:1179-1181. |
| 18. | Schutter EM, Davelaar EM, van Kamp GJ, Verstraeten RA, Kenemans P, Verheijen RH. The differential diagnostic potential of a panel of tumor markers (CA 125, CA 15-3, and CA 72-4 antigens) in patients with a pelvic mass. Am J Obstet Gynecol. 2002;187:385-392. [PubMed] [DOI] |