修回日期: 2008-10-30
接受日期: 2008-11-03
在线出版日期: 2008-12-08
目的: 探讨Dukes D期直肠癌的转移分布、预后及治疗策略.
方法: 收集1979-05/2003-08我院诊断为Dukes D直肠癌并行手术干预治疗的患者301例, 运用Log-rank和Kapla-Meier检测方法回顾性分析患者临床病理资料, 直肠癌的类型分布及预后.
结果: Dukes D期直肠癌患者平均生存32.50±3.22 mo, 1、3、5年整体生存率为64.61%、26.40%和15.15%; 肿瘤的大体类型、组织类型、浸润深度和手术方式影响患者的预后; 行单纯造瘘的病例占32.56%, 姑息性手术的病例占67.44%, 且行姑息性手术者生存显著获益(P = 0.0158); 伴有腹膜种植的病例占10.29%, 伴有局部浸润的病例占32.55%, 伴有远处转移的病例占40.53%, 术中伴有复合转移(合并两种或两种以上转移类型)的病例占16.61%, 其预后无差异(P = 0.4122); 发生肝转移的病例占所有病例的51.4%, 占所有远处转移患者的84.23%, 平均生存时间为32.50±3.22 mo, 行根治术者的生存时间相对较长.
结论: Dukes D期直肠癌中, 各种转移类型的病例预后无差异, 手术切除原发灶可助患者生存获益.
引文著录: 王轶慧, 刘彦龙, 赵旭海, 姜世雄, 孙喜文, 王锡山. Dukes D期直肠癌的预后分析及治疗策略. 世界华人消化杂志 2008; 16(34): 3844-3848
Revised: October 30, 2008
Accepted: November 3, 2008
Published online: December 8, 2008
AIM: To evaluate the metastasis distribution, prognosis and treatment strategy for patients with Dukes D stage rectal cancer.
METHODS: Clinical data, type distribution and prognosis of 301 cases with Dukes D stage rectal cancer who underwent surgery from May 1991 to August 2003 were retrospectively analyzed using Log-rank and Kapla-Meier test.
RESULTS: The patients with Dukes D stage were associated with a mean OS (overall survival) of 32.50 ± 3.22 months, and OS rate were 64.61% (1 year), 26.40% (3 years) and 15.15% (5 years), respectively. The prognosis was related to factors such as gross type, tumor differentiation, T stage and surgery type. 32.56% patients underwent side-side anastomosis and no primary-cancer-directed surgery, and 67.44% patients underwent primary-cancer-directed surgery. Patients had significantly benefited from palliative resection in terms of overall survival (P = 0.0158). The patients with Dukes D stage were 10.29% with peritoneal carcinomatosis, 32.55% with local infiltration, 40.53% with distant metastasis, and 16.61% with complex metastasis. The prognosis among metastasis type was not significantly different (P = 0.4122). Patients with synchronous liver metastases accounted for 51.4% of all cases, and 84.23% for distant metastasis, which had a mean OS of 32.50 ± 3.22 months and had relatively longer life expectancy.
CONCLUSION: Patients of Dukes D stage rectal cancer show no significant difference regardless of metastasis type, and primary-cancer-directed surgery should be actively performed and the postoperative OS rate and quality of life can be improved.
- Citation: Wang YH, Liu YL, Zhao XH, Jiang SX, Sun XW, Wang XS. Prognosis analysis and treatment strategy for patients with Dukes D stage rectal cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(34): 3844-3848
- URL: https://www.wjgnet.com/1009-3079/full/v16/i34/3844.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i34.3844
大肠癌是一种常见的恶性肿瘤, 起病隐匿, 出现临床症状已属晚期, 部分患者已发生远处转移. 有资料显示在所有的结直肠癌患者中, Dukes D期患者大约占20%, 其中仅有大约15%-30%的患者可行根治性切除[1]. 当前, 如何合理处理Dukes D期直肠癌一直是学术界讨论的热点和难点[2]. 本文总结分析我院24年收治的Dukes D直肠癌患者, 旨在了解Dukes D期直肠癌的临床病例资料特点及预后差异, 为制定合理的治疗方案和预后进行指导.
收集1979-05/2003-08在我院住院诊断为Dukes D直肠癌,并且行手术干预治疗的患者301 例. 其中男187例, 女114例; 年龄16-83(平均50.6)岁, 其中≤60岁者214例, >60岁者87例; 病灶位于腹膜返折以上的病例180例, 腹膜返折以下者121例; 手术行Miles者107例, Dixon者63例, Hartmann者33例, 单纯造瘘者98例; 术后病理报告是高中分化腺癌者222例, 黏液腺癌者67例, 印戒细胞癌者12例; 大体类型为增殖型者55例, 溃疡型者84例, 浸润型者63例, 资料缺失者99例; 浸润深度T中包括T1者1例, T2者38例, T3者48例, T4者214例. 每位患者均有完整的随访纪录.
统计学处理 汇总Dukes D期直肠癌患者的临床病理资料, 分析Dukes D期直肠癌的类型分布及预后特点, 其中单因素生存率计算用寿Kapla-Meier法, 组间的生存率比较用Log-rank检验. 所有处理均采用SPSS11.5统计软件包.
在所有的临床病理资料中, 肿瘤的大体类型、组织类型、浸润深度和手术方式影响患者的预后. 其中, 肿瘤大体类型为浸润型、肿瘤侵破浆膜层、组织类型为低分化和黏液腺癌以及行单纯造瘘术的患者的预后最差. 行单纯造瘘的病例占32.56%(98/301), 姑息性手术的病例占67.44%(203/301), 且行姑息性手术者生存显著获益(P = 0.0158). Dukes D期直肠癌患者平均生存32.50±3.22 mo, 1、3、5年生存率为64.61%、26.40%和15.15%(表1).
| 分组 | n | 1年整体生存率 | 3年整体生存率 | 5年整体生存率 | 平均生存时间(mo) | 时序检验值 | P值 |
| 年龄 | 0.58 | 0.4475 | |||||
| ≤60 | 214 | 0.6253±.0340 | 0.226±0.0322 | 0.108±0.0265 | 31.0±3.24 | ||
| >60 | 87 | 0.667±0.0514 | 0.302±0.0534 | 0.240±0.0532 | 34.4±4.50 | ||
| 性别 | 0.49 | 0.4845 | |||||
| 男 | 187 | 0.596±0.0369 | 0.231±0.0344 | 0.146±0.0316 | 30.6±3.12 | ||
| 女 | 114 | 0.703±0.0434 | 0.280±0.0462 | 0.148±0.0406 | 34.1±4.67 | ||
| 原发灶部位 | 0.01 | 0.9145 | |||||
| 腹膜返折上 | 180 | 0.583±0.0374 | 0.271±0.0355 | 0.167±0.0325 | 33.9±3.84 | ||
| 腹膜返折下 | 121 | 0.722±0.0419 | 0.209±0.0434 | 0.106±0.0374 | 28.3±2.76 | ||
| 大体类型 | 9.93 | 0.0191 | |||||
| 增殖型 | 55 | 0.652±0.0645 | 0.380±0.0693 | 0.256±0.0700 | 40.9±6.70 | ||
| 溃疡型 | 84 | 0.779±0.0459 | 0.289±0.0541 | 0.144±0.0451 | 36.2±4.78 | ||
| 浸润型 | 63 | 0.571±0.0641 | 0.191±0.0583 | 0.152±0.0579 | 26.4±4.39 | ||
| 缺失组 | 99 | 0.546±0.0521 | 0.174±0.0430 | 0.095±0.0357 | 27.2±5.20 | ||
| 组织类型 | 5.57 | 0.0618 | |||||
| 高-中分化腺癌 | 222 | 0.682±0.0320 | 0.271±0.0334 | 0.169±0.0307 | 34.0±2.98 | ||
| 低分化腺癌 | 67 | 0.522±0.0622 | 0.182±0.0506 | 0.075±0.0382 | 25.8±5.58 | ||
| 黏液腺癌 | 12 | 0.420±0.1763 | 0 | 0 | 17.7±5.27 | ||
| 浸润深度 | 25.37 | 0.0000 | |||||
| T1 | 1 | 0 | 0 | 0 | 5.00±0.00 | ||
| T2 | 38 | 0.789±0.0661 | 0.445±0.0838 | 0.287±0.0837 | 43.9±7.23 | ||
| T3 | 48 | 0.787±0.0596 | 0.364±0.0720 | 0.253±0.0682 | 51.3±9.16 | ||
| T4 | 214 | 0.593±0.0348 | 0.179±0.0312 | 0.084±0.0258 | 24.3±2.31 | ||
| 手术方式 | 11.74 | 0.0194 | |||||
| Miles | 107 | 0.625±0.0489 | 0.348±0.0506 | 0.266±0.0504 | 42.3±6.16 | ||
| Dixon | 63 | 0.739±0.0578 | 0.244±0.0624 | 0.104±0.0529 | 31.0±4.18 | ||
| Hartmann | 33 | 0.776±0.0806 | 0.252±0.0954 | 0.126±0.0791 | 34.5±7.15 | ||
| 单纯造瘘 | 98 | 0.541±0.0525 | 0.164±0.0425 | 0.082±0.0343 | 22.9±3.47 | ||
| 手术性质 | 1.21 | 0.2720 | |||||
| R0 | 7 | 0.714±0.1707 | 0.476±0.2253 | 0.238±0.2026 | 56.3±28.0 | ||
| R1 | 294 | 0.636±0.0287 | 0.244±0.0278 | 0.143±0.0250 | 31.3±2.62 |
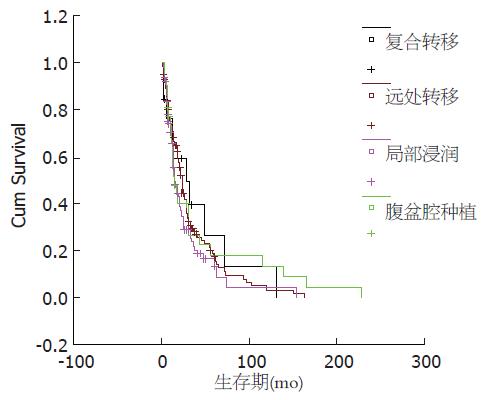
在301例病例中, 术中发现伴有单纯腹膜种植的病例占10.29%(31/301), 平均生存期为43.76±12.17 mo; 术中伴有单纯局部浸润的病例占32.55%(98/301), 平均生存期为28.49±4.68 mo; 伴有单纯远处转移的病例占40.53%(122/301),平均生存期为34.04±3.61 mo; 术中伴有复合转移(合并两种或两种以上转移类型)的病例占16.61%(50/301), 平均生存42.02±13.71; 这四种转移类型的病例平均生存时间无差异(P = 0.4122, 图1, 表2).
| 转移类型 | n | 1年整体生存率 | 3年整体生存率 | 5年整体生存率 | 平均生存时间(mo) | 时序检验值 | P值 |
| 腹膜种植 | 31 | 0.552±0.0934 | 0.2658±0.0886 | 0.1772±0.0781 | 43.76±12.17 | 2.87 | 0.4122 |
| 局部浸润 | 98 | 0.658±0.0492 | 0.2362±0.0500 | 0.1299±0.0472 | 28.49±4.68 | ||
| 远处转移 | 122 | 0.706±0.417 | 0.2933±0.0444 | 0.1725±0.0406 | 34.04±3.61 | ||
| 复合转移 | 50 | 0.592±0.141 | 0.3949±0.1478 | 0.2632±0.1458 | 42.02±13.71 |
在301例病例中, 发生肝转移的病例占51.4%(155/301), 平均生存时间为32.50±3.22个月. 发生肺脏转移的病例占2.6%(8/301), 平均生存时间为25.63±6.14 mo. 骨转移的病例占1.3%(4/301), 平均生存时间为31.00±13.69(表3).
| 远处转移 | n | 1年整体生存率 | 3年整体生存率 | 5年整体生存率 | 平均生存时间(mo) |
| 肝脏 | 155 | 0.659±0.0388 | 0.274±0.0392 | 0.176±0.0365 | 32.50±3.22 |
| 肺脏 | 8 | 0.750±0.1531 | 0.125±0.1169 | 0 | 25.63±6.14 |
| 骨 | 4 | 0.500±0.2500 | 0.250±0.2165 | 0 | 31.00±13.69 |
| 其他 | 17 | 0.756±0.1063 | 0.544±0.1548 | 0.272±0.2075 | 40.45±6.39 |
直肠癌播散途径一般有直接浸润、种植播散、淋巴道转移和血道转移四种类型. 在本组总结的所有Dukes D期的直肠癌病例中, 伴有腹膜种植的病例占10.29%, 伴有局部浸润的病例占32.55%, 伴有远处转移的病例占40.53%, 术中伴有复合转移(合并两种或两种以上转移类型)的病例占16.61%, 以局部浸润和远处转移的病例居多. 经统计学分析, 这四种转移类型的病例平均生存时间无差异. 但是, 伴有局部浸润的患者生存期相对最短, 这主要是因为这类患者大多数无法切除原发肿瘤, 只能行单纯造瘘术, Joffe et al[3]报道单纯造瘘术是不能延长患者的生存期. 在Dukes D期患者中, 发生肝转移的病例占51.4%(155/301), 占所有远处转移患者的84.23%, 发生肺脏、骨等处转移的病例较少. Welch et al曾提出"转移级联学说"即原发灶首先转移到肝脏,再通过肝动脉转移到肺、骨和其他部位[4]. 在本组资料中, 在伴有肝脏转移的病例中, 同时肺转移病例有3例, 同时伴有骨转移的病例有2例, 同时伴有其他脏器转移的病例有4例, 由于病例数较少, 尚不能支持此理论. 但是我们发现, 在所有伴有局部浸润的病例中, 同时伴有肝转移的病例占24.85%, 同时伴有腹膜种植的病例占28.24%, 这就提示我们当直肠癌患者处于局部晚期的时候, 除了注重原发灶的清除[5-6]之外, 更要注重全身系统评估, 以制定合理的治疗方案.
在Dukes D期结直肠癌患者中, 原发灶切除的作用一直受到争议, 其主要焦点集中于当患者并发不可切除的肝转移且无症状时如何处理原发灶. 目前为止, 有两种观点. 传统观点认为应切除原发灶, 其原因在于: (1)防止局部肿瘤的并发症, 如疼痛、出血、梗阻和穿孔; (2)降低肿瘤负荷, 为进一步治疗创造条件; (3)相比较于未切除者, 生存和生活质量可获益[7-9]. 而另一种观点认为, 切除原发灶的目的在于防止急性肠梗阻, 因为伴发肠梗阻的患者术后具有较高的死亡率[10], 所以针对这样的患者应首先立即进行系统化疗[11-12], 手术切除原发灶可能导致延迟或者妨碍系统化疗. Tebbutt et al[13]通过对伴有远处转移的患者进行随机化疗后, 发现相对于切除原发灶的患者, 未切除原发灶的患者并发肠瘘、肠梗阻及腹膜炎的发生率没有区别, 从而说明无症状的Dukes D结直肠癌患者能够耐受化疗而不影响原发灶的切除. Goldberg et al[14]和Tournigand et al[15]的研究认为早期化疗效果较好, 其反应率超过50%, 中位生存期为20 mo. 同样, Simmonds的结论也证实了晚期直肠癌进行化疗能够减轻症状, 并能使生存受益[16], 部分患者化疗后手术可提高整体生存[17]. 当前, 由于化疗新药[18-20]的不断出现以及腔内支架的使用, 部分患者由不可根治变为根治. 对于无症状的不可根治的Dukes D直肠癌患者是否进行即刻手术还是延迟手术干预的前瞻性研究还未见报道, 所以Dukes D期早期手术的价值应重新评估.
但是在我国, 大肠癌一旦诊断多为中晚期, 常常伴有明显的症状, 所以上述关于无症状型Dukes D期大肠癌的治疗方案尚缺乏指导价值. 夏振龙 et al报导Dukes D期大肠癌自然生存期仅数月-1年, 尤其是有肝转移者, 平均生存期为5-10 mo, 也有报道半年生存率为零[21]. 在本组资料中, Dukes D期直肠癌患者平均生存33 mo, 1、3、5年生存率为64.6%、26.4%和17.4%, 而伴肝转移者, 平均生存期为32.50±3.22 mo, 这些患者多数是在有明显症状的情况下发现并进行手术干预. 肿瘤的大体类型、组织类型、浸润深度和手术方式影响患者的预后. 其中, 肿瘤大体类型为浸润型、肿瘤侵破浆膜层、组织类型为低分化和黏液腺癌以及行单纯造瘘术的患者的预后最差. 以往的资料[22-24]显示, Dukes D期结直肠癌的手术效果与肝转移程度、腹膜种植、原发肿瘤切除、肿瘤的分化程度、年龄是否大与75岁以及心血管疾病有关. 由于伴发肝转移与腹膜种植的直肠癌患者预后无差别, 我们没有分析其对手术效果的影响. 同时, 相对于单纯造瘘术者, 其余三种术式的效果均具有显著差异, 这是因为单纯造瘘的患者其共性为浸润型、分化差以及"冰冻骨盆"状态; 同时也说明原发灶的切除可以使患者的生存获益; Dukes D期伴肝转移的直肠癌经根治术后生存期高于姑息性切除, 但由于资料偏少未显示出统计学差异. 这个结论与一些报道相吻合[25-30]. 所以, 对于有症状的Dukes D期大肠癌患者, 积极手术治疗无论对患者生存期还是生活质量均有较明显改善. 在娴熟的手术技巧基础上, 凡术中探查能切除者应尽可能切除, 由于切除了肿瘤负荷, 患者的全身状况在一段时间内将会有明显好转.
总之, Dukes D期患者中, 不同转移类型的病例术后平均生存时间无差异; 肿瘤的大体类型、组织类型、浸润深度和手术方式影响患者的预后; 相比较于原发灶未切除者, 原发灶的切除可助患者生存受益.
在我国, 结直肠癌是消化道常见的恶性肿瘤, 大约有20%的病例同时并发远处转移. 在过去的10年间, 直肠癌的治疗已取得长足的进步, 比如TME的推广、放疗的精确性不断的提高以及术前放化疗的使用, 明显的改善了直肠癌根治术后复发率及生存率. 但是, 直肠癌术后5年生存率未得到长足改善的原因, 除了局部复发和远处转移导致的治疗失败外, 主要是Dukes D期直肠癌治疗手段的缺乏.
房林, 副教授, 同济大学附属上海市第十人民医院普外科
国内外学者, 尤其是国外学者研究Dukes D期直肠癌的重心在于手术干预时机的选择, 比如直肠癌同时性伴发肝转移的处理及无症状的不可根治的Dukes D直肠癌的处理, 这些都缺乏前瞻性研究.
目前为止, 对于并发不可切除的肝转移且无症状Dukes D期直肠癌原发灶的处理有两种观点: 一种是积极切除原发灶; 另一种是先行放化疗, 延迟手术干预. 特别是由于化疗新药的不断出现以及腔内支架的使用, 部分患者由不可根治变为根治, 所以Dukes D期早期手术的价值应重新评估.
本文重点探讨不同类型的Dukes D期直肠癌的分布、预后及其相关因素, 并指出切除原发灶可使患者受益.
该文章回顾了301例Dukes D直肠癌病例, 从肿瘤的大体类型、组织类型、浸润深度和手术方式等方面进行了总结, 对临床有一定指导意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Faivre J, Manfredi S, Bouvier AM. [Epidemiology of colorectal cancer liver metastases]. Bull Acad Natl Med. 2003;187:815-822; discussion 822-823. [PubMed] |
| 2. | Rosen SA, Buell JF, Yoshida A, Kazsuba S, Hurst R, Michelassi F, Millis JM, Posner MC. Initial presentation with stage IV colorectal cancer: how aggressive should we be? Arch Surg. 2000;135:530-534; discussion 534-535. [PubMed] [DOI] |
| 3. | Joffe J, Gordon PH. Palliative resection for colorectal carcinoma. Dis Colon Rectum. 1981;24:355-360. [PubMed] [DOI] |
| 4. | Welch JP, Donaldson GA. The clinical correlation of an autopsy study of recurrent colorectal cancer. Ann Surg. 1979;189:496-502. [PubMed] [DOI] |
| 7. | Al-Sanea N, Isbister WH. Is palliative resection of the primary tumour, in the presence of advanced rectal cancer, a safe and useful technique for symptom control? ANZ J Surg. 2004;74:229-232. [PubMed] [DOI] |
| 8. | Ruo L, Gougoutas C, Paty PB, Guillem JG, Cohen AM, Wong WD. Elective bowel resection for incurable stage IV colorectal cancer: prognostic variables for asymptomatic patients. J Am Coll Surg. 2003;196:722-728. [PubMed] [DOI] |
| 9. | Kuo LJ, Leu SY, Liu MC, Jian JJ, Hongiun Cheng S, Chen CM. How aggressive should we be in patients with stage IV colorectal cancer? Dis Colon Rectum. 2003;46:1646-1652. [PubMed] [DOI] |
| 10. | Scoggins CR, Meszoely IM, Blanke CD, Beauchamp RD, Leach SD. Nonoperative management of primary colorectal cancer in patients with stage IV disease. Ann Surg Oncol. 1999;6:651-657. [PubMed] [DOI] |
| 11. | Aloia T, Sebagh M, Plasse M, Karam V, Lévi F, Giacchetti S, Azoulay D, Bismuth H, Castaing D, Adam R. Liver histology and surgical outcomes after preoperative chemotherapy with fluorouracil plus oxaliplatin in colorectal cancer liver metastases. J Clin Oncol. 2006;24:4983-4990. [PubMed] [DOI] |
| 12. | Benoist S, Pautrat K, Mitry E, Rougier P, Penna C, Nordlinger B. Treatment strategy for patients with colorectal cancer and synchronous irresectable liver metastases. Br J Surg. 2005;92:1155-1160. [PubMed] [DOI] |
| 13. | Tebbutt NC, Norman AR, Cunningham D, Hill ME, Tait D, Oates J, Livingston S, Andreyev J. Intestinal complications after chemotherapy for patients with unresected primary colorectal cancer and synchronous metastases. Gut. 2003;52:568-573. [PubMed] [DOI] |
| 14. | Goldberg RM, Sargent DJ, Morton RF, Fuchs CS, Ramanathan RK, Williamson SK, Findlay BP, Pitot HC, Alberts SR. A randomized controlled trial of fluorouracil plus leucovorin, irinotecan, and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer. J Clin Oncol. 2004;22:23-30. [PubMed] [DOI] |
| 15. | Tournigand C, Andre T, Achille E, Lledo G, Flesh M, Mery-Mignard D, Quinaux E, Couteau C, Buyse M, Ganem G. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol. 2004;22:229-237. [PubMed] [DOI] |
| 16. | Simmonds PC. Palliative chemotherapy for advanced colorectal cancer: systematic review and meta-analysis. Colorectal Cancer Collaborative Group. BMJ. 2000;321:531-535. [PubMed] [DOI] |
| 17. | Giantonio BJ, Catalano PJ, Meropol NJ, O'Dwyer PJ, Mitchell EP, Alberts SR, Schwartz MA, Benson AB 3rd. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol. 2007;25:1539-1544. [PubMed] [DOI] |
| 18. | Saltz LB, Cox JV, Blanke C, Rosen LS, Fehrenbacher L, Moore MJ, Maroun JA, Ackland SP, Locker PK, Pirotta N. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group. N Engl J Med. 2000;343:905-914. [PubMed] [DOI] |
| 19. | Saltz LB, Meropol NJ, Loehrer PJ Sr, Needle MN, Kopit J, Mayer RJ. Phase II trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor. J Clin Oncol. 2004;22:1201-1208. [PubMed] [DOI] |
| 20. | Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, Berlin J, Baron A, Griffing S, Holmgren E. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004;350:2335-2342. [PubMed] [DOI] |
| 22. | Liu SK, Church JM, Lavery IC, Fazio VW. Operation in patients with incurable colon cancer--is it worthwhile? Dis Colon Rectum. 1997;40:11-14. [PubMed] [DOI] |
| 23. | Makela J, Haukipuro K, Haukipuro K, Laitinen S, Kairaluoma MI. Palliative operations for colorectal cancer. Dis Colon Rectum. 1990;33:846-850. [PubMed] [DOI] |
| 24. | Stelzner S, Hellmich G, Koch R, Ludwig K. Factors predicting survival in stage IV colorectal carcinoma patients after palliative treatment: a multivariate analysis. J Surg Oncol. 2005;89:211-217. [PubMed] [DOI] |
| 25. | Beham A, Rentsch M, Püllmann K, Mantouvalou L, Spatz H, Schlitt HJ, Obed A. Survival benefit in patients after palliative resection vs non-resection colon cancer surgery. World J Gastroenterol. 2006;12:6634-6638. [PubMed] |
| 26. | Cook AD, Single R, McCahill LE. Surgical resection of primary tumors in patients who present with stage IV colorectal cancer: an analysis of surveillance, epidemiology, and end results data, 1988 to 2000. Ann Surg Oncol. 2005;12:637-645. [PubMed] [DOI] |
| 27. | Law WL, Chan WF, Lee YM, Chu KW. Non-curative surgery for colorectal cancer: critical appraisal of outcomes. Int J Colorectal Dis. 2004;19:197-202. [PubMed] [DOI] |
| 28. | Konyalian VR, Rosing DK, Haukoos JS, Dixon MR, Sinow R, Bhaheetharan S, Stamos MJ, Kumar RR. The role of primary tumour resection in patients with stage IV colorectal cancer. Colorectal Dis. 2007;9:430-437. [PubMed] [DOI] |