修回日期: 2008-10-08
接受日期: 2008-10-14
在线出版日期: 2008-11-28
目的: 探讨JNK信号通路在δ氨基酮戊酸(ALA)-光动力疗法((PDT)诱导SW480细胞凋亡中的作用.
方法: 将SW480细胞分为空白对照组、激光照射组、ALA组及ALA-PDT组, Western blot检测各组细胞c-Jun氨基末端激酶(JNK)的表达; 用SP600125(JNK抑制剂)预孵育ALA-PDT组细胞, Western blot检测各组细胞的多聚(ADP-核糖)聚合酶(PARP)的表达.
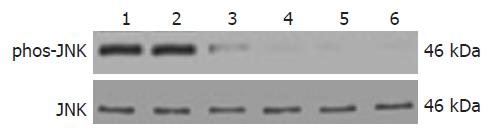
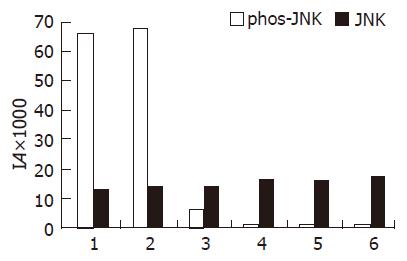
结果: 磷酸化JNK在空白对照组、激光照射组及ALA组几乎无表达, ALA-PDT后30-90 min细胞表达显著高于空白对照组、激光照射组及ALA组(F = 12.314, P<0.001), 其中ALA-PDT后60及90 min的磷酸化JNK表达显著高于ALA-PDT后30 min(F= 9.782, P<0.001), 各组细胞总的JNK表达无显著差异. JNK的激活能抑制ALA-PDT诱导SW480细胞凋亡.
结论: JNK信号通路的激活抑制ALA-PDT诱导SW480细胞凋亡; JNK通路可能成为增强ALA-PDT治疗结肠癌的新靶点.
引文著录: 郑江华, 陈开, 陈祖林. JNK信号通路在δ氨基酮戊酸-光动力疗法诱导SW480细胞凋亡中的作用机制. 世界华人消化杂志 2008; 16(33): 3792-3795
Revised: October 8, 2008
Accepted: October 14, 2008
Published online: November 28, 2008
AIM: To investigate the role of the c-Jun N-terminal kinase (JNK) signaling pathway in SW480 cell apoptosis in response to 5-aminolevulinic acid (ALA)-based photodynamic therapy (PDT).
METHODS: SW480 cells were divided into control group, laser irradiation group, ALA group and ALA-PDT group. Western blot was used to detect expression of JNK in each group. SW480 cells in ALA-PDT group were preincubated with SP600125 (JNK inhibitor). Western blot was used to detect expression of PARP in each group.
RESULTS: JNK phosphorylation almost had no expression in control group, light group or ALA group. JNK phosphorylation of SW480 cells at 30, 60 and 90 min after ALA- PDT was significantly increased than that of control group, light group or ALA group (F = 12.314, P < 0.001). Phosphorylated JNK expression was significantly higher at 60 min and 90 min after ALA-PDT than at 30 min after ALA- PDT (F = 9.782, P < 0.001). The expression of total JNK of all groups had no significant difference. The activation of JNK inhibited apoptosis of SW480 cells in response to ALA-PDT.
CONCLUSION: AActivation of JNK signaling pathway inhibits SW480 cell apoptosis after ALA-PDT. JNK signaling pathway may become a new target, which will enhance anticancer treatment of ALA-PDT for colon carcinoma.
- Citation: Zheng JH, Chen K, Chen ZL. Role of the c-Jun N-terminal kinase signaling pathway in SW480 cell apoptosis in response to 5-aminolevulinic acid-based photodynamic therapy. Shijie Huaren Xiaohua Zazhi 2008; 16(33): 3792-3795
- URL: https://www.wjgnet.com/1009-3079/full/v16/i33/3792.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i33.3792
光动力疗法(photodynamic therapy, PDT)作为一种新的肿瘤治疗方法近年来倍受重视, 迄今为止, 加拿大、美国、法国、荷兰、德国和日本等国家已先后批准PDT用于一些恶性肿瘤[1], 但其作用的分子机制还不清楚. 研究表明PDT能激活有丝分裂原蛋白激酶(mitogen activated protein kinases, MAPKs)[2], 然而PDT诱导MAPKs的生物学作用存在争议, 这可能与光敏剂和/或细胞类型相关[3]. MAPK家族主要包括3个成员: ERK、JNK和p38MAPK. ERK主要介导生长、分化及存活, JNK和p38MAPK主要介导细胞的应急反应, 他们的激活促进细胞凋亡. 但是JNK激活方式的不同也可产生不同的生物学效应, γ射线照射Jurkat T细胞后, JNK被持续激活, 细胞发生凋亡; 而CD28单抗加PMA处理后, JNK被迅速而短暂的激活, 细胞并不出现凋亡, 而是被活化和增殖[4], 提示JNK激活作用可能具有细胞和刺激物的特异性. 有报道显示卟啉或卟啉衍生物-PDT能诱导c-Jun表达[5], 并激活JNK信号通路[6], 但JNK信号通路的激活与PDT诱导细胞凋亡的关系还不清楚, 因此我们探讨ALA-PDT对JNK信号通路的影响及其与细胞凋亡的关系.
δ氨基酮戊酸和Hepes为Sigma公司产品, 培养液RPMI 1640和D-Hanks为Hyclone公司产品, 胰蛋白酶(北京鼎国生物技术公司); 小牛血清(成都哈里公司); JNK mAb、磷酸化JNK mAb及PARP mAb(Cell Signaling Technology); SP600125(Merck biosciences); β-actin抗体(北京博澳森生物技术公司); PVDF膜(Roche); 蛋白质分子Maker(MBI); RIPA(上海申能博彩生物科技有限公司); DTT(Gibco); 二甲基亚砜(DMSO, Sigma公司); 结肠癌细胞株SW480细胞(中国人民解放军第四军医大学动物实验中心提供).
1.2.1 细胞培养: 用含青霉素和链霉素分别为100 kU/L, 含100 mL/L小牛血清RPMI 1640培养液培养, 37 ℃, 50 mL/L CO2, 饱和湿度, 单层贴壁生长.
1.2.2 细胞的PDT处理: 将增殖期SW480细胞按照适当浓度接种于6孔培养板, 每组复4孔, 待其贴壁后, 吸出含血清的培养液, D-Hanks液轻轻漂洗后弃去, ALA组和ALA-PDT组在暗室按预定时间加入ALA(40 mg/L), 严格避光条件下继续孵育4 h, 弃去含有ALA的培养液; 在另外的ALA-PDT组细胞中加入终浓度20 µmol/L的SP600125(JNK抑制剂)预孵育2 h, D-Hanks液轻轻漂洗后, 加入新鲜培养液, 空白对照组不加ALA且不受激光照射, ALA组加入ALA不受激光照射. 激光照射组、ALA-PDT组以及加有SP600125的ALA-PDT组使用半导体激光仪(西南师范大学激光所, 波长532 nm, 距光斑3 cm处输出功率12 mW, 能量密度9 J/cm2)垂直照射培养板30 min, 然后将细胞置于培养箱中继续培养到实验设计的时间, 再检测各组细胞的蛋白表达[6].
1.2.3 Western蛋白印迹检测JNK和PARP蛋白表达: 细胞培养48 h后经PDT处理, 按照设计时间继续孵育或即刻抽提细胞总蛋白. 按照RIPA使用说明, 每孔细胞加入300 µL RIPA提取细胞总蛋白, 考马斯亮蓝250染色法测总蛋白浓度后-20 ℃保存. 调整各组总蛋白浓度使每孔上样量一致, SDS-聚丙烯酰胺凝胶垂直电泳分离后通过半干电转仪将蛋白转到PVDF膜. 用含0.1% Tween-20的50 g/L脱脂奶粉室温下封闭PVDF膜1 h后, 再用含0.1% Tween-20的Tris缓冲液(TBS/T)洗3次, 每次5 min; 一抗1:1000稀释, 4 ℃过夜, TBS/T洗3次, 每次5 min; 按照1:2000稀释浓度加入抗兔或小鼠的HRP-IgG 1 h, TBS/T洗3次, 每次5 min; 加入DAB显色, 凝胶成像系统上摄像并分析灰度值, 以积分吸光度A×面积表示(A×mm2), 分别计算目的条带的积分吸光度值(IA值).
统计学处理 数据mean±SD表示, 采用SPSS10.0统计软件处理数据, 行F检验. 检验水准α = 0.05.
ALA-PDT造成SW480细胞JNK蛋白表达增加. 磷酸化JNK在空白对照组、激光照射组及ALA组几乎无表达, PDT后30-90 min细胞表达显著高于空白对照组、激光照射组及ALA组(F = 12.314, P<0.001), 其中PDT后60及90 min的磷酸化JNK表达显著高于PDT后30 min(F = 9.782, P<0.001), 各组细胞总的JNK表达无显著差异
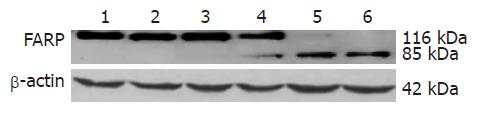
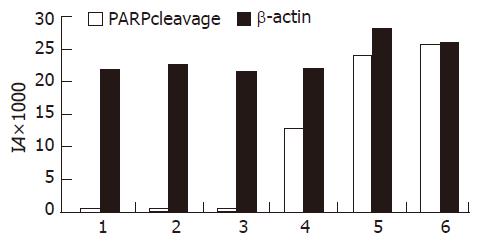
为了进一步研究JNK在ALA-PDT后SW480细胞中的作用, 我们用JNK抑制剂SP600125在激光照射前处理ALA-PDT组细胞, 孵育2 h, 结果发现ALA-PDT后30-90 min PARP裂解成85 kDa大小的片段逐渐增加, 说明JNK的激活能抑制ALA-PDT诱导SW480细胞凋亡(图3-4).
PDT是指光敏剂选择性地聚集在肿瘤组织中, 接受光照后在细胞内产生活性氧物质, 而导致肿瘤细胞凋亡或坏死的一种治疗方法[7-8]. 迄今为止, 加拿大、美国、法国、荷兰、德国和日本等国家已先后批准PDT用于一些恶性肿瘤[1]. 但常规光敏剂不良反应重和需要较长时间避光等缺点又限制了其进一步临床应用. δ氨基酮戊酸(aminolaevulinic acid, ALA)是一种血红素生物合成的前体物质, 在大多数类型的癌细胞中, 由于胆色素原脱氨基酶活性增加而亚铁鳌合酶活性降低[9], 导致原卟啉Ⅸ(protoporphyrin, PP Ⅸ)在癌细胞内积累, PP Ⅸ具有极好的光敏特性, 用与之吸收波段相应的光照射后将导致癌细胞的破坏[10]. 因ALA代谢快、毒副作用小等优点, 所以是一种很有前途的治疗癌症的方法[11], 但ALA-PDT对结肠癌杀伤作用还不够强[12], 探讨其作用的信号传导机制可能是提高ALA-PDT对结肠癌疗效的重要研究方向之一.
多项研究表明, JNK的激活与多种细胞的细胞凋亡调控有关. 神经生长因子(NGF)可使PC12细胞发生分化, 当NGF从培养基中被去除后, JNK被激活, 出现细胞凋亡; 当PC12细胞被转染了JNK上游激酶MEKK1的显性失活突变体后, NGF撤除诱导的细胞凋亡可被阻断[13]. Jurkat细胞经γ射线处理后JNK可被激活, 出现细胞凋亡, 而当细胞被转染了显性失活JNK突变体后, γ射线诱导的凋亡可以被阻断, 同样, 激活的JNK过度表达可诱导细胞凋亡[14]. 以上研究均表明, JNK的激活可诱导细胞发生凋亡. 但是JNK激活方式的不同也可产生不同的生物学效应, γ射线照射Jurkat T细胞后, JNK被持续激活, 细胞发生凋亡; 而CD28单抗加PMA处理后, JNK被迅速而短暂的激活, 细胞并不出现凋亡, 而是被活化和增殖[4], 提示JNK激活作用可能具有细胞和刺激物的特异性. 有报道显示卟啉或卟啉衍生物-PDT能诱导c-Jun表达[5], 并激活JNK信号通路的激活[6], 我们的实验结果显示ALA-PDT后SW480细胞的JNK信号通路也快速激活. 但JNK信号通路的激活与PDT诱导细胞凋亡的关系还不清楚, 因此我们进一步探讨ALA-PDT对SW480细胞JNK信号通路的激活与细胞凋亡的关系. 目前主要有两种细胞凋亡途径: 死亡受体介导的凋亡途径和线粒体介导的凋亡途径[15]. 死亡受体介导的凋亡途径是指细胞表面的肿瘤坏死因子受体(TNFR)超家族受到刺激后, TNFR1和TNF结合导致TNFR1形成同三聚体, 随后他们的死亡结构域交联, 再与Fas相关的死亡结构域蛋白(Fas-associated death domain, FADD)结合, 激活始动Caspase, 如Caspase-8, -9. 活化的始动Caspase进一步活化效应Caspase, 如: Caspase-3, -6, -7等. 从而诱导细胞凋亡[16]. 线粒体介导的凋亡途径是指线粒体功能受到损害后, 细胞色素C释放进入胞质, 在ATP的参与下细胞色素C结合并活化凋亡活化因子-1(apoptosis activating factor, Apaf-1). 随后, 活化的Apaf-1使Caspase-9剪切和活化, 从而进一步活化效应Caspase, 最后细胞凋亡[17]. Caspase-3最主要的底物是多聚(ADP-核糖)聚合酶(poly(ADP-ribose) polymerase, PARP), 该酶与DNA修复、基因完整性监护有关. 在细胞凋亡启动时, 116 kDa的PARP在Asp216-Gly217之间被caspase-3剪切成31 kDa和85 kDa两个片段, 使PARP中与DNA结合的两个锌指结构与羧基端的催化区域分离, 不能发挥正常功能. 结果使受PARP负调控影响的Ca2+/Mg2+依赖性核酸内切酶的活性增高, 裂解核小体间的DNA, 引起细胞凋亡. 因此我们用JNK抑制剂处理细胞, 观察ALA-PDT后各组细胞PARP蛋白的裂解情况, 从而探讨JNK信号通路的激活与PDT诱导细胞凋亡的关系. 实验结果表明: 抑制JNK或p38MAPK后, 116 kDa的PARP裂解成85 kDa片段逐渐增加, 说明JNK通路的激活保护ALA-PDT后SW480细胞免于凋亡.
总之, ALA-PDT能诱导SW480细胞JNK通路的快速激活, 阻断JNK通路可增强ALA-PDT诱导SW480细胞凋亡.
PDT是指光敏剂选择性地聚集在肿瘤组织中, 接受光照后在细胞内产生活性氧物质, 而导致肿瘤细胞凋亡或坏死的一种治疗方法. 迄今为止, 加拿大、美国、法国、荷兰、德国和日本等国家已先后批准PDT用于一些恶性肿瘤.
王志刚, 副主任医师, 上海市第六人民医院普外科
目前JNK信号通路的激活与PDT诱导细胞凋亡的关系还不甚清楚.
本文探索了ALA-PDT诱导结肠癌细胞SW480凋亡与JNK信号通路的关系, 为结肠癌光动力治疗的增效作用提供新的靶点, 也为结肠癌光动力治疗和作用机理提供理论依据.
本研究对光动力疗法治疗肿瘤的机理的探讨具有一定理论价值, 可读性及创新性均能较好的反映我国和国际胃肠病学研究水平.
编辑: 李军亮 电编: 郭海丽
| 1. | Johansen LS. [Photodynamic therapy. A new method for the treatment of cancer]. Ugeskr Laeger. 1999;161:3992-3995. [PubMed] |
| 2. | Assefa Z, Vantieghem A, Declercq W, Vandenabeele P, Vandenheede JR, Merlevede W, de Witte P, Agostinis P. The activation of the c-Jun N-terminal kinase and p38 mitogen-activated protein kinase signaling pathways protects HeLa cells from apoptosis following photodynamic therapy with hypericin. J Biol Chem. 1999;274:8788-8796. [PubMed] [DOI] |
| 3. | Xue L, He J, Oleinick NL. Promotion of photodynamic therapy-induced apoptosis by stress kinases. Cell Death Differ. 1999;6:855-864. [PubMed] [DOI] |
| 4. | Chen YR, Meyer CF, Tan TH. Persistent activation of c-Jun N-terminal kinase 1 (JNK1) in gamma radiation-induced apoptosis. J Biol Chem. 1996;271:631-634. [PubMed] [DOI] |
| 5. | Kick G, Messer G, Plewig G, Kind P, Goetz AE. Strong and prolonged induction of c-jun and c-fos proto-oncogenes by photodynamic therapy. Br J Cancer. 1996;74:30-36. [PubMed] |
| 6. | Klotz LO, Fritsch C, Briviba K, Tsacmacidis N, Schliess F, Sies H. Activation of JNK and p38 but not ERK MAP kinases in human skin cells by 5-aminolevulinate-photodynamic therapy. Cancer Res. 1998;58:4297-4300. [PubMed] |
| 7. | Peng Q, Warloe T, Moan J, Godal A, Apricena F, Giercksky KE, Nesland JM. Antitumor effect of 5-aminolevulinic acid-mediated photodynamic therapy can be enhanced by the use of a low dose of photofrin in human tumor xenografts. Cancer Res. 2001;61:5824-5832. [PubMed] |
| 8. | Niedre M, Patterson MS, Wilson BC. Direct near-infrared luminescence detection of singlet oxygen generated by photodynamic therapy in cells in vitro and tissues in vivo. Photochem Photobiol. 2002;75:382-391. [PubMed] [DOI] |
| 9. | Bartosova J, Hrkal Z. Accumulation of protoporphyrin-IX (PpIX) in leukemic cell lines following induction by 5-aminolevulinic acid (ALA). Comp Biochem Physiol C Toxicol Pharmacol. 2000;126:245-252. [PubMed] |
| 10. | Dougherty TJ, Gomer CJ, Henderson BW, Jori G, Kessel D, Korbelik M, Moan J, Peng Q. Photodynamic therapy. J Natl Cancer Inst. 1998;90:889-905. [PubMed] [DOI] |
| 11. | Haddad R, Kaplan O, Greenberg R, Siegal A, Skornick Y, Kashtan H. Photodynamic therapy of murine colon cancer and melanoma using systemic aminolevulinic acid as a photosensitizer. Int J Surg Investig. 2000;2:171-178. [PubMed] |
| 13. | Xia Z, Dickens M, Raingeaud J, Davis RJ, Greenberg ME. Opposing effects of ERK and JNK-p38 MAP kinases on apoptosis. Science. 1995;270:1326-1331. [PubMed] [DOI] |
| 14. | Chen YR, Wang X, Templeton D, Davis RJ, Tan TH. The role of c-Jun N-terminal kinase (JNK) in apoptosis induced by ultraviolet C and gamma radiation. Duration of JNK activation may determine cell death and proliferation. J Biol Chem. 1996;271:31929-31936. [PubMed] [DOI] |
| 16. | Wallach D, Varfolomeev EE, Malinin NL, Goltsev YV, Kovalenko AV, Boldin MP. Tumor necrosis factor receptor and Fas signaling mechanisms. Annu Rev Immunol. 1999;17:331-367. [PubMed] [DOI] |
| 17. | Adams JM, Cory S. Apoptosomes: engines for caspase activation. Curr Opin Cell Biol. 2002;14:715-720. [PubMed] [DOI] |