修回日期: 2008-10-12
接受日期: 2008-10-30
在线出版日期: 2008-11-28
目的: 了解糖尿病大鼠胃肠动力障碍时, 回肠肌间神经丛有无形态学异常, 以及第Ⅰ组代谢型谷氨酸受体mGluR1、mGluR5的表达变化, 探讨谷氨酸能神经在糖尿病胃肠病变发生中的作用.
方法: 40只大鼠随机分为糖尿病组和对照组, 给与高脂饮食结合腹腔注射STZ 30 mg/kg造糖尿病模型. 运用肌间神经丛铺片观察谷氨酸能神经的分布及形态特征, 并对其神经节和神经元进行定量研究, 以及运用免疫荧光染色和RT-PCR方法观察大鼠回肠肠神经系统肌间神经丛的代谢型谷氨酸受体mGluR1、mGluR5的表达变化.
结果: 糖尿病大鼠肠神经系统肌间神经丛的谷氨酸能神经节和神经元的数目较对照组明显减少(mGluR1: 4.5±3.1 vs 7.3±2.4; 142.25±28.24 vs 175.34±34.83, 均P<0.05; mGluR5: 4.3±2.1 vs 7.9±2.8, 133.37±35.73 vs 168.34±32.66, 均P<0.05), 荧光强度较对照组减弱(mGluR1: 145.23±28.78 vs 167.72±30.56, 均P<0.05; mGluR5: 141.54±18.46 vs 172.53±29.74, 均P<0.05), mGluR1、mGluR5受体mRNA表达减少(1.05±0.27 vs 1.43±0.47, 0.95±0.30 vs 1.60±0.39, 均P<0.01).
结论: 糖尿病大鼠回肠肠壁的肌间神经丛的神经节和神经元数目减少, 以及兴奋性递质受体mGluR1、mGluR5的表达减少是导致胃肠道肌层兴奋性降低, 肌层收缩减弱, 引起糖尿病胃肠病变的一个重要机制.
引文著录: 白艳华, 张军, 史红阳, 戴菲, 李芳伟. 糖尿病大鼠回肠肌间神经丛mGluR1及mGluR5的表达. 世界华人消化杂志 2008; 16(33): 3734-3739
Revised: October 12, 2008
Accepted: October 30, 2008
Published online: November 28, 2008
AIM: To find the morphologic abnormalities, if any, of myenteric plexus in diabetic rats, to explore the expressive alteration of the Group Ⅰ mGluRs (mGluR1, mGluR5) and to explore the role of glutamic acid energic nerve in enteric nervous system of diabetic gastroenteropathy.
METHODS: Forty rats were randomly divided into diabetic group and control group. Gastric emptying and small intestine transit rate were measured, and the number of mGluR1 and mGluR5 receptors in diabetic rats was studied using fluorescence immunohistochemistry and RT-PCR.
RESULTS: Eighteen weeks after the establishment of the diabetic rats model, gastric emptying and gastrointestinal transit rate were delayed compared with control group. The number of ganglia and neurons was significantly decreased in diabetic rats compared with control group (mGluR1: 4.5 ± 3.1 vs 7.3 ± 2.4, 142.25 ± 28.24 vs 175.34 ± 34.83, both P < 0.05; mGluR5: 4.3 ± 2.1 vs 7.9 ± 2.8, 133.37 ± 35.73 vs 168.34 ± 32.66, both P < 0.05). The fluorescence intensity of the receptors of mGluR1 and mGluR5 in the diabetic rats was weakened compared with control group (mGluR1: 145.23 ± 28.78 vs 167.72 ± 30.56, both P < 0.05; mGluR5: 141.54 ± 18.46 vs 172.53 ± 29.74, both P < 0.05), and mGluR1 and mGluR5 mRNA expressions were decreased in the diabetic rats (1.05 ± 0.27 vs 1.43 ± 0.47, 0.95 ± 0.30 vs 1.60 ± 0.39, both P < 0.01).
CONCLUSION: Decreased glutamatergic ganglia and neurons and reduced receptor expression of mGluR1 and mGluR5 in myenteric plexus might be one of the mechanisms of diabetic gastroenteropathy in rats.
- Citation: Bai YH, Zhang J, Shi HY, Dai F, Li FW. Expression of metabotropic glutamate receptors mGluR1 and mGluR5 in the myenteric plexus of the diabetic rat ileum. Shijie Huaren Xiaohua Zazhi 2008; 16(33): 3734-3739
- URL: https://www.wjgnet.com/1009-3079/full/v16/i33/3734.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i33.3734
糖尿病胃肠病变(diabetic gastroenteropathy)是糖尿病的一种常见的并发症, 表现为消化不良、恶心、呕吐、腹痛、腹胀、腹泻、便秘等多种症状. 75%的门诊糖尿病病患者不同程度具有这些症状, 严重地影响了患者的生活质量, 并削弱了血糖的调控, 且妨碍药物的吸收, 干扰治疗, 又可引起营养不良和水电解质紊乱, 可分为糖尿病性胃轻瘫和糖尿病肠病两种[1-2]. 近年, 糖尿病胃肠动力障碍已引起国内外学者和临床医生的重视, 并成为研究热点.
目前认为引起糖尿病胃肠病变的发病机制包括神经病变(含自主神经病变和肠神经系统病变)、Cajal间质细胞异常、高血糖、胃肠激素分泌异常等等, 但确切的发病机制尚不完全清楚[3]. 其中肠神经系统(enterie nervous system, ENS)病变是较受关注的一种发病机制, 本研究通过建立糖尿病大鼠模型, 研究代谢型谷氨酸受体mGluR1、mGluR5的表达变化, 从而了解谷氨酸能神经的变化在糖尿病胃肠神经病变发生中的作用.
健康♂SD大鼠40只, 体质量100-160 g, 由西安交通大学医学院动物中心提供.
1.2.1 糖尿病模型的建立: 健康♂SD大鼠随机分为实验组(30只)和对照组(10只). 对照组饲以标准饲料, 糖尿病组予以高脂饲料. 高脂饲料的成分为普通饲料占61.5%的基础上, 加熟猪油15%, 蔗糖20%, 胆固醇2.5%, 胆酸盐1%. 8 wk后糖尿病组, 一次性左下腹ip链尿佐菌素(streptozotocin, STZ)30 mg/kg[4], 对照组腹腔内只注射等量柠檬酸盐缓冲液, 空腹血糖>7.8 mmol/L或葡萄糖耐量实验血糖120 min>11.1 mmol/L并稳定者为糖尿病大鼠. 成模后每2周固定时间测量体质量, 每周测定2-3次血糖, 剔除死亡、未成模及血糖恢复的大鼠, 18 wk ip过量100 g/L水合氯醛处死大鼠.
1.2.2 胃肠道动力指标检测: 大鼠胃排空和肠道传输速度测定: 两组动物禁食24 h, 处死前, 经口胃管灌入20 g/L亚甲兰0.4 mL, 30 min后处死动物, 开腹取全部胃肠道, 自幽门括约肌处取胃, 沿大弯侧剪开, 将胃内色素残留物充分洗于4 mL去离子水中, 3500 r/min离心15 min, 取上清液, 以分光光度计测吸光度为胃内色素残留量, 求出与对照均值的百分比即为各样本的胃内色素相对残留率. 同时量取幽门括约肌至小肠色素最前端及至盲肠距离, 以二者百分比为小肠推进比.
1.2.3 小肠肌间神经丛铺片标本制备: 动物处死后, 剖腹, 取出取相同部位(距离回盲部10 cm处)的一段回肠(长10 cm), 尽量剪掉肠系膜和脂肪组织, 0.01 mol/L的PBS洗净内容物后, 用40 g/L多聚甲醛充盈回肠, 两端用线结扎, 放入40 g/L多聚甲醛中固定8 h, 再转入300 g/L蔗糖溶液脱水. 将固定脱水后的肠管剪成长约6 mm×6 mm大小的方块, 0.01 mol/L的PBS冲洗3次后用手术刀片在肠管浆膜面轻轻划一切痕, 用钟表镊沿切痕轻轻剥离, 得到一层透明的组织, 即纵行肌与环形肌层组织, 将组织内侧面向上之置于解剖显微镜下, 用钟表镊小心剥掉环肌层, 即得到位于位于纵、环肌层之间的肌间神经丛铺片标本, 放入0.01 mol/L的PBS溶液中保存(4 ℃).
1.2.4 肌间神经丛免疫荧光染色分别检测mGluR1、mGluR5的表达变化: 本实验采用漂染法, 铺片经0.01 mol/L的PBS漂洗10 min×3次后, (1)0.3% trition x-100 37 ℃下孵育30 min; (2)0.01 mol/L的PBS漂洗10 min×3次; (3)正常血清封闭, 37 ℃下孵育2 h后倾去, 不洗; (4)室温下滴加一抗, (mGluR1 chemicon公司, 1:200稀释, mGluR5 chemicon公司, 1:200稀释)4 ℃下过夜; (5)0.01 mol/L的PBS漂洗10 min×3次; (6)加荧光二抗(FITC 1:100稀释)4 ℃下过夜; (7)0.01 mol/L的PBS漂洗10 min×3次; (8)将铺片裱于多聚赖氨酸处理过的玻片上, 甘油/PBS封片; (9)荧光显微镜和共聚焦显微镜下观察, 照相, 定量观察mGluR1、mGluR5的荧光强度变化.
1.2.5 计数肌层神经元和神经节的数目: 在200倍荧光显微镜下对神经节及神经元计数, 每例随机选取5个高倍镜视野进行神经节及神经细胞计数, 取均值分别代表该标本神经节和神经元密度.
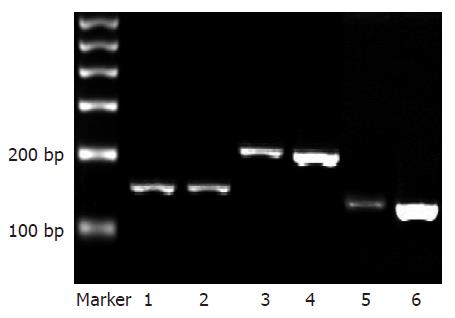
1.2.6 采用RT-PCR法检测胃肠道mGluR1、mGluR5 mRNA的表达变化: 取肠肌间神经丛共50 mg, 用TRIzol试剂提取总RNA. 测定总 RNA含量. A260/A280的比值在1.6-2.0时, 表明纯度较好, 可用于逆转录合成cDNA, 逆转录试剂盒购自Fermentas公司, 引物由北京三博远志公司设计合成. 引物序列如下, mGluR1上游引物: 5-AAATCTACAGCAATGCTGGCGA-3, 下游引物5-CTTCGATGACTTCTCTGTC-3, 扩增产物长度207 bp; mGluR5上游引物: 5-GAGCAGATCAGCAGCGTAGTG-3, 下游引物: 5-TCAGGTAGGAGGAGCAGATTGG-3, 扩增产物长度121 bp; β-actin上游引物: 5-CTATCGGCAATGAGCGGTTCC-3, 下游引物: 5-TGTGTTGGCATAGAGGTCTTTACG-3, 扩增产物长度146 bp. 25 μL反应体系进行PCR反应, 反应条件: 94 ℃预变性5 min, 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸1 min, 循环30次, 末次循环后72 ℃再延伸10 min, 4 ℃终止反应. 取PCR产物10 mL, 在含0.5 mg/L溴化乙啶(EB)的20 g/L琼脂糖凝胶上电泳(80 V, 20 min), 凝胶图像成像处理系统扫描凝胶, 以目的条带与内参条带的光密度之比(A1/A2)为标准评价结果.
统计学处理 各组数据用mean±SD表示, 两组间比较采用t检验, P<0.05为差异显著, P<0.01为差异非常显著, 用SPSS13.0统计分析软件进行数据处理.
对照组大鼠在实验全过程精神良好, 动作灵活, 进食正常, 休质量逐渐增加, 毛色光泽, 未见感染病灶. 实验组大鼠给予高脂饮食后, 体质量自第4周开始与对照组比较有明显升高, STZ注射后, 糖尿病大鼠体质量增长较注射前缓慢. 糖尿病组大鼠在注射后1 wk内出现多尿、多饮、多食症状, 10 wk后上述症状更加显著, 且较对照组大鼠明显懒动, 精神倦怠, 无进攻性, 毛色干枯无光泽, 易感染, 部分造模大鼠腹部出现溃疡.
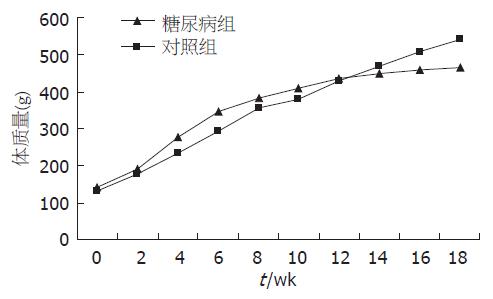
实验组大鼠在第4周后体质量增长快于对照组(276.32±23.47 g vs 234±28.76 g, P<0.05), 自第9周开始体质量增长放缓, 第12-14周两组体质量无明显差异, 16 wk后糖尿病大鼠体质量增长较对照组减慢, 差异有显著性(458±35.75 g vs 508±28.46 g, P<0.05, 图1).
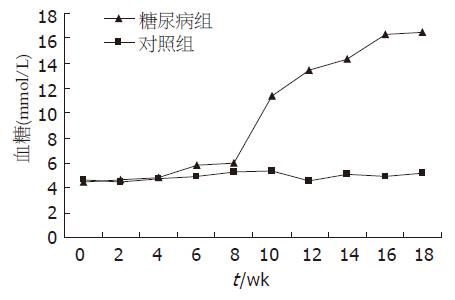
糖尿病组大鼠在第9周后空腹血糖高于对照组(8.34±2.35 mmol/L vs 5.33±1.03 mmol/L, P<0.05), 第10周后在血糖明显高于对照组(11.34±3.36 mmol/L vs 5.34±1.07 mmol/L, P<0.01), 以后每2周测一次空腹血糖. 大鼠18 wk处死前测量血糖和体重(图2).
糖尿病组的胃内色素残留率与对照组比较显著增加, 小肠传输速率减慢(表1).
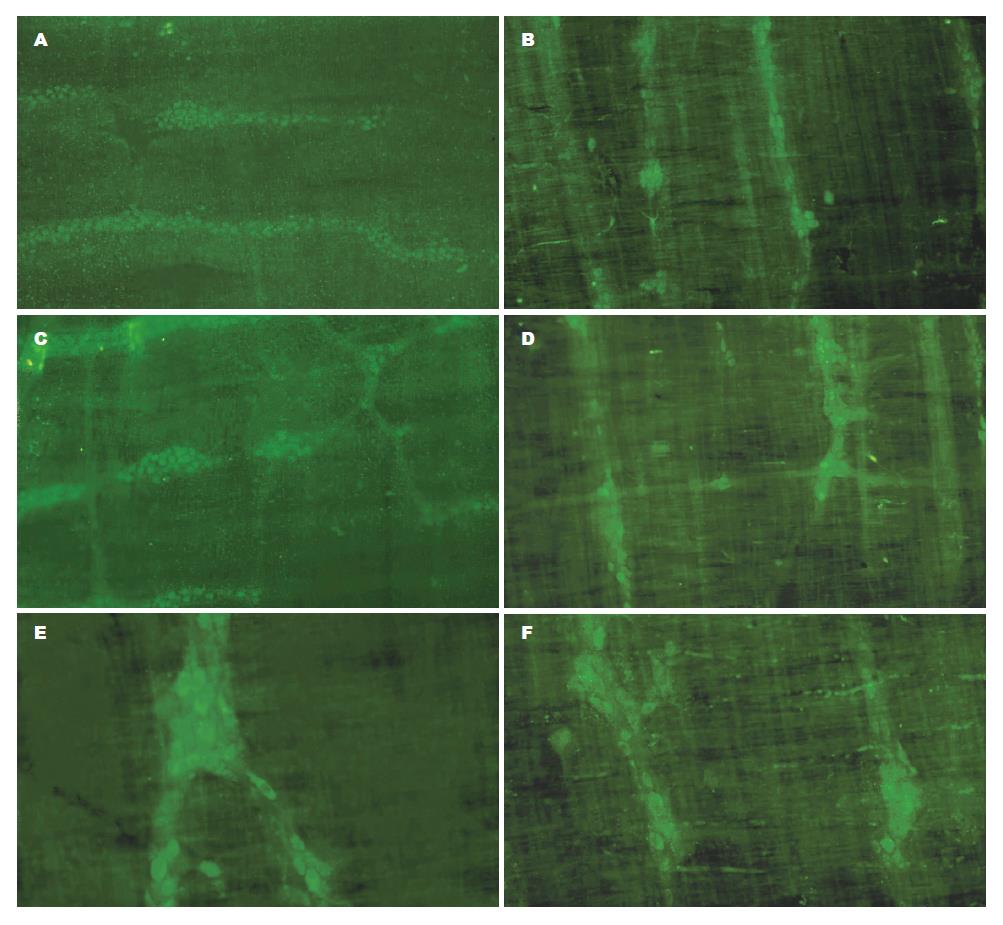
荧光显微镜下, 大鼠回肠肌间神经丛主要由神经结, 节间束和一些含膨体的神经纤维纵横交织呈网格状分布, 神经元胞体形态多样, 有卵圆形, 三角形及不规则形. 正常大鼠回肠肌间神经丛中的神经纤维呈"树根状"分布, 神经节粗大, 其中可见大小不等的神经元及突起, 节间束可见散在神经元, 通常每个神经元胞体有1条或多条长突起伸入节间束,但也可见到有的神经元胞体相互融合, 以及神经元的短突彼此连接, 构成神经元回路. 此外, 还可见神经元的短突末端分叉, 投射到附近神经元的胞体上(图3).
在200倍荧光显微镜下对阳性细胞计数, 每例随机选取5个高倍镜视野进行神经节及神经细胞计数发现实验组糖尿病大鼠回肠肌间神经丛中谷氨酸能神经和氮能神经的神经节体积较小, 散在分布的神经元少, 神经纤维较细. 差异有统计学意义(P<0.05, 表2, 图3).
糖尿病组较正常对照组回肠 mGluR1、mGluR5阳性细胞数量减少, 表达减弱, 荧光强度降低, 差异显著(P<0.05, 表3).
ENS是由胃肠道壁内(包括胰和胆囊内)所含的神经节及其间的网络组成的系统, 从食管到肛门的管壁内, 有一系列的神经丛, 共同组成ENS, 他是一个高度协调的神经集合, 具有明显的特征性, 类似于中枢神经系统(CNS). ENS主要由有神经节的神经丛和无神经节的神经丛这两个互相联系的神经丛组成复杂的肠壁内神经网络, 主要有肠肌间神经丛和黏膜下神经丛. 肠肌间神经丛位于纵肌和环肌之间, 围绕整个消化管的周围, 是由内部相互联系的小神经节组成的神经网络. ENS是调节小肠收缩活动的重要组成部分, ENS的神经元主要包括两部分: (1)胆碱能神经元, 是兴奋性神经元, 主要的神经递质为乙酰胆碱. (2)非肾上腺素非胆碱能神经元, 释放的递质主要有NO, 血管活性肠肽, 生长抑素等[5].
谷氨酸(Glu)是广泛存在于CNS中的一种兴奋性神经递质, Glu激活两种类型的受体, 离子型谷氨酸受体(iGluRs)和代谢型谷氨酸受体(mGluRs). 其中, mGluRs是一类和G蛋白偶联的调节离子通道和第二信使生成酶的特异型受体. 根据序列同源性、信号转导通路以及药理学特性, mGluRs可以分为3组, 第Ⅰ组(Group ⅠmGluRs)包括mGluR1和mGluR5[6]. 研究表明, mGluRs在中枢神经系统之外也有表达, 如在脊髓背根神经节, 味蕾, 胸腺, 视网膜、胰腺等都发现有其表达. 目前研究证实Glutamate也是存在于胃肠道中的一种重要的兴奋性神经递质, 谷氨酸受体在胃肠道ENS大量分布[7-8], 功能包括调节胃肠运动、参与胃肠内脏感觉的传入, 以及影响胃肠道的分泌等[9-10].
本研究选用♂大鼠, 运用高脂饮食加前腹腔注射STZ法进行糖尿病造模, 从发病机制上更接近临床上的2型糖尿病, 且造模成功率较高[4]. 通过制作小肠肌间神经丛铺片, 进行mGluR1、mGluR5受体免疫荧光染色发现, 在糖尿病大鼠的肌间神经丛的神经节及神经元数目较对照组明显减少, mGluR1、mGluR5受体表达降低, 荧光强度减弱. RT-PCR方法观察发现肌间神经丛mGluR1、mGluR5 mRNA表达较对照组减少, 由于目前发现的mGluR1、mGluR5主要存在于神经元上, 固可认为肌间神经丛mGluR1、mGluR5 mRNA表达的减少, 系由于神经元上的该物质减少所致. 以往研究发现, 肝硬化大鼠空肠和结肠肌间神经从的氮能和胆碱能神经元减少, 一氧化氮合酶和乙酰胆碱酯酶的活性均下降, 其所对应的神经元的功能下降[11], 另外, 雷亚宁 et al[12]用链脲佐菌素建立大鼠糖尿病模型, 发现糖尿病大鼠回肠肌间神经丛内胆碱能神经元的密度明显低于对照组, 而氮能神经节和氮能神经元的密度则明显高于对照组. 龙庆林 et al[13]用Karnovsky-Root直接法证明了糖尿病大鼠胃窦肌间神经丛胆碱能神经减少. 由于Glutamate也是存在于胃肠道中的一种重要的兴奋性神经递质, mGluR1、mGluR5与乙酰胆碱共同表达, 与乙酰胆碱具有协同作用[14], 因此从另一方面也证明糖尿病胃肠病变大鼠在胆碱能神经元的密度减少的同时也存在着谷氨酸受体的减少. 实验表明, 谷氨酸是重要的兴奋性神经递质, 能使胃肠道平滑肌去极化, 激活mGluR1, mGluR5可引起胃肠道平滑肌收缩, 促进胃肠蠕动[15], 因此肌间神经丛内谷氨酸能神经元减少势必引起肠蠕动减慢, 胃肠传输速率延迟. 通过本研究进一步证明糖尿病大鼠胃肠壁的肌间神经丛由于兴奋性递质受体mGluR1, mGluR5的减少, 导致胃肠道肌层兴奋性降低, 收缩减弱.
另外, 分子生物学研究表明mGluR1、mGluR5属于G蛋白偶联受体, 作用机制为通过活化磷脂酶C(PLC), 将膜内的磷酸肌醇(PI)水解为甘油二酯(DAG)和三磷酸肌醇(IP3), IP3作为第二信使可引起内源性Ca2+的释放. 神经元是一种可兴奋性细胞, 能迅速以一种可控制方式传递电化学信号, 神经元内对化学和电信号刺激做出反应的主要信使是Ca2+[16]. 因此当mGluR1、mGluR5受体表达减少, 使其配体作用于神经元上谷氨酸受体的作用减弱, 使Ca2+释放减少, 因此神经元的兴奋性降低, 从分子水平上证实了第Ⅰ组谷氨酸受体在ENS上的调节作用.
总之, 糖尿病胃肠病变大鼠胃肠动力明显减退, 其机制可能与肌间神经丛谷氨酸能神经损伤, mGluR1、mGluR5受体表达减少有一定关系.
谷氨酸(Glu)是广泛存在于中枢神经系统的一种神经递质, 与大脑的认知、疼痛, 内脏感觉等有关. Glu 激活两种类型的受体. 离子型受体(iGluRs)和代谢型受体(mGluRs). 最新的分子生物学分析发现, Glu不仅作用于中枢的一些神经核团, 调节胃肠功能, 而且还作用于一些外周的神经元组织和非神经元组织直接调节胃肠功能, 及参与胃肠内脏感觉的传入, 从而间接调节胃肠功能.
姜春萌, 教授, 大连医科大学附属第二医院消化科
在中枢神经系统中, 当Glu的释放异常时均可引起的神经损伤和神经元死亡这种作用被称为兴奋性毒性, 这在中枢神经系统中已得到公认, 兴奋性毒性引起的损伤包括坏死和凋亡, 通常被认为是由离子型受体和NMDA受体介导的. 近年来的研究认为代谢型谷氨酸受体(mGluRs)在兴奋性毒性的发生机制中起着重要的作用.
谷氨酸作为一种新的外周神经递质, 在消化系方面的研究较少. 本文首次研究其在糖尿病胃肠病变中的作用, 探讨其在胃肠动力疾病发生中的作用.
本研究可以为胃肠动力疾病的研究提供新的方向, 帮助我们更深入地了解一些胃肠道动力疾病的发病机制, 提供诊断和治疗的新思路,及提供新的药物作用靶点和选择用药的依据, 具有较强生理学意义和临床应用前景.
肠神经系统(ENS): 1921年英国生理学家Langley et al在研究哺乳动物胃肠道的神经支配时, 发现胃肠道有一个独立于中枢神经系统的神经结构, 并将其称之为ENS. 他包括大量神经节和无数神经纤维, 主要由分布于黏膜下和肌间神经丛的传入神经元、中间神经元和传出神经元及神经纤维组成, ENS中的肠神经节神经元是迷走神经和内脏神经传出神经通路的主要靶目标. 这些神经节中的运动神经元和感觉神经元对胃肠平滑肌细胞、腺体细胞及血管等效应器官活动起作用.
本研究内容较新, 设计合理, 统计方法恰当, 具有一定的参考价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Ordog T. Interstitial cells of Cajal in diabetic gastroenteropathy. Neurogastroenterol Motil. 2008;20:8-18. [PubMed] [DOI] |
| 2. | Talley NJ, Young L, Bytzer P, Hammer J, Leemon M, Jones M, Horowitz M. Impact of chronic gastrointestinal symptoms in diabetes mellitus on health-related quality of life. Am J Gastroenterol. 2001;96:71-76. [PubMed] [DOI] |
| 3. | Duby JJ, Campbell RK, Setter SM, White JR, Rasmussen KA. Diabetic neuropathy: an intensive review. Am J Health Syst Pharm. 2004;61:160-173; quiz 175-176. [PubMed] |
| 4. | Reed MJ, Meszaros K, Entes LJ, Claypool MD, Pinkett JG, Gadbois TM, Reaven GM. A new rat model of type 2 diabetes: the fat-fed, streptozotocin-treated rat. Metabolism. 2000;49:1390-1394. [PubMed] [DOI] |
| 5. | Furness JB. The enteric nervous system: normal functions and enteric neuropathies. Neurogastroenterol Motil. 2008;20 Suppl 1:32-38. [PubMed] [DOI] |
| 6. | Fagni L, Bockaert J. Effects of nitric oxide on glutamate-gated channels and other ionic channels. J Chem Neuroanat. 1996;10:231-240. [PubMed] [DOI] |
| 7. | Fairman WA, Vandenberg RJ, Arriza JL, Kavanaugh MP, Amara SG. An excitatory amino-acid transporter with properties of a ligand-gated chloride channel. Nature. 1995;375:599-603. [PubMed] [DOI] |
| 8. | Tong Q, Kirchgessner AL. Localization and function of metabotropic glutamate receptor 8 in the enteric nervous system. Am J Physiol Gastrointest Liver Physiol. 2003;285:G992-G1003. [PubMed] |
| 9. | Ren J, Hu HZ, Liu S, Xia Y, Wood JD. Glutamate receptors in the enteric nervous system: ionotropic or metabotropic? Neurogastroenterol Motil. 2000;12:257-264. [PubMed] [DOI] |
| 10. | Young RL, Page AJ, O'Donnell TA, Cooper NJ, Blackshaw LA. Peripheral versus central modulation of gastric vagal pathways by metabotropic glutamate receptor 5. Am J Physiol Gastrointest Liver Physiol. 2007;292:G501-G511. [PubMed] [DOI] |
| 14. | Kirchgessner AL, Liu MT, Alcantara F. Excitotoxicity in the enteric nervous system. J Neurosci. 1997;17:8804-8816. [PubMed] [DOI] |
| 15. | Kirchgessner AL. Glutamate in the enteric nervous system. Curr Opin Pharmacol. 2001;1:591-596. [PubMed] [DOI] |