修回日期: 2008-09-27
接受日期: 2008-10-07
在线出版日期: 2008-11-18
目的: 研究射频消融(RFA)与肝动脉栓塞(TAE)联合治疗VX2兔肝移植瘤的安全性.
方法: 将VX2肿瘤块植入实验兔的肝脏内, 建立兔肝癌模型. 将36只兔肝癌模型随机分为4组, 每组9只, A组行单纯RFA治疗, B、C、D组分别在TAE治疗后1、4、7 d行RFA治疗; 术前及术后检查实验兔肝、肾功能和存活情况.
结果: 实验兔术后出现精神萎靡、纳差、嗜睡, 以B组及C组最重, A组最轻. A组及D组无动物死亡, B、C组分别死亡3、2只. 各组ALT值均在治疗后第1天最高. A组(178.4±49.2 U/L)、D组(208.2±65.5 U/L)分别与B组(385.0±213.1 U/L)和C组(289.2±192.6 U/L)比较, 差异有统计学意义(P<0.05), B组与C组, D组与A组之间比较, 均无统计学意义; 各组治疗后4、7 d ALT值比较均无统计学意义. 各组UREA值组间比较差异也无统计学意义.
结论: 栓塞后1、4 d行射频治疗对肝脏功能将产生严重的影响, 栓塞后7 d进行射频治疗相对比较安全. 单纯射频及联合治疗对肾功能无明显影响.
引文著录: 李绍钦, 倪才方, 蒋国民, 陈珑. 射频消融联合肝动脉栓塞治疗兔肝癌的安全性. 世界华人消化杂志 2008; 16(32): 3677-3680
Revised: September 27, 2008
Accepted: October 7, 2008
Published online: November 18, 2008
AIM: To investigate the safety about the combined therapy of radiofrequency ablation (RFA) with transcatheter artery embolization (TAE) in rabbits with VX2 hepatic carcinoma.
METHODS: VX2 tumor tissues were implanted into the rabbit's liver to establish liver cancer model. Thirty-six rabbits with hepatic carcinoma were assigned to 4 groups randomly (n = 9). Group A received RFA treatment only; group B, C, D received TAE treatment 1, 4, 7 d prior to RFA treatment respectively. The ALT and UREA levels of the experimental rabbits were measured before and after each treatment.
RESULTS: Decreased appetite, drowsiness and dispiritedness were observed in the rabbits, especially in group B and C. No death was observed in group A and group D, but there were 3 deaths in group B and 2 deaths in group C. ALT levels were the highest at the first day in all groups. The difference was significant at the first day between group B (385.0 ± 213.1 U/L), C (289.2 ± 192.6 U/L) and A (178.4 ± 49.2 U/L), D (208.2 ± 65.5 U/L) respectively (P < 0.05), but not significant between group B and C, group A and D; There were no differences between each group at the 4th day and 7th day. No statistical significance in UREA levels was observed among the four groups.
CONCLUSION: RFA at 1, 4 d after TAE might impact liver function severely. RFA, is relatively safe at 7 d after TAE treatment. Combined therapy of RFA and TAE exerts no impact on renal function in all groups.
- Citation: Li SQ, Ni CF, Jiang GM, Chen L. Combined therapy of radiofrequency ablation with transcatheter artery embolization in rabbit model of hepatic carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(32): 3677-3680
- URL: https://www.wjgnet.com/1009-3079/full/v16/i32/3677.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i32.3677
肝动脉栓塞联合射频治疗可以扩大损毁范围, 提高肿瘤坏死率[1-3]. 此方法已在临床上开始应用, 并取得较好疗效[4-11]. 单纯行肝动脉栓塞或射频均会对肝脏有一定损害. 二者联合治疗的时间间隔对安全性有何影响? 目前临床上没有统一标准, 缺乏理论基础, 无大型动物肿瘤模型在此方面的实验报道. 我们期望通过动物实验研究初步阐明以上问题.
新西兰白兔36只, 雌雄不限, 体质量2.5-3.5 kg, 3-4月龄, 苏州大学动物实验中心提供; VX2瘤株为鳞状细胞癌, 由血液病研究所实验室冻存; 3F Progreat导管; 冷循环射频治疗仪, 针尖长2 cm的冷循环单极射频针. 仪器与设备DSA; 4排螺旋CT; 欧林巴斯显微镜及照相系统.
1.2.1 动物分组: VX2肿瘤肝脏种植成功后2 wk, 并经CT平扫及增强证实肿瘤直径2.0 cm左右. 将36只肝移植瘤兔分为4组, 每组9只: A组: 单纯RFA治疗; B组: 栓塞后1 d行射频治疗; C组: 栓塞后4 d行射频治疗; D组: 栓塞后7 d行射频治疗. 各组分别于治疗前、治疗后1、4、7 d抽取静脉血查肝肾功能.
1.2.2 动物模型制备: VX2肿瘤细胞复苏后, 接种于兔后腿肌肉组织内, 2 wk后剪取长出的肿瘤组织边缘部分, 剪至1 mm3左右的小块; 选取新西兰大白兔36只麻醉后, 四肢固定仰卧于CT机床台上, 上腹部及剑突周围脱毛后消毒. 18G穿刺针首先放入长约2-3 cm的1条明胶海绵条, 再放入2-3个准备好的组织块, 沿设定的穿刺位置、方向进针, 并CT扫描证实针尖的位置后(一般为肝左叶), 平头穿刺针芯将瘤块快速推入肝内(平头穿刺针芯伸出穿刺针约1.5 cm并重复2-3次). 拔出针具, 消毒穿刺点. 术后庆大霉素4万单位肌注, 连续3 d.
1.2.3 RFA治疗: 荷瘤兔麻醉后, 予以腹部、大腿及背部脱毛, 背部贴附一电极片后仰卧固定于金属车上, 金属车上亦贴附一电极片并与RFA 治疗仪的电极导线相连. 上腹部消毒铺巾后, 于上腹部偏左行4.0 cm左右的纵行切口, 切开后逐层分离, 暴露肝脏肿瘤; 肝脏周缘湿纱布遮盖以保护肝脏及相邻脏器; 将电极针插入肿瘤中央后射频10 min(功率25 W). 术毕逐层缝合切口, 庆大霉素腹腔内灌注. 术后继续给予庆大霉素4万单位肌注.
1.2.4 肝动脉造影及栓塞治疗: 荷瘤兔麻醉后, 股动脉区备皮消毒, 切开皮肤, 钝性分离股动脉, 股动脉切口近心端用缝线穿过其下方, 并轻轻提起, 用眼科剪在股动脉上方剪开长约2 mm的斜形切口; 在导丝引导下置入4F H1导管将导管送至L1水平造影, 找到腹腔动脉后超选至腹腔干动脉造影, 了解肝固有动脉走行及肿瘤供血情况后, 通过H1导管置入3F SP导管或3F Progreat导管, 超选至肝固有动脉并造影, 根据肿瘤大小、血供及染色情况, 注入适量碘化油,再次造影肿瘤染色基本消失. 术后给予预防感染、补液.
1.2.5 联合治疗: RFA及DSA肝动脉栓塞治疗方法如上所述; B组、C组、D组在TAE 1、4、7 d后行RFA. A组在RFA后及B组、C组、D组在TAE后及联合治疗后连续3 d行同样上述方法进行预防感染处理.
1.2.6 肝、肾功能检查: A组瘤兔在术前、RFA后1、4、7 d分别在耳缘静脉抽取2 mL静脉血,送生化室行丙氨酸氨基转移酶(谷丙转氨酶, ALT)、血清尿素(UREA)检查; 其余3组(B组、C组、D组)也分别在术前、TAE+RFA后第1、4、7天行ALT、UREA检查, 以了解肝、肾功能及其变化情况.
统计学处理 计量资料用mean±SD表示, 选用SPSS13.0统计软件, 统计方法采用完全随机分组设计的方差分析和LSD-t检验. 以P<0.05差异有统计学意义.
A组动物出现精神萎靡、纳差、嗜睡. 一般3 d后恢复正常; 联合治疗组上述症状更明显, 甚至部分动物出现拒食, B组、C组最显著. D组症状较A组稍明显, 但明显比B组及C组轻.
A组、D组没有动物死亡, B组、C组分别有3只、2只动物死亡, 均在联合治疗后24 h内死亡. 动物死亡后及时补充.
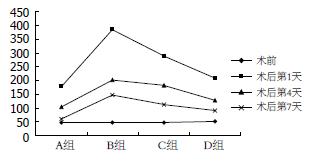
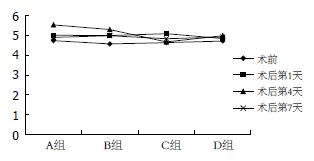
各组治疗后1 d ALT值比较: 各组动物治疗后ALT值均在第1天时最高, 4 d后明显下降, 其中以栓塞1 d后射频组(B组)在治疗后第1天升高幅度最大, 明显高于D组、A组栓塞后射频第1天, 差异有统计学意义(P<0.05), 与C组栓塞后射频第1天比较差异无统计学意义; 单纯射频组(A组)升高幅度最小, 下降速度最快. D组联合治疗后第1天与A组联合治疗后第1天ALT值比较差异无统计学意义; C组联合治疗后第1天与A组、D组联合治疗后第1天ALT值比较差异有统计学意义(P<0.05). 各组治疗后4、7 d ALT值比较: B组联合治疗后4、7 d ALT值仍较其他组联合治疗后第4天高(B组>C组>D组>A组), 但各组比较差异均无统计学意义(表1, 图1). 各组UREA值组间比较差异均无统计学意义(表2, 图2).
| A组 | B组 | C组 | D组 | F | P | |
| 术前 | 47.6±10.7 | 47.1±11.2 | 46.9±10.4 | 51.4±11.3 | 0.458 | 0.85 |
| 术后1 d | 178.4±49.2 | 385.0±213.1 | 289.2±192.6 | 208.2±65.5 | 5.645 | 0.02 |
| 术后4 d | 103.6±33.0 | 202.2±62.1 | 181.6±42.4 | 128.3±18.4 | 1.254 | 0.49 |
| 术后7 d | 60.4±15.6 | 147.2±23.4 | 113.8±95.8 | 90.7±48.1 | 2.012 | 0.34 |
| A组 | B组 | C组 | D组 | F | P | |
| 术前 | 4.74±0.94 | 4.57±0.74 | 4.64±0.49 | 4.72±0.63 | 1.321 | 0.84 |
| 术后1 d | 5.02±0.58 | 5.00±0.58 | 5.10±0.57 | 4.85±1.23 | 1.129 | 0.76 |
| 术后4 d | 5.84±0.43 | 5.30±1.62 | 4.68±0.68 | 5.00±1.43 | 1.254 | 0.69 |
| 术后7 d | 5.54±0.42 | 5.00±0.86 | 4.84±0.67 | 4.92±1.04 | 0.912 | 0.91 |
TAE[12]与RFA[13-14]均会对肝脏功能产生一定的破坏性影响, 一般1 d开始升高, 7 d后基本恢复正常[15-16]. 但RFA联合TAE会使ALT更明显的增高, 以B组联合治疗后第1天最明显, 与A组单纯射频后第1天比较差异均有统计学意义(P<0.001),与D组术后第1天相比差异亦有统计学意义(P<0.05), 但是与C组术后第1天比较差异无统计学意义; C组术后第1天与D组术后第1天ALT比较差异亦有统计学意义(P<0.05), D组术后第1天与A组术后第1天比较虽然有增加, 但差异亦无统计学意义, 而C组术后第1天与A组术后第1天比较差异有统计学意义(P<0.05). 而A、B、C、D组4 d及7 d后ALT比较差异均无统计学意义. 以上结果说明: 栓塞1、4 d后行射频治疗(B、C组)1 d在栓塞和射频双重打击下, 动物肝脏功能储备严重降低. 从各实验组动物治疗后4、7 d ALT比较差异均无统计学意义分析, 实验动物(特别对于B、C组)ALT恢复较快. 另外, 治疗后的动物死亡时间主要集中在24 h以内, 而24 h以后实验动物无死亡, 说明动物死亡和ALT增高密切相关.
动物死亡时间也是在B组和C组, 且为急性期死亡, 存活时间没有超过24 h, 考虑死亡原因主要为联合治疗创伤极大, 肝脏功能储备严重降低, 导致急性肝功能衰竭. 而TAE后7 d, 肝脏储备功能已经基本恢复, D组射频第1天ALT值与单纯射频第1天(R1)ALT值比较, 差异无统计学意义, 提示TAE后7 d行射频治疗是安全的.
总之, ALT升高的主要原因是TAE和RFA以及联合治疗均不可避免对正常肝脏造成一定的损害作用, 特别TAE和RFA联合治疗间隔时间短(少于7 d), 对肝脏功能会产生严重的破坏性, 而栓塞后7 d进行射频治疗相对比较安全; 所以, 在临床治疗中, 肝功能损害严重的患者应慎用此项治疗. 同时, 在临床上应重视治疗后肝功能的保护及支持治疗. 单纯射频及联合治疗对肾功能无明显影响.
肝动脉栓塞联合射频治疗可以扩大损毁范围, 提高肿瘤坏死率. 此方法已在临床上应用, 并取得较好疗效. 单纯行肝动脉栓塞或射频均会对肝脏有一定损害. 二者联合治疗的时间间隔对安全性有何影响, 有待进一步研究.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
目前临床上TACE后行RFA的时间间隔大多为0 d-4 wk, 文献报道两者间隔时间越短, 疗效越好, 但安全性越差.
通过动物实验, 我们得到初步结论, TACE后第7天行RFA疗效无明显影响, 安全性较高.
VX2兔鳞癌细胞株: 兔VX2肿瘤是世界上广泛使用、可在大型动物体内生长的恶性肿瘤, 常用于恶性肿瘤介入和射频治疗的研究及影像学研究和动物模型的建立.
本研究为临床进一步联合应用TACE与RFA的时间窗等相关问题提供了实验依据, 对临床有指导作用.
编辑: 李军亮 电编:郭海丽
| 1. | Lorentzen T, Christensen NE, Nolsle CP, Torp-Pedersen ST. Radiofrequency tissue ablation with a cooled needle in vitro: ultrasonography, dose response, and lesion temperature. Acad Radiol. 1997;4:292-297. [PubMed] [DOI] |
| 2. | Goldberg SN, Gazelle GS, Solbiati L, Rittman WJ, Mueller PR. Radiofrequency tissue ablation: increased lesion diameter with a perfusion electrode. Acad Radiol. 1996;3:636-644. [PubMed] [DOI] |
| 3. | Sugimori K, Morimoto M, Shirato K, Kokawa A, Tomita N, Saito T, Nozawa A, Hara M, Sekihara H, Tanaka K. Radiofrequency ablation in a pig liver model: effect of transcatheter arterial embolization on coagulation diameter and histologic characteristics. Hepatol Res. 2002;24:164. [PubMed] [DOI] |
| 4. | Goldberg SN, Kamel IR, Kruskal JB, Reynolds K, Monsky WL, Stuart KE, Ahmed M, Raptopoulos V. Radiofrequency ablation of hepatic tumors: increased tumor destruction with adjuvant liposomal doxorubicin therapy. AJR Am J Roentgenol. 2002;179:93-101. [PubMed] |
| 5. | Buscarini L, Buscarini E, Di Stasi M, Quaretti P, Zangrandi A. Percutaneous radiofrequency thermal ablation combined with transcatheter arterial embolization in the treatment of large hepatocellular carcinoma. Ultraschall Med. 1999;20:47-53. [PubMed] [DOI] |
| 6. | Lencioni R, Cioni D, Donati F, Bartolozzi C. Combination of interventional therapies in hepatocellular carcinoma. Hepatogastroenterology. 2001;48:8-14. [PubMed] |
| 7. | Curley SA, Izzo F, Delrio P, Ellis LM, Granchi J, Vallone P, Fiore F, Pignata S, Daniele B, Cremona F. Radiofrequency ablation of unresectable primary and metastatic hepatic malignancies: results in 123 patients. Ann Surg. 1999;230:1-8. [PubMed] [DOI] |
| 8. | Takaki H, Yamakado K, Nakatsuka A, Fuke H, Murata K, Shiraki K, Takeda K. Radiofrequency ablation combined with chemoembolization for the treatment of hepatocellular carcinomas 5 cm or smaller: risk factors for local tumor progression. J Vasc Interv Radiol. 2007;18:856-861. [PubMed] [DOI] |
| 9. | Yamakado K, Nakatsuka A, Takaki H, Yokoi H, Usui M, Sakurai H, Isaji S, Shiraki K, Fuke H, Uemoto S. Early-stage hepatocellular carcinoma: radiofrequency ablation combined with chemoembolization versus hepatectomy. Radiology. 2008;247:260-266. [PubMed] |
| 10. | Veltri A, Moretto P, Doriguzzi A, Pagano E, Carrara G, Gandini G. Radiofrequency thermal ablation (RFA) after transarterial chemoembolization (TACE) as a combined therapy for unresectable non-early hepatocellular carcinoma (HCC). Eur Radiol. 2006;16:661-669. [PubMed] [DOI] |
| 11. | Izzo F, Barnett CC Jr, Curley SA. Radiofrequency ablation of primary and metastatic malignant liver tumors. Adv Surg. 2001;35:225-250. [PubMed] |
| 13. | Yoshitani S, Hayashi K, Kuroda M, Tanaka Y, Hasegawa T, Saito H, Kosaka T, Takashima S. [Results of local ablation therapy for liver metastases from colorectal cancer using radiofrequency ablation and microwave coagulation therapy (RFA/MCT)]. Gan To Kagaku Ryoho. 2005;32:1666-1669. [PubMed] |
| 14. | Takeda Y, Hasuike Y, Kashiwazaki M, Shin E, Tsujinaka T. [Transdiaphragmatic radiofrequency ablation of malignant liver tumors]. Gan To Kagaku Ryoho. 2002;29:2229-2233. [PubMed] |