修回日期: 2008-10-16
接受日期: 2008-10-21
在线出版日期: 2008-11-18
目的: 探讨非酒精性脂肪性肝炎(NASH)患者肝脏转化生长因子β1(TGFβ1)和结缔组织生长因子(CTGF)的表达及二者在脂肪性纤维化发展过程中的相关性.
方法: 采用HE染色, 光镜下观察21例非酒精性脂肪性肝炎组(NASH组)肝组织和10例正常肝组织组标本肝组织的病理改变; RT-PCR及免疫组织化学技术分别检测以上两组标本中TGFβ1和CTGF的表达情况.
结果: 光镜下非酒精性脂肪性肝炎组出现明显炎症反应和纤维化. 免疫组化结果显示非酒精性脂肪性肝炎组肝脏TGFβ1和CTGF的表达显著高于正常肝脏组(109.52±4.50 vs 114.47±2.00, 117.07±3.60 vs 125.05±3.37, 均P<0.01). NASH组TGFβ1和CTGF mRNA的表达水平升高明显, 与对照组比较差异有统计学意义(0.66±0.07 vs 0.46±0.04, 0.59±0.08 vs 0.41±0.05, 均P<0.05).
结论: TGFβ1和CTGF在非酒精性脂肪性肝炎中的表达升高可能参与了脂肪性肝炎向肝纤维化转变, CTGF可能在诊断和治疗非酒精性脂肪性肝炎中扮演重要的作用.
引文著录: 但杰, 高鹏, 申力, 黄海云, 俞泽元. TGFβ1和CTGF在非酒精性脂肪性肝炎肝组织中的表达及意义. 世界华人消化杂志 2008; 16(32): 3637-3641
Revised: October 16, 2008
Accepted: October 21, 2008
Published online: November 18, 2008
AIM: To investigate the expression of connective tissue growth factor (CTGF) and transforming growth factorβ1 (TGFβ1) in non-alcoholic steatohepatitis hepatic tissue and to explore correlation between them during hepatic fibrosis.
METHODS: HE staining, RT-PCR and immunohistochemistry methods were used to measure TGFβ1 and CTGF mRNA expression levels in liver tissue of 21 patients with non-alcoholic steatohepatitis and 10 normal controls meanwhile hepatic histopathological changes were evaluated.
RESULTS: The optical microscopic analysis indicated that liver inflammation and fibrosis were apparently present in non-alcoholic steatohepatitis group (NASH group). And immunohistochemistry analysis revealed that the expressions of TGFβ1 and CTGF in hepatic tissue were significantly higher in NASH group than in normal control group (109.52 ± 4.50 vs 114.47 ± 2.00, 117.07 ± 3.60 vs 125.05 ± 3.37, both P < 0.01). TGFβ1 mRNA and CTGF mRNA expression were enhanced significantly in NASH group, compared with the control group (0.66 ± 0.07 vs 0.46 ± 0.04, 0.59 ± 0.08 vs 0.41 ± 0.05, both P < 0.05).
CONCLUSION: The enhanced expressions of TGFβ1 and CTGF in hepatic liver tissue of non-alcoholic steatohepatitis patients might be involved in fatty fibrosis. CTGF plays an important role in diagnosis and treatment of non-alcoholic fatty liver disease.
- Citation: Dan J, Gao P, Shen L, Huang HY, Yu ZY. Expression and its significance of connective tissue growth factor and transforming growth factorβ1 in hepatic tissues of non-alcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2008; 16(32): 3637-3641
- URL: https://www.wjgnet.com/1009-3079/full/v16/i32/3637.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i32.3637
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)是无过度饮酒史, 与脂质及糖代谢紊乱有关的肝脏疾病. 有报道证实12%-25%的NASH患者可发展为肝纤维化或肝硬化. 而转化生长因子β1(transforming growth factorβ1, TGF-β1)是目前已知最强的促肝纤维化的细胞因子及纤维化形成过程中重要的始动刺激因子之一[1]. 结缔组织生长因子(connectivetissue growth factor, CTGF)作为TGFβ1的下游效应递质, 介导了TGFβ1的促细胞外基质(ECM)积聚效应[2], 由于ECM合成和降解的失衡最终导致纤维化的发生. 本文通过检测NASH肝组织和正常肝脏组织中TGFβ1和CTGF的表达情况来对其在NASH向肝纤维化发生、发展的关系进行探讨.
研究对象均来自2007-07/2008-04在甘肃省人民医院普外科术前检查时发现符合非酒精性脂肪肝诊断标准[3], 经患者本人同意并签字, 并经医学伦理委员会同意, 行腹部手术时取得的标本21例, 其中男19例, 女12例, 年龄29-60(平均42±10)岁. 因外伤或良性肝肿瘤手术切除的正常肝组织10例. 其中男6例, 女4例, 年龄27-57(平均38±9)岁. 标本取得后迅速冰冻于-80℃的超低温冰箱中保存. 主要试剂: TGFβ1多抗(美国Santa Cruz产品)、CTGF多抗(北京博奥森生物技术有限公司)、逆转录试剂及PCR引物(上海生工生物工程技术服务有限公司)、PCR试剂(四川天泽基因工程有限公司), 其他PCR试剂为Promega产品.
1.2.1 病理组织学检查: 常规HE染色, 光镜下观察病理学变化. 脂肪肝病理组织学诊断参考中华医学会肝脏病学分会脂肪肝和酒精性肝病学组"非酒精性脂肪肝诊断标准"[3]. 根据肝小叶内脂肪变的肝细胞数将脂肪肝程度量化: 0分(肝细胞内无脂滴沉积); 1分(肝小叶内<30%的肝细胞有脂肪变); 2分(肝小叶内30%-50%的肝细胞有脂肪变); 3分(50%-75%的肝细胞有脂肪变); 4分(75%以上的肝细胞有脂肪变). 另外对肝组织炎症活动度和纤维化程度进行评分[4].
1.2.2 免疫组化染色: 采用SP法, 染色、操作按试剂盒说明书进行. 阴性对照用0.01 mmol/L的PBS代替一抗, 分别用试剂盒指定标本作阳性对照. 免疫组织化学结果判定标准: 用全自动医学图像彩色分析系统进行图像半定量分析, 测定肝组织中棕黄色阳性表达颗粒的灰度值, 该值越低表达越强.
1.2.3 RT-PCR检测TGFβl与CTGF mRNA表达: (1)总RNA提取: 从-80℃冰箱中取出300 mg肝组织, 加入TRIzol 1 mL, 并转移到匀浆器中, 将匀浆器置冰水上研磨, 转移研磨好的液体到无RNA酶和无DNA酶的1.5 mL离心管中. 然后加入0.2 mL氯仿, 温和震荡后, 4℃低温离心12 000 r/min; 吸取上层水相溶液并转移至另一新鲜的1.5 mL离心管, 加入等体积异丙醇(0.5 mL)颠倒混匀后室温静止15 min, 再次4℃低温离心12 000 r/min, l0 min, 弃上清, 然后加入700 mL/L乙醇l mL洗涤并干燥, 最后用DEPC处理水溶解RNA. 提取的总RNA经紫外分光光度计测定提取物的浓度, 各样本A260/280比值在1.8-2.0之间. (2)合成相关引物: 从相关资料获得所需引物[5-7], 并从基因库(GenBank)中进行核对, 引物序列如下: TGFβ1: 5'-CAGAAATACAGCAACAATTCCTGG-3'(sense); 5'-CAGTGTGTTATCCCTGCTGTC-3'(antisense); CTGF: 5'-CGACTGGAAGACACGTTTGG-3'(sense); 5'-AGGCTTGGAGATTTTGGGAG-3'(antisense); GAPDH: 5'-GAAGGTGAAGGTCGGAGTC-3'(sense); 5'-GAAGATGGTGATGGGATTTC-3'(antisense). (3)反转录反应: 取上面组织提取的总RNA约2 µg在下述反应体系中反转录成cDNA, 反应体系如下: 2.5 µmol/L oligd(t) 1 µL, 双蒸水9.5 µL 70℃预变性5 min后加入5×RT-Buffer 4 µL, 5 mmol/L dNTPs 2 µL, 20 U/µL RNAasin 1 µL, 然后加入M-MLV反转录酶200 U, 再42℃孵育1 h, 72℃加热10 min灭活反转录酶. (4)PCR扩增: 模板3 µL引物1 µL、双蒸水11 µL、绵阳天泽基因工程有限公司即用型PCR Magicmi×2.0 15 µL, 按说明书条件扩增. TGFβ1: 94℃变性1 min, 60℃退火 1 min, 72℃延伸1 min, 共30个循环反应; CTGF: 95℃变性30 s, 58℃退火20 s, 72℃延伸30 s, 共40个循环反应. (5)PCR反应产物10 µL在琼脂糖凝胶上电泳30 min(120 V), 图像分析仪采集图像, 以内参GAPDH为基准, 作半定量分析, 即以扩增目的片段/GAPDH的光密度比值代表所扩增目的基因片段的相对表达水平, 值越大表示TGFβ和CTGF表达水平越高.
统计学处理 数据用mean±SD表示, 两均数比较采用t检验. 所有统计采用SPSS10.0软件进行. P<0.05表示差异有统计学意义.
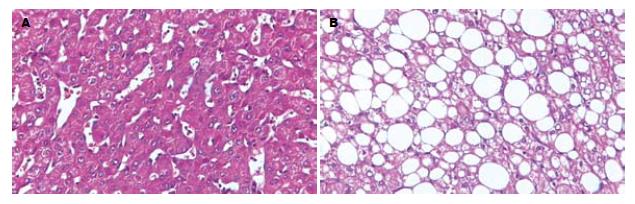
肝腺泡3区呈以大泡为主, 大小泡混合性脂肪变性、窦周纤维化、脂肪变性、周围肝细胞胞质疏松、气球样变性; 窦壁细胞增生较活跃, 窦腔内炎细胞浸润以单个核细胞为主, 随肝小叶内炎症程度的加重而重; 肝小叶内可见大核、双核肝细胞, 汇管区周围可见空泡核肝细胞, 凋亡小体偶见; 汇管区无明显炎细胞浸润及纤维化, 部分病例见纤维间隔及轻度界面炎(图1). NASH组在脂肪变性程度积分、炎症积分、纤维化积分与正常组相比都有显著差异(P<0.01, 表1).
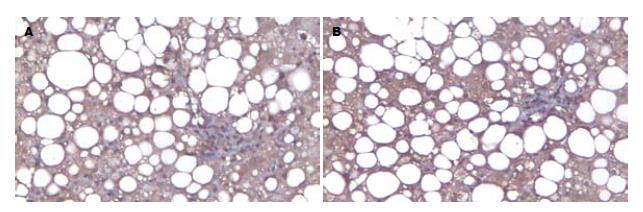
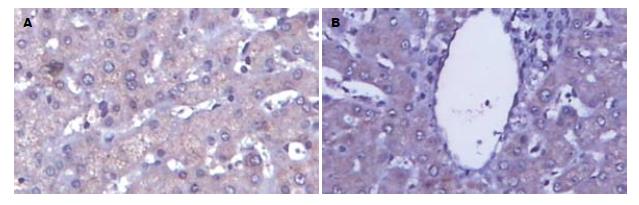
NASH肝组织TGF-β1染色阳性物质呈棕黄色, 在肝腺泡3带脂肪变性肝细胞附近、病变肝组织的炎症区、中央静脉周围、纤维化较明显的门管区及肝窦周Disse间隙的细胞外基质(ECM)沉积处及纤维间隔, 均可见明显的TGF-β1阳性染色. 肝组织内CTGF主要表达于汇管区和纤维间隔周围以及肝非实质细胞中, 偶见胆管上皮细胞呈阳性反应, 炎症明显的区域肝细胞胞质可见阳性染色(图2). 正常肝组织内无或仅有极少量表达(图3). 统计学分析表明, 两组间TGFβ1及CTGF表达差异有统计学意义(P<0.01, 表2).
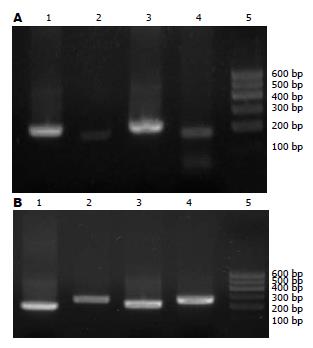
TGFβ1和CTGF的RT-PCR产物电泳结果示扩增片段分别为186 bp和250 bp, 与预期设计的目的片段相同, 正常组肝组织TGFβ1和CTGF mRNA的表达量较低(图4); NASH组TGFβ1和CTGF mRNA的表达水平升高明显, 差异有统计学意义(P<0.05, 表3).
NASH是非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)中的一种类型, 也是NAFLD出现重要病理损害, 启动向NASH相关性肝硬化进展的关键环节, 随着生活方式的改变, NASH在人群中的发病率也已经达到2%-3%[8]. 但其发病机制至今尚未完全明确, 目前认为与脂质代谢异常、氧应激及脂质过氧化反应等因素密切相关.
肝纤维化是以胶原为主的细胞外基质(ECM)合成增多, 而降解相对减少, 两者失去动态平衡而引起, 故过多ECM沉积于肝内时而引起, 是各种慢性肝病向肝硬化发展所共有的病理改变和必经途径. 而TGFβ1是调控肝纤维化发生、发展的核心物质[9].
TGFβ1是一组具有多种生物学功能的蛋白多肽, 对细胞的生长、分化和多种生理、病理过程起重要的调节作用. 他参与细胞周期的调控, 血管及胚胎的形成, 诱导细胞凋亡以及免疫调节等过程. 肝脏中多种细胞均可产生TGFβ1[10]. CTGF是最近分离出的一种生长因子, 具有与血小板衍生生长因子类似的生物学活性, 如促进趋化和有丝分裂, 其在许多组织器官纤维化时表达明显增高[11-13]. 实验研究认为, 星状细胞(HSC)是其主要来源, 而CTGF表达上调, 也是星状细胞活化的中心通道. 体外研究表明, TGFβ1可以特异性地诱导成纤维细胞产生CTGF, 并由后者作为下游效应介质作用于结缔组织, 刺激成纤维细胞增生和细胞外基质合成; 用反义技术抑制CTGF表达能明显降低TGFβ1诱导的细胞外基质的合成, 提示CTGF在TGFβ1导致的肝纤维化中起关键作用.
本研究应用免疫组化方法, 对NASH中TGFβ1的表达进行研究, 结果显示TGFβ1在NASH肝组织中的表达与炎症分级及纤维化程度明显相关, 随着肝脏炎症活动度及纤维化程度的加重而表达增强. 在肝窦壁及其周围, 可见较多带分支突起的梭形细胞内有阳性表达, 提示肝窦内皮细胞、星状细胞、枯否氏细胞是产生TGFβ1的主要细胞. 随着病变分级、分期上升, 其阳性部位主要是纤维间隔、炎症坏死区等纤维化发生的前沿部位, 偶见邻近肝细胞TGFβ1表达. 这种表达情况与慢性肝病由炎症发展为纤维化的进程相吻合, 即肝细胞损伤后炎细胞浸润, 浸润细胞分泌TGFβ1等细胞因子介导损伤部位修复, 导致纤维组织和纤维间隔形成, 证明TGFβ1有明显促肝脏纤维化形成的作用.
我们经免疫组化检测发现, CTGF在纤维化0期仅见于汇管区少量梭状间质细胞内, 表达水平很低, 随肝纤维化程度的增加, 表达的部位和范围呈增加趋势. 与TGFβ1的表达分布部位比较接近, 均以汇管区及纤维间隔等纤维形成的区域最明显. 说明CTGF确实同TGFβ1一样, 参与了肝纤维化的形成过程.
同时我们用RT-PCR方法检测了NASH组肝组织中TGFβ1和CTGF基因表达水平, 发现其表达较正常组显著增高. 且随纤维化程度加重, 与病理学分级呈正相关关系, 表明TGFβ1和CTGF 表达与肝纤维化形成、发展密切相关.
目前普遍认为TGFβ1是导致组织纤维化形成的最重要的细胞因子之一, 但其作用广泛、效应复杂, 正面效应的存在限制了抗TGFβ1抗体的应用, 单纯抑制其活性可能引起许多难以预料的副作用[14]例如去除TGFβ1基因的小鼠因失去对炎症过程的抑制, 而在出生后很快死于全身性炎症[15]. 在正常状态下CTGF表达水平很低, 而且主要在间质细胞中表达, 其作用亦限于结缔组织, 是一个更具特异性的靶位. 本实验证明非酒精性脂肪性肝炎中的二者的表达和正常组比较有显著差异, 而且CTGF随TGFβ1的升高而升高, 故推测CTGF在非酒精性脂肪性肝炎早期检测及在阻断向纤维化的进一步发展方面具有重要的作用.
非酒精性脂肪性肝炎(NASH)的发病与脂质代谢、胰岛素抵抗、氧应激及脂质过氧化反应等因素密切相关. 部分NASH患者最终可发展成为肝纤维化或肝硬化. 随着对其发病机制的深入研究, 人们渴望能在分子水平上找到阻断NASH进一步发展的方法.
张锦生, 教授, 复旦大学上海医学院病理学系
脂肪肝发展为肝纤维化的发病机制尚未完全搞清, 各条途径的多种细胞因子扮演的角色都是研究的热点, 但目前还未找到合适细胞因子能安全高效的运用临床实际中.
在正常状态下CTGF表达低, 作用范围较TGFβ1窄, 多只作用于结缔组织. 如果阻断CTGF的表达将会有效的阻断脂肪肝的发展进程而不会出现阻断TGFβ1所带来的严重后果.
本文用免疫组化和RT-PCR分别在蛋白和mRNA水平研究21例非酒精性肝炎穿刺肝组织中TGF-β1和CTGF表达的变化, 有一定参考价值.
编辑: 李军亮 电编:郭海丽
| 1. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 2. | 陆 翠毕, 华 国平, 王 华, 顾 美珍, 倪 润洲, 黄 介飞. 结缔组织生长因子与转化生长因子β1在肝纤维化组织中的表达. 南通大学学报(医学版). 2006;26:9l-93. |
| 5. | Deng YZ, Chen PP, Wang Y, Yin D, Koeffler HP, Li B, Tong XJ, Xie D. Connective tissue growth factor is overexpressed in esophageal squamous cell carcinoma and promotes tumorigenicity through beta-catenin-T-cell factor/Lef signaling. J Biol Chem. 2007;282:36571-36581. [PubMed] [DOI] |
| 6. | Higashi T, Sasagawa T, Inoue M, Oka R, Shuangying L, Saijoh K. Overexpression of latent transforming growth factor-beta 1 (TGF-beta 1) binding protein 1 (LTBP-1) in association with TGF-beta 1 in ovarian carcinoma. Jpn J Cancer Res. 2001;92:506-515. [PubMed] |
| 8. | Yu AS, Keeffe EB. Nonalcoholic fatty liver disease. Rev Gastroenterol Disord. 2002;2:11-19. [PubMed] |
| 9. | Roberts AB, Piek E, Bottinger EP, Ashcroft G, Mitchell JB, Flanders KC. Is Smad3 a major player in signal transduction pathways leading to fibrogenesis? Chest. 2001;120:43S-47S. [PubMed] [DOI] |
| 10. | Derynck R, Jarrett JA, Chen EY, Eaton DH, Bell JR, Assoian RK, Roberts AB, Sporn MB, Goeddel DV. Human transforming growth factor-beta complementary DNA sequence and expression in normal and transformed cells. Nature. 1985;316:701-705. [PubMed] [DOI] |
| 11. | Kasaragod AB, Lucia MS, Cabirac G, Grotendorst GR, Stenmark KR. Connective tissue growth factor expression in pediatric myofibroblastic tumors. Pediatr Dev Pathol. 2001;4:37-45. [PubMed] [DOI] |
| 12. | Ito Y, Goldschmeding R, Bende R, Claessen N, Chand M, Kleij L, Rabelink T, Weening J, Aten J. Kinetics of connective tissue growth factor expression during experimental proliferative glomerulonephritis. J Am Soc Nephrol. 2001;12:472-484. [PubMed] |
| 13. | Lasky JA, Ortiz LA, Tonthat B, Hoyle GW, Corti M, Athas G, Lungarella G, Brody A, Friedman M. Connective tissue growth factor mRNA expression is upregulated in bleomycin-induced lung fibrosis. Am J Physiol. 1998;275:L365-L371. [PubMed] |
| 14. | 赵 丽娟, 李 红, 杨 世杰. 黄芪注射液对D-半乳糖胺所致小鼠急性肝损伤的保护作用. 吉林大学学报(医学版). 2003;29:280-282. |
| 15. | Letterio JJ, Bottinger EP. TGF-beta knockout and dominant-negative receptor transgenic mice. Miner Electrolyte Metab. 1998;24:161-167. [PubMed] [DOI] |