修回日期: 2008-10-24
接受日期: 2008-10-27
在线出版日期: 2008-11-18
目的: 观察正常胃黏膜、肠上皮化生、异型增生和早期胃癌中抑癌基因PTEN的蛋白表达, 探讨PTEN表达在胃癌早期发生过程中的作用.
方法: 共收集57例病变, 按病理级别分为慢性胃炎伴肠上皮化生14例, 异型增生27例, 早期胃癌16例, 另取20例正常胃黏膜作为对照. 采用EnVision免疫组化方法检测各组黏膜中PTEN蛋白表达情况, 并分析其与临床病理特征的关系.
结果: PTEN在正常胃黏膜和肠上皮化生中全部表达, 在异型增生和早期胃癌中的阳性率分别为92.6%(25/27), 75.0%(12/16). PTEN在正常胃黏膜、肠上皮化生和异型增生三组间的表达无显著差异, 在早期胃癌中的表达较前三组明显降低(P<0.05). PTEN表达强度与病理级别呈明显的负相关(r = -0.488, P<0.01). PTEN蛋白表达与患者年龄、性别、病变部位及H. pylori感染无关(P>0.05), 但与血清CEA水平显著相关(P = 0.001).
结论: 作为一种具有磷酸酶活性的抑癌基因, PTEN蛋白低表达在胃癌早期发生过程中发挥着重要的作用.
引文著录: 张斌, 曹俊, 周强, 陈洁宇, 邹晓平. PTEN蛋白在早期胃癌和癌前病变中的表达及与临床病理特征的相关性. 世界华人消化杂志 2008; 16(32): 3626-3630
Revised: October 24, 2008
Accepted: October 27, 2008
Published online: November 18, 2008
AIM: To investigate the correlation of phosphatase and tensin homolog deleted on chromosome ten (PTEN) protein expression and clinicopathological features in the precancerous lesions and early gastric cancer, and to explore its clinical implication in early development of gastric cancer.
METHODS: A series of 20 normal gastric mucosal samples, 14 intestinal metaplasia (IM), 27 dysplasia and 16 early gastric carcinomas were examined for the expression of PTEN using EnVision immunohistochemistry. Correlation between PTEN expression and clinicopathological features was analyzed.
RESULTS: The positive rates of PTEN protein were 100% (20/20), 100% (14/14), 92.6% (25/27) and 75.0% (12/16) in normal gastric mucosa, IM, dysplasia and early gastric carcinoma, respectively. The positive rate of PTEN protein expression was significantly lower in early gastric carcinoma than the other three groups (P < 0.05). PTEN protein expression level was negatively correlated with the pathological severity(r = -0.488, P < 0.01). The expression of PTEN was markedly associated with the serum CEA level (P = 0.001), but not with age, sex, H. pylori infection or with location of lesions (P > 0.05).
CONCLUSION: PTEN, a tumor suppressor gene with phosphatase activity, plays an important role in the early carcinogenesis of gastric carcinoma owe to its reduced expression.
- Citation: Zhang B, Cao J, Zhou Q, Chen JY, Zou XP. Correlation between PTEN protein expression and clinicopathological features in the precancerous lesions and early gastric cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(32): 3626-3630
- URL: https://www.wjgnet.com/1009-3079/full/v16/i32/3626.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i32.3626
胃癌是全球最常见的恶性肿瘤之一, 位居恶性肿瘤死因的第2位, 在我国则占恶性肿瘤死亡率的第1位. 随着人们对胃癌发病机制和生物学行为不断深入的研究, 发现胃癌的发生进展常伴有癌基因的激活和抑癌基因的失活. PTEN(phosphatase and tensin homolog deleted on chromosome ten)是1997年Li和Steck et al几乎同时报道的位于染色体10q23.3上的基因[1-2], 是迄今为止发现的第1个具有磷酸酶活性的抑癌基因, 不仅参与细胞周期调控, 而且控制细胞正常发育, 在许多肿瘤组织、肿瘤细胞株以及多种肿瘤相关综合征中都存在该基因的突变[3-6]. 目前对胃癌组织尤其是早期胃癌和癌前病变组织中PTEN蛋白表达研究较少, 且结论尚不一致. 本研究利用免疫组化方法检测57例早期胃癌和癌前病变组织及20例正常胃黏膜中PTEN蛋白表达的情况, 旨在探讨其在胃癌临床病理中的意义.
收集南京大学医学院附属鼓楼医院消化科2005-06/2008-01内镜黏膜切除术(endoscopic mucosal resection, EMR)切除标本和常规胃镜活检蜡块存档: 活检证实为慢性胃炎伴肠上皮化生14例, 另有43例患者经透明帽法进行黏膜切除[7], 为排除药物及内镜操作对蛋白表达可能产生的影响, 仅取首次切除的43例病变纳入本研究, 按术后病理级别分为: 异型增生27例, 早期胃癌16例. 57例患者分为: 男40例, 女17例, 年龄42-80(平均65.2±9.2)岁, 所有患者均未接受放化疗及免疫治疗. 40例患者经快速尿素酶法检测H. pylori, 阳性12例, 阴性28例. 35例患者检测了血清CEA, 9例超过正常范围, 余26例均正常. 20例正常胃黏膜组织取自20名来自门诊的健康志愿者. 本实验获所有患者知情同意. 即用型小鼠抗人PTEN mAb购自北京中杉金桥生物技术有限公司, 免疫组化试剂盒及DAB显色试剂盒均购自福州迈新(Maixin)生物技术有限公司.
1.2.1 免疫组化检测: 采用EnVision染色方法, 4 mm厚切片常规脱蜡至水, 高压抗原热修复(1 mmol/L EDTA, pH8.0), 山羊血清封闭后依次滴加一抗4℃过夜, 生物素化二抗室温孵育30 min, DAB显色, 苏木素衬染后封片. 用PBS代替一抗平行操作染色做阴性对照, 用经反复验证的已知阳性片做阳性对照.
1.2.2 结果判定标准: 以细胞质出现棕黄色颗粒为PTEN阳性表达细胞. 每张切片随机观察10个高倍视野(×400), 计数阳性细胞与总细胞的比值. 阳性细胞数<5%为阴性(-), 5%-25%为弱阳性(+), 25%-50%为阳性(++), >50%为强阳性(+++).
统计学处理 采用非参数检验(Kruskal-Wallis Test和Mann-Whitney U Test)对各组病变PTEN表达的差异进行检验; 采用Spearman等级相关分析蛋白表达与病理级别间的相关性; 对性别、年龄等的组间差异用χ2检验和Fisher确切概率法进行检验; 应用Logistic回归进行多因素分析. 所有数据均在SPSS13.0软件包中进行分析, P<0.05为差异有统计学意义.
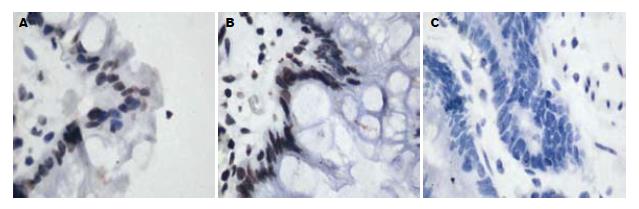
PTEN免疫组化阳性产物呈棕黄色细颗粒状, 主要定位于细胞质中(图1), 细胞核和细胞膜几乎不着色. PTEN在正常胃黏膜和肠上皮化生中全部表达, 在异型增生和早期胃癌中的表达呈递减趋势(表1), 分别为92.6%(25/27)、75.0%(12/16). PTEN在正常胃黏膜、肠上皮化生和异型增生三组间的表达无显著差异, 在早期胃癌中的表达则显著降低, 与前三组比较差异有统计学意义(P<0.05). PTEN表达强度与病理分级的关系采用Spearman等级相关分析, 结果两者呈明显的负相关(r = -0.488, P<0.01).
PTEN蛋白表达与患者的年龄、性别、H. pylori感染均无显著相关, 与患者血清CEA水平和病变部位有密切联系(P<0.05, 表2). 应用Logistic逐步回归分析方法筛选相关因素, 血清CEA水平和病变部位最终进入Logistic回归模型. Wald检验结果表明, 血清CEA水平对PTEN蛋白表达有意义(P = 0.003), 血清CEA水平正常患者的病变PTEN蛋白表达较CEA升高者高, OR值为e2.835 = 17.030. 经过分析表明病变部位对PTEN蛋白表达并无意义(P = 0.179, 表3)
| 分组 | n | PTEN表达情况 | P | |||
| - | + | ++ | +++ | |||
| 年龄 | 0.601 | |||||
| <60 | 18 | 2 | 4 | 9 | 3 | |
| ≥60 | 39 | 4 | 15 | 12 | 8 | |
| 性别 | 0.288 | |||||
| 男 | 40 | 4 | 16 | 13 | 7 | |
| 女 | 17 | 2 | 3 | 8 | 4 | |
| H. pylori | 0.538 | |||||
| + | 12 | 3 | 1 | 7 | 1 | |
| - | 28 | 3 | 9 | 8 | 8 | |
| CEA水平 | 0.001 | |||||
| 正常 | 26 | 1 | 7 | 8 | 10 | |
| 升高 | 9 | 3 | 5 | 1 | 0 | |
| 病变部位 | 0.044a | |||||
| 胃角 | 15 | 2 | 2 | 7 | 4 | |
| 胃体 | 20 | 4 | 10 | 3 | 3 | |
| 胃窦 | 22 | 0 | 7 | 11 | 4 | |
| 进入变量 | Estimate | Std. Error | Wald | u | P |
| 病变部位 | 1.099 | 0.818 | 1.804 | 1 | 0.179 |
| CEA水平 | 2.835 | 0.940 | 9.097 | 1 | 0.003 |
胃癌的发生发展是一个多阶段、连续性的过程, 一般而言, 要经历慢性胃炎→胃黏膜萎缩肠化→异型增生→胃癌这一动态过程, 常伴有癌基因的激活和抑癌基因的失活. 抑癌基因PTEN编码的蛋白具有双特异性磷酸酶活性, 能使PIP3去磷酸化而抑制(PI3K)/Akt(pAkt)信号传导途径, 在调控细胞生长及维持细胞的增殖、分化和凋亡平衡中起重要作用[8]. PTEN基因突变则导致其磷酸酶活性下降, 细胞恶性增殖能力和迁移能力增强, 并抑制细胞凋亡. Kang et al[9]对310例胃癌组织进行免疫组织化学分析, 发现有62例(20%)PTEN失表达, 而且瘤体越大、浸润越深、有淋巴结转移及预后不良者PTEN蛋白表达的阳性率越低, 提示PTEN蛋白的失表达与胃癌的发生、发展及预后密切相关. 国内Zheng et al[10]检测了胃癌及癌旁黏膜、肠上皮化生和异型增生中的PTEN蛋白表达, 结果PTEN蛋白在异型增生和胃癌中的阳性表达率(66.7%和47.8%)显著低于癌旁黏膜和肠上皮化生(100%和98.5%)(P<0.01), 进展期胃癌PTEN表达显著低于早期胃癌(42.9% vs 67.6%, P<0.01), 表明PTEN在胃癌发生发展不同阶段的表达呈递减趋势, 李异玲 et al[11-12]的研究也得出相似结论, 提示PTEN蛋白表达水平可作为判定胃癌病理生物学行为的客观指标. 但另一些研究却提出相反的观点: Sato et al[13]检测58例原发性胃癌中仅1例(1.7%)在内含子7区有5个碱基对缺失, 但无mRNA序列的改变, 因此认为PTEN基因的突变、缺失在胃癌的发生、发展中并不起主要作用. 另一项研究也表明PTEN基因的突变率在进展期胃癌中并没有显著性的提高, 提示PTEN基因并没有作为一种抑癌基因而参与胃癌的形成和进展[14]. 本研究采用免疫组化方法检测正常黏膜、肠上皮化生、异型增生和早期胃癌4个阶段的黏膜中PTEN蛋白的表达情况, 发现PTEN蛋白的表达随病理级别增加也呈递减趋势, 两者呈显著的负相关. PTEN蛋白在正常黏膜和肠上皮化生中全部表达, 在异型增生中也仅有轻度缺失, 三组间无明显差异(P>0.05); 在早期胃癌中的表达明显降低, 仅75.0%, 显著低于前三组黏膜中的阳性率(P<0.05), 结果表明PTEN基因失表达是胃癌发生的早期分子事件, 在胃癌前病变进展至胃癌的过程中起着重要的作用.
国内Deng et al[15]的研究表明PTEN蛋白在胃癌组织中的表达与患者的年龄、性别及病变大小无关, 但与病变浸润深度和分化程度相关(P = 0.02). 我们的研究也表明在胃癌前病变和早期胃癌阶段中PTEN表达与患者的年龄、性别及病变部位无关, 与患者是否感染H. pylori也无明显相关性. Colakoglu et al[16]的研究表明结肠癌组织中pAkt蛋白的表达与患者术前的血清CEA水平密切相关, 既然PTEN基因的突变可以导致pAkt信号通路的失活, 那么PTEN蛋白表达是否也与血清CEA水平存在相关性便值得进一步探讨. 本研究中我们采用Logistic逐步回归分析方法分析, 结果表明血清CEA水平对PTEN蛋白表达有意义(P = 0.003), 血清CEA水平正常患者的病变中PTEN蛋白表达阳性率较CEA升高者高.
总之, PTEN作为一种具有磷酸酶活性的抑癌基因, 在胃癌早期发生过程中发挥着重要的作用. 不过由于内镜取材的特殊性和局限性, 本研究未能探讨PTEN蛋白表达与胃癌淋巴结转移、TNM分期等因素之间的关系. 已有报道表明PTEN低表达是结直肠癌复发的独立危险因子[16], 但是在胃癌中情况如何还无从知晓. 另外, PTEN基因在早期胃癌及癌前病变阶段中是如何起作用的? 其失活机制又如何? 是否可以使人工调节PTEN基因表达水平及体外干涉PTEN作用通路成为逆转癌前病变从而限制其向胃癌转化的新靶点? 此类问题还有待于继续积累资料进行更深入的研究.
胃癌是全球最常见的恶性肿瘤之一, 抑癌基因的失活是胃癌常见的遗传学改变, 可能是胃癌发生的早期分子事件. 近年来的研究发现, PTEN在许多肿瘤组织、肿瘤细胞株以及多种肿瘤相关综合征中都存在突变, 与肿瘤的浸润及转移关系密切.
杜雅菊, 主任医师, 哈尔滨医科大学附属第二医院消化内科
近年来对胃癌尤其是早期胃癌和癌前病变中PTEN基因突变情况研究较少, 且结论尚不一致, 有待于进一步研究.
国内外多项研究报道均提示PTEN蛋白的失表达与胃癌的发生、发展及预后密切相关, 提示PTEN蛋白表达水平可作为判定胃癌病理生物学行为的客观指标. 但另一些研究却表明PTEN基因的突变、缺失在胃癌的发生、发展中并不起主要作用, PTEN基因并未作为一种抑癌基因参与胃癌的形成和进展.
本研究采用EnVi sion免疫组化方法检测经内镜活检和黏膜切除并经严格病理组织学诊断的正常胃黏膜、肠上皮化生、异型增生和早期胃癌中PTEN蛋白表达情况, 并分析其与临床病理特征的关系. 结果表明PTEN蛋白低表达在胃癌早期发生过程中起着重要作用.
通过检测PTEN蛋白表达水平, 可以早期诊断胃癌, 判断预后; 同时也为通过人工调节PTEN基因表达水平及体外干涉PTEN作用通路来逆转癌前病变并限制其向胃癌转化提供了理论基础.
本研究发现作为一种具有磷酸酶活性的抑癌基因PTEN在胃癌早期发生过程中发挥着重要的作用, 为胃癌早期诊断提供了依据.
编辑: 李军亮 电编:何基才
| 1. | Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science. 1997;275:1943-1947. [PubMed] [DOI] |
| 2. | Steck PA, Pershouse MA, Jasser SA, Yung WK, Lin H, Ligon AH, Langford LA, Baumgard ML, Hattier T, Davis T. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet. 1997;15:356-362. [PubMed] [DOI] |
| 3. | Sansal I, Sellers WR. The biology and clinical relevance of the PTEN tumor suppressor pathway. J Clin Oncol. 2004;22:2954-2963. [PubMed] [DOI] |
| 4. | Butler MG, Dasouki MJ, Zhou XP, Talebizadeh Z, Brown M, Takahashi TN, Miles JH, Wang CH, Stratton R, Pilarski R. Subset of individuals with autism spectrum disorders and extreme macrocephaly associated with germline PTEN tumour suppressor gene mutations. J Med Genet. 2005;42:318-321. [PubMed] [DOI] |
| 5. | Tate G, Suzuki T, Endo Y, Mitsuya T. A novel mutation of the PTEN gene in a Japanese patient with Cowden syndrome and bilateral breast cancer. Cancer Genet Cytogenet. 2008;184:67-71. [PubMed] [DOI] |
| 6. | Pezzolesi MG, Li Y, Zhou XP, Pilarski R, Shen L, Eng C. Mutation-positive and mutation-negative patients with Cowden and Bannayan-Riley-Ruvalcaba syndromes associated with distinct 10q haplotypes. Am J Hum Genet. 2006;79:923-934. [PubMed] [DOI] |
| 8. | Cantley LC, Neel BG. New insights into tumor suppression: PTEN suppresses tumor formation by restraining the phosphoinositide 3-kinase/AKT pathway. Proc Natl Acad Sci U S A. 1999;96:4240-4245. [PubMed] [DOI] |
| 9. | Kang YH, Lee HS, Kim WH. Promoter methylation and silencing of PTEN in gastric carcinoma. Lab Invest. 2002;82:285-291. [PubMed] |
| 10. | Zheng HC, Chen Y, Kuang LG, Yang L, Li JY, Wu DY, Zhang SM, Xin Y. [Expression of PTEN-encoding product in different stages of carcinogenesis and progression of gastric carcinoma]. Zhonghua Zhongliu Zazhi. 2003;25:13-16. [PubMed] |
| 11. | 李 异玲, 何 向民, 郑 华川, 吴 东瑛, 杨 雪飞, 辛 彦, 傅 宝玉. 胃黏膜癌变过程中PTEN基因编码产物的表达及意义. 世界华人消化杂志. 2003;11:1294-1296. [DOI] |
| 13. | Sato K, Tamura G, Tsuchiya T, Endoh Y, Sakata K, Motoyama T, Usuba O, Kimura W, Terashima M, Nishizuka S. Analysis of genetic and epigenetic alterations of the PTEN gene in gastric cancer. Virchows Arch. 2002;440:160-165. [PubMed] [DOI] |
| 14. | Wang JY, Huang TJ, Chen FM, Hsieh MC, Lin SR, Hou MF, Hsieh JS. Mutation analysis of the putative tumor suppressor gene PTEN/MMAC1 in advanced gastric carcinomas. Virchows Arch. 2003;442:437-443. [PubMed] |
| 15. | Deng H, Wu RL, Zhou HY, Huang X, Chen Y, Liu LJ. Significance of Survivin and PTEN expression in full lymph node-examined gastric cancer. World J Gastroenterol. 2006;12:1013-1017. [PubMed] |
| 16. | Colakoglu T, Yildirim S, Kayaselcuk F, Nursal TZ, Ezer A, Noyan T, Karakayali H, Haberal M. Clinicopathological significance of PTEN loss and the phosphoinositide 3-kinase/Akt pathway in sporadic colorectal neoplasms: is PTEN loss predictor of local recurrence? Am J Surg. 2008;195:719-725. [PubMed] [DOI] |