修回日期: 2008-10-22
接受日期: 2008-10-27
在线出版日期: 2008-11-18
目的: 探讨人血管生成素-1(angiopoietin-1, Ang1)对体外培养的人胃癌细胞MGC-803所产生的凋亡抑制作用的可能机制.
方法: 以适当感染复数(MOI = 20)的重组腺病毒Ad-Ang1和对照病毒Ad-GFP感染人胃癌细胞, 对照组用无血清培养基培养, 并分别通过RT-PCR、Western blot方法检测Bcl-2及Bax mRNA和蛋白的表达.
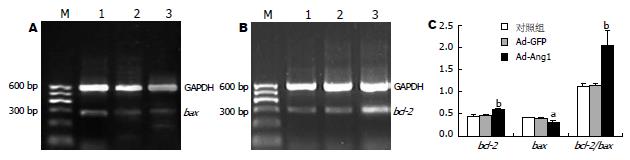
结果: Bcl-2 mRNA和蛋白的表达量在Ad-Ang1组中明显高于Ad-GFP组及对照组(0.609±0.01 vs 0.462±0.02, 0.609±0.01 vs0.475±0.02, 均P<0.05), Ad-GFP组与对照组相比无显著性差异; 而Ad-Ang1组的Bax mRNA和蛋白的表达量则低于Ad-GFP组及对照组(0.313±0.04 vs 0.413±0.02, 0.313±0.04 vs 0.407±0.03, 均P<0.05), 后两组相比无显著性差异; Bcl-2/Bax比值在Ad-Ang1组中也明显增高.
结论: Ang1基因转染体外培养的人胃癌细胞后, 不论是在转录水平还是在翻译水平均上调了细胞Bcl-2的表达, 同时使Bax表达下调, Bcl-2/Bax比值增大, 此途径可能为Ang1抑制血浆饥饿所诱导的肿瘤细胞凋亡的机制之一.
引文著录: 欧希龙, 颜芳, 关云艳, 孙为豪, 杨柳, 陈国胜, 产松苗, 陈宝安. 血管生成素-1对人胃癌细胞Bcl-2和Bax表达的影响. 世界华人消化杂志 2008; 16(32): 3605-3609
Revised: October 22, 2008
Accepted: October 27, 2008
Published online: November 18, 2008
AIM: To explore the possible mechanism underlying the inhibitory effect of angiopoietin-1 (Ang1) on apoptosis of human gastric cancer cells MGC-803.
METHODS: The human gastric cancer cells (MGC-803) were cultured with Ad-Ang1 and Ad-GFP at proper multiplicity of infection (MOI = 20) and the expression levels of bcl-2 mRNA, bax mRNA and Bcl-2 protein, Bax protein were determined using RT-PCR and Western blot, respectively.
RESULTS: The expression levels of Bcl-2 mRNA and its protein were higher in Ad-Ang1 transfected group than in Ad-GFP transfected group and control group (0.609 ± 0.01 vs 0.462 ± 0.02, 0.609 ± 0.01 vs 0.475 ± 0.02, both P < 0.05). There was no significant difference between Ad-GFP group and control group. However, compared with the other groups, the expression level of Bax mRNA and its protein in the MGC-803 cells treated with Ad-Ang1 were significantly down-regulated (0.313 ± 0.04vs 0.413 ± 0.02, 0.313 ± 0.04 vs 0.407 ± 0.03, both P < 0.05). Meanwhile, the ratio of Bcl-2 to Bax increased markedly in Ad-Ang-1 transfected group.
CONCLUSION: Ang1 gene can significantly up-regulate Bcl-2 expression and down-regulate Bax expression at both transcriptional and translational levels in vitro, which may be one of mechanisms underlying protection against serum starvation-induced apoptosis.
- Citation: Ou XL, Yan F, Guan YY, Sun WH, Yang L, Chen GS, Chan SM, Chen BA. Effect of angiopoietin-1 on expression of Bcl-2 and Bax in human gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(32): 3605-3609
- URL: https://www.wjgnet.com/1009-3079/full/v16/i32/3605.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i32.3605
血管生成这一复杂过程是由很多促血管生成因子所调控的. 目前认为血管内皮生长因子(vascular endothelial growth factor, VEGF)和血管生成素(angiopoietin, Ang)是调节血管生成的重要因子, 他们组成一个系统而发挥作用. Ang家族成员包括Ang1、Ang2、Ang3和Ang4, 由于前两者和血管生成关系密切, 因而倍受关注. 资料显示在多种肿瘤组织中均有Ang1及其受体Tie-2表达增加, 特别是在肿瘤边缘的血管新生区. 随后研究证实在有VEGF存在的情况下, Ang1和Tie-2结合后具有抑制血管渗漏、维持血管完整性的作用[1], 并由此认为Ang1对肿瘤发生、发展的影响是通过血管机制实现的. 在前期实验中为了探讨Ang1对肿瘤细胞是否有直接的作用, 我们以腺病毒为载体, 将Ang1基因导入体外培养的人胃癌细胞株MGC-803中, 并已证实Ang1具有抑制血浆饥饿诱导细胞凋亡的作用, 为进一步探讨其可能的机制, 我们分别利用RT-PCR及Western blot检测Bcl-2和Bax mRNA及蛋白水平的表达.
人胃腺癌细胞株MGC-803购自中科院, 复制缺陷型腺病毒重组体Ad-Ang1及对照病毒Ad-GFP由南京医科大学第一附属医院构建[2]并赠送. 焦碳酸二乙酯(DEPC)水、溴化乙锭(EB)、TRIzol试剂为美国Sigma公司产品, RT-PCR试剂盒购自日本TaKaRa公司, DNA小分子量Marker购自北京天为时代公司, β-actin鼠抗人mAb为Sigma公司生产, Bcl-2和Bax鼠抗人mAb购自Santa Cruz公司, 硝酸纤维素膜和ECL发光剂分别购自美国Bio-Rad公司和GE公司, IgG-HRP二抗为北京中山金桥生物技术公司产品.
1.2.1 细胞培养: 实验分为对照组、Ad-GFP组和Ad-Ang1组, 以细胞浓度为2.0×108/L, 分别接种于3个培养瓶(50 mL)中, 于60%-70%细胞贴壁时对后两组予相应的无血清无抗生素培养液稀释的病毒液3 mL感染(感染复数与前期实验相同, MOI = 20), 对照组用无血清培养基培养, 8 h后换100 mL/L胎牛血清的RPMI 1640培养液继续培养, 36 h后行下列相应检查.
1.2.2 RT-PCR检测bcl-2 mRNA和bax mRNA的表达: 以1 mL TRIzol试剂分别提取上述3组总RNA, 并于完整性鉴定后进行逆转录, 反应体系为20 µL, 具体如下: RNA Free H2O 7.5 µL, MgCl2 4 µL, 10×RT Buffer 2 µL, dNTP 2 µL, OligodT 1 µL, RNA酶抑制剂0.5 µL, AMV 1 µL, RNA样品2 µL. 反应参数: 45℃ 30 min, 99℃ 5 min, 4℃ 5 min, 反应产物立即扩增或-20℃冻存. 引物及其反应步骤见表1. PCR反应体系包括3 µL cDNA, 目的基因及内参的上下游引物(20 µmol/L)各0.75 µL, MgC12 1 µL, 5×PCR Buffer 5 µL, Taq酶0.25 µL, 灭菌蒸馏水12.75 µL. 将上述各成分加入200 µL薄壁PCR管中, 瞬时离心, 上PCR仪进行扩增. 然后配制20 g/L琼脂糖凝胶, 加入终浓度为0.5 mg/L的溴化乙锭(EB); 取5 µL PCR终产物及DNA Marker, 以0.5×TBE为缓冲液, 电压100 V, 电泳40 min; 紫外检测仪下观察DNA扩增情况, 用ImageMaster VDS扫描分析仪扫描凝胶图谱, 用100 bp梯度的PCR Marker作分子量参照, 采用Total Lab2.0分析系统(nonlinear dynamics ltd)对PCR产物进行半定量分析, 测量区带密度, 计算样品区带与GAPDH区带的密度比, 计算两者比值作为目的基因的相对表达量.
| 基因名称 | 上游引物(5'-3') | 下游引物(5'-3') | 扩增产物长度(bp) | 退火温度(℃) |
| bcl-2 | GTGGAGGAGCTCTTCAGGGA | AGGCACCCAGGGTGATGCAA | 304 | 54 |
| bax | GAGGATGATTGCCGCCGTGGACA | GGTGGGGGTGAGGAGGCTTGAGG | 275 | 57 |
| GAPDH | CCACCCATGGCAAATTCCATGGCA | TCTAGACGGCAGGTCAGGTCCAC | 598 | 56 |
1.2.3 Western blot检测Bcl-2和Bax蛋白的表达: 对上述3组细胞进行总蛋白的提取, 然后配制10%分离胶和5%的积层胶, 予十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)变性电泳, 各取蛋白样品20 μg加样, 空白孔加1×SDS凝胶加样缓冲液补满, 电泳直至溴酚蓝到达分离胶底部, 结束电泳, 取下凝胶, 做好标记. 剪取与电泳凝胶大小一致的Whatman 3 MM滤纸和一张PVDF膜, 将3 MM滤纸于转移缓冲液中湿润, 然后从阴极面(上)到阳极面(下)依次叠放3层3 MM滤纸、凝胶、PVDF膜、3层3 MM滤纸, 采用Bio-Rad公司的半干式电转移仪, 参照厂家提供的程序进行(25 V×30 min), 将蛋白印迹在PVDF膜上. 最后将硝纤膜取出置一平皿中, 加封闭液, 室温封闭4 h后弃去封闭液, 加入1:500稀释的Bcl-2和Bax一抗(用TBST稀释), 4℃反应过夜, TBST漂洗后加入IgG-HRP(TBST稀释1:100), 室温作用2 h, 再予TBST充分漂洗, 加入ECL显色液, 置于柯达活体成像仪中观察结果, 条件设置为曝光5 min, CCD自动获取图片结果.
统计学处理 实验结果以mean±SD表示, 均数间比较采用t检验. 所有数据均采用SAS8.2统计软件进行分析, P<0.05表示有显著差异.
在Ad-Ang1组中bcl-2 mRNA的表达明显高于对照组和Ad-GFP组(0.609±0.01 vs 0.462±0.02, 0.609±0.01 vs 0.475±0.02, P<0.01), 后两组细胞中bcl-2 mRNA的表达差异无统计学意义; 而bax mRNA的表达在Ad-Ang1组中则低于对照组和Ad-GFP组(0.313±0.04 vs 0.413±0.02, 0.313±0.04 vs 0.407±0.03, P<0.05), 后两组细胞中bax mRNA的表达差异无统计学意义; Ang1基因转染后bcl-2 mRNA/bax mRNA比值上调, 和其他两组相比有统计学意义(2.046±0.32 vs 1.117±0.07, 2.046±0.32 vs 1.143±0.03, P<0.01, 图1).
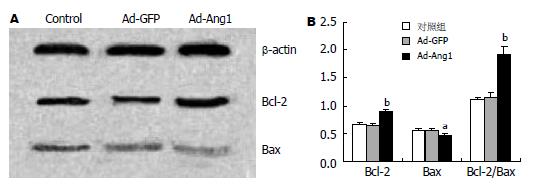
在Ad-Ang1组中Bcl-2蛋白的表达明显高于对照组和Ad-GFP组(0.906±0.03 vs 0.656±0.04, 0.906±0.03 vs 0.649±0.03, P<0.01), 后两组细胞中Bcl-2蛋白的表达无显著差异(P>0.05); 而Bax蛋白的表达在Ad-Ang1组中则低于对照组和Ad-GFP组(0.472±0.03 vs 0.564±0.03, 0.472±0.03 vs 0.567±0.03, P<0.05), 后两组细胞中Bax蛋白的表达差异无统计学意义; Ad-Ang1组中Bcl-2/Bax比值明显高于对照组和Ad-GFP组(1.922±0.15 vs 1.109±0.05, 1.922±0.15 vs 1.152±0.08, P<0.01), 说明基因转染后Bcl-2/Bax比值上调
(图2).
Ang是继VEGF之后所发现的又一重要的血管形成促进因子, 在多种肿瘤组织如肝癌[3]、结肠癌[4]、胶质瘤[5]、乳腺癌及前列腺癌[6]等中有高表达, Wang et al[7]又证实了在胃癌组织中表达也明显高于临近的正常组织, 且与肿瘤分化程度密切相关. 此外, 该研究人员还应用RT-PCR方法检测了8种胃癌细胞株上血管生成素及受体表达情况, 结果显示在所有检测的细胞株上均有Ang1、Tie-2 mRNA的表达. 目前认为Ang-1参与了肿瘤的发生、发展, 但其对肿瘤发展过程中的作用尚有争议. 尽管如此, 人们对Ang1在血管生成中的作用已取得一致看法, 认为Ang1能抑制血管内皮细胞凋亡、介导内皮细胞与血管旁细胞间的相互作用而促进血管重塑、成熟, 维持血管的完整性. 实验显示Ang1对不同的内皮细胞, 包括人脐静脉内皮细胞、动脉及微血管内皮细胞等均有抑制凋亡的作用[8], 而对不同因素如血浆饥饿、肿瘤坏死因子[9]、氧化应激[10]、放射线处理和高渗透剂[11]等所诱导的内皮细胞的凋亡也均有抑制作用. 后来, 又有研究证实Ang1对其他种类细胞也有同样的作用. Valable et al[12]应用Caspase-3活性测定方法证实Ang1抑制了血浆饥饿诱导的神经细胞凋亡, 是通过促进Akt的磷酸化而实现的; 应用PI3-K抑制剂后减少了Akt的磷酸化并增加了活性Caspase-3的表达. Dallabrida et al[13]用同样方法检测Ang1对不表达Tie-2的心肌细胞和骨骼肌细胞凋亡的影响, 结果显示Ang1抑制了上述细胞血浆饥饿所诱导的凋亡, 这一作用是由于激活Akt和MAPK p42/44信号途径所致; 应用整合素受体可阻断这一效应, 因而认为整合素可能介导了Ang1作用的发挥. 而我们在前期实验中, 利用腺病毒作为载体将外源Ang1基因导入体外培养的人胃癌细胞株MGC-803, 通过流式细胞仪检测该基因对细胞凋亡的影响, 显示Ang1基因也有抑制血浆饥饿诱导的胃癌细胞凋亡的作用[14]. 血浆饥饿所诱导的细胞凋亡是Caspase依赖性的, 而目前认为bcl-2为其上游调控分子, 为进一步探讨其抑制凋亡的可能机制, 我们利用RT-PCR及Western blot检测Ang1转染对胃癌细胞在mRNA及蛋白水平上表达bcl-2和bax的影响.
bcl-2基因家族是对细胞凋亡起调控作用的主要因子, 该家族继1985年首次发现bcl-2基因以来, 又陆续增添了很多新成员, 迄今已有近30种, 其中bax是通过与bcl-2共免疫沉淀而第一个被鉴定出具有促进细胞凋亡作用的基因. bcl-2和bax通过形成同二聚体或异二聚体对细胞凋亡进行调节. 细胞中Bcl-2/Bax比值决定对细胞凋亡的调控方向, 比值低时说明bax过量, 形成Bax-Bax同二聚体, 诱导细胞凋亡; 而当Bcl-2蛋白表达增多时, 使Bax-Bax的同二聚体分开并形成Bax-Bcl-2的异二聚体从而抑制细胞的凋亡. Bcl-2和Bax对凋亡的调节与线粒体有关, Bax-Bcl-2的异二聚体可使线粒体膜通透性增加, 细胞色素C释放增多, 后者通过作用于凋亡蛋白激活因子-1(Apaf-1)继而激活凋亡蛋白酶Caspases,导致细胞的凋亡[15]. 至于bcl-2是否参与了Ang1对细胞的促生存作用, 目前研究较少, 且结果不一致. Harfouche et al[16]的实验显示Ang1除通过PI3-K途径使Akt磷酸化以外, 还可上调内皮细胞Survivin蛋白表达, 但对细胞色素C和Bcl-2蛋白表达没有影响. 但也有研究人员证实Ang1可促进Bcl-2蛋白的表达[17]. 本研究显示Ang1基因转染人胃癌细胞株MGC-803后, 在转录和翻译水平上均上调了bcl-2的表达, 而bax mRNA和Bax蛋白的表达均下调, Bcl-2/Bax水平增高. 因而, 我们认为该途径可能是Ang1基因抑制肿瘤细胞凋亡的机制之一.
目前认为血管内皮生长因子(VEGF)和血管生成素(Ang)是调节血管生成的重要因子, 他们组成一个系统而发挥作用. Ang是继VEGF之后所发现的又一重要的血管形成促进因子, 在多种肿瘤组织如肝癌、结肠癌、胶质瘤、乳腺癌及前列腺癌等中有高表达.
姜春萌, 教授, 大连医科大学附属第二医院消化科
本课题组前期实验中以腺病毒为载体, 将Ang1基因导入体外培养的人胃癌细胞株MGC-803中, 并已证实Ang1具有抑制血浆饥饿诱导细胞凋亡的作用.
Wang et al证实了在胃癌组织中表达明显高于临近的正常组织, 且与肿瘤分化程度密切相关. 此外, 该研究人员还应用RT-PCR方法检测了8种胃癌细胞株上血管生成素及受体表达情况, 结果显示在所有检测的细胞株上均有Ang1、Tie-2 mRNA的表达. Harfouche et al的实验显示Ang1除通过PI3-K途径使Akt磷酸化以外, 还可上调内皮细胞Survivin蛋白表达, 但对细胞色素C和Bcl-2蛋白表达没有影响.
本文书写规范, 实验设计合理, 方法可靠, 内容较新, 具有一定的参考价值.
编辑: 李军亮 电编:郭海丽
| 1. | Cho CH, Kammerer RA, Lee HJ, Steinmetz MO, Ryu YS, Lee SH, Yasunaga K, Kim KT, Kim I, Choi HH. COMP-Ang1: a designed angiopoietin-1 variant with nonleaky angiogenic activity. Proc Natl Acad Sci U S A. 2004;101:5547-5552. [PubMed] [DOI] |
| 2. | 周 磊, 张 馥敏, 杨 志健, 陆 丽, 丁 兆丰, 丁 必森, 哈 团柱, 李 传富, 高 翔, 马 文珠. 人血管生成素-1和血管内皮生长因子165基因克隆及复制缺陷型腺病毒载体构建. 中华心血管病杂志. 2003;31:699. |
| 3. | Torimura T, Ueno T, Kin M, Harada R, Taniguchi E, Nakamura T, Sakata R, Hashimoto O, Sakamoto M, Kumashiro R. Overexpression of angiopoietin-1 and angiopoietin-2 in hepatocellular carcinoma. J Hepatol. 2004;40:799-807. [PubMed] [DOI] |
| 4. | Nakayama T, Hatachi G, Wen CY, Yoshizaki A, Yamazumi K, Niino D, Sekine I. Expression and significance of Tie-1 and Tie-2 receptors, and angiopoietins-1, 2 and 4 in colorectal adenocarcinoma: Immunohistochemical analysis and correlation with clinicopathological factors. World J Gastroenterol. 2005;11:964-969. [PubMed] |
| 5. | Ding H, Roncari L, Wu X, Lau N, Shannon P, Nagy A, Guha A. Expression and hypoxic regulation of angiopoietins in human astrocytomas. Neuro Oncol. 2001;3:1-10. [PubMed] [DOI] |
| 6. | Caine GJ, Blann AD, Stonelake PS, Ryan P, Lip GY. Plasma angiopoietin-1, angiopoietin-2 and Tie-2 in breast and prostate cancer: a comparison with VEGF and Flt-1. Eur J Clin Invest. 2003;33:883-890. [PubMed] [DOI] |
| 7. | Wang J, Wu K, Zhang D, Tang H, Xie H, Hong L, Pan Y, Lan M, Hu S, Ning X. Expressions and clinical significances of angiopoietin-1, -2 and Tie2 in human gastric cancer. Biochem Biophys Res Commun. 2005;337:386-393. [PubMed] [DOI] |
| 8. | Kim I, Moon SO, Han CY, Pak YK, Moon SK, Kim JJ, Koh GY. The angiopoietin-tie2 system in coronary artery endothelium prevents oxidized low-density lipoprotein-induced apoptosis. Cardiovasc Res. 2001;49:872-881. [PubMed] [DOI] |
| 9. | Chen JX, Chen Y, DeBusk L, Lin W, Lin PC. Dual functional roles of Tie-2/angiopoietin in TNF-alpha-mediated angiogenesis. Am J Physiol Heart Circ Physiol. 2004;287:H187-H195. [PubMed] [DOI] |
| 10. | Murakami T, Takagi H, Suzuma K, Suzuma I, Ohashi H, Watanabe D, Ojima T, Suganami E, Kurimoto M, Kaneto H. Angiopoietin-1 attenuates H2O2-induced SEK1/JNK phosphorylation through the phosphatidylinositol 3-kinase/Akt pathway in vascular endothelial cells. J Biol Chem. 2005;280:31841-31849. [PubMed] [DOI] |
| 11. | Kwak HJ, Lee SJ, Lee YH, Ryu CH, Koh KN, Choi HY, Koh GY. Angiopoietin-1 inhibits irradiation- and mannitol-induced apoptosis in endothelial cells. Circulation. 2000;101:2317-2324. [PubMed] |
| 12. | Valable S, Bellail A, Lesne S, Liot G, Mackenzie ET, Vivien D, Bernaudin M, Petit E. Angiopoietin-1-induced PI3-kinase activation prevents neuronal apoptosis. FASEB J. 2003;17:443-445. [PubMed] |
| 13. | Dallabrida SM, Ismail N, Oberle JR, Himes BE, Rupnick MA. Angiopoietin-1 promotes cardiac and skeletal myocyte survival through integrins. Circ Res. 2005;96:e8-e24. [PubMed] [DOI] |
| 14. | 颜 芳, 欧 希龙, 关 云艳, 产 松苗, 陈 国胜, 杨 柳, 孙 为豪. 血管生成素-1基因对人胃癌细胞增殖与凋亡的影响. 世界华人消化杂志. 2007;15:824-830. [DOI] |
| 15. | Sawa H, Kobayashi T, Mukai K, Zhang W, Shiku H. Bax overexpression enhances cytochrome c release from mitochondria and sensitizes KATOIII gastric cancer cells to chemotherapeutic agent-induced apoptosis. Int J Oncol. 2000;16:745-749. [PubMed] |
| 16. | Harfouche R, Hassessian HM, Guo Y, Faivre V, Srikant CB, Yancopoulos GD, Hussain SN. Mechanisms which mediate the antiapoptotic effects of angiopoietin-1 on endothelial cells. Microvasc Res. 2002;64:135-147. [PubMed] [DOI] |
| 17. | Shi LG, Zhang GP, Jin HM. Inhibition of microvascular endothelial cell apoptosis by angiopoietin-1 and the involvement of cytochrome C. Chin Med J (Engl). 2006;119:725-730. [PubMed] |