修回日期: 2008-09-25
接受日期: 2008-10-07
在线出版日期: 2008-11-08
目的: 检测家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)家族成员MUTYH基因SNP位点, 为结直肠癌易感人群的筛检提供依据.
方法: 应用PCR-SSCP及基因测序方法检测三个疑似FAP家系患者MUTYH基因SNP位点, PCR-CTPP方法检测中国医科大学附属第一医院结直肠癌组患者283例与对照组307患者血液DNA中MUTYH IVS1-5 A>C SNP突变位点的情况, 分析其多态性与结直肠癌易感性的关系.
结果: 发现MUTYH基因3个SNP位点, 分别为IVS1-5 A>C (A/C); IVS6+35 A>G(A/G, G/G)及c.G972C(Q335H)(G/C). 结直肠癌患者中发生MUTYH IVS1-5 A/C与MUTYH IVS1-5 C/C突变的患者分别为11和2例, 对照组中发生MUTYH IVS1-5 A/C突变的患者为4例, 但未发现MUTYH IVS1-5 C/C纯合性突变. 对照组中MUTYH IVS1-5 A/C等位基因频率与结直肠癌组相比, 有显著性差异(χ2 = 7.43, P = 0.006). MUTYH IVS1-5 A>C多态性与结直肠癌易感性有相关性.
结论: MUTYH IVS1-5 A>C位点基因多态性在结直肠癌发生中起着作用, 其对了解结直肠癌的发病机制及对高危人群的筛检具有重大意义.
引文著录: 佟静, 王炳元. MUTYH基因与结直肠癌发病的关系. 世界华人消化杂志 2008; 16(31): 3576-3581
Revised: September 25, 2008
Accepted: October 7, 2008
Published online: November 8, 2008
AIM: To provide evidence for screening of colorectal cancer in susceptible population through detecting familial adenomatous polyposis (FAP) family clan MUTYH gene SNP site.
METHODS: PCR-SSCP and gene sequencing were used to detect MUTYH gene SNP site in three doubtful FAP genealogy, and PCR-CTPP was used to detect MUTYH gene SNP mutational site in 283 colorectal cancer patients and 307 control group patients in the affiliated first hospital of China Medical University. Relationship between the SNP site and colorectal cancer susceptivity was analyzed.
RESULTS: Three SNP sites of MUTYH genes were found in three doubtful FAP genealogy, that is, IVS1-5 A>C (A/C), IVS6 + 35 A>G (A/G, G/G) and c.G972C (Q335H) (G/C). Eleven patients were found to generate MUTYH IVS1-5 A/C mutation and 2 MUTYH IVS1-5 C/C mutation in colorectal cancer group. And 4 patients were found to have MUTYH IVS1-5 A/C mutation and no MUTYH IVS1-5 C/C homozygosity mutation in control group. Significant difference in MUTYH IVS1-5 A/C allele frequency was detected between colorectal cancer group and control group (χ2 = 7.43, P = 0.006). Polymorphism of MUTYH IVS1-5 A>C was closely correlated to colorectal cancer susceptivity.
CONCLUSION: MUTYH IVS1-5 A>C site gene polymorphism plays important role in genesis of colorectal cancer, which is significant to etiopathogenesis of colorectal cancer and screening of high-risk group.
- Citation: Tong J, Wang BY. Relationship between MUTYH gene and occurrence of colorectal cancer in family clan of familial adenomatous polyposis. Shijie Huaren Xiaohua Zazhi 2008; 16(31): 3576-3581
- URL: https://www.wjgnet.com/1009-3079/full/v16/i31/3576.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i31.3576
碱基切除修复途径在生物体内是保守的, 在参与修复氧化损伤所引起的突变中起到至关重要的作用. 其中MUTYH基因定位于染色体1p32.1至p34.3, MUTYH基因编码一种特异的腺嘌呤转葡糖基酶, 在复制后切除子链DNA中与母链8-oxodG错配的A. 如果MUTYH蛋白失活, 则易导致复制过程中G:C-A:T的颠换. 研究表明在癌基因及抑癌基因中, 由于碱基切除修复途径缺陷所引起的基因突变频率的增加能导致肿瘤发生.
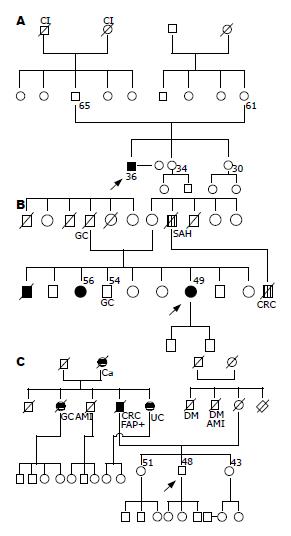
3个受检家系血样标本均来源于中国医科大学附属第一医院. 且经患者及其家族成员同意对其血样进行基因筛查. 家系一受检者2005年诊断为早期胃癌行纤维结肠镜检查示盲肠、升结肠、乙状结肠均有多发息肉. 其妹行纤维结肠镜检查发现有散发小的大肠息肉. 病理诊断为肠腺瘤、中度异型. 家系二受检者其兄于20年前行大肠癌手术, 于术后半年死亡. 为其家族第1个发病者. 其姐于其兄发病后行纤维结肠镜检查, 发现全结肠多发息肉, 行病理检查未发现癌. 遂行全结肠切除术, 保留直肠. 当时受检者29岁, 行纤维结肠镜检查, 发现盲肠和直肠散在数十个非密生型息肉, 大小为1-8 mm. 病理诊断为肠腺瘤、中度异型. 家系三受检者其父于2000-01便血, 行纤维结肠镜检查, 镜下呈典型的FAP密生型息肉. 病理示升结肠高分化腺瘤, 其父并于2007-08-09因直肠癌肝肺转移病逝.
本研究中结直肠癌组患者283名与对照组307名均来源于中国医科大学附属第一医院. 且经患者及其家属同意对其血样进行基因检测.
1.2.1 DNA提取: 对每个受检者抽取约5 mL静脉血, 经DNA提取试剂盒QIAamp® DNA Blood Maxi Kit提取受检者全血中DNA.
1.2.2 RNA提取: 对每个受检者抽取约5 mL静脉血, 经RNA提取试剂盒PAXgene Blood RNA Kit提取受检者全血中RNA.
1.2.3 引物的设计与合成: 在GenBank中登载人MUTYH(NM_012222.1)基因全序列, 应用Oligo@Sigma Genosys软件分别对APC及MUTYH基因全部外显子设计引物.
1.2.4 PCR反应体系: 20 μL PCR反应体系为: Hotstar Taq DNA聚合酶0.2 U 10×PCR缓冲液包含15 mmol/L MgCl2 共2 μL, 200 μmol/L dNTP 1.6 μL, 每种0.25 μmol/L引物0.2 μL, 加入1 μL模板DNA, 加双蒸水至20 μL. 反应条件设置为: 95℃预变性15 min, 94℃变性30 s, 退火30 s, 72℃延伸1 min, 重复37个循环, 最后72℃充分延伸10 min.
1.2.5 限制性内切酶反应体系: 20 μL限制性内切酶反应体系为: PCR扩增产物15 μL, 10×缓冲液2 μL, 100×BSA 0.2 μL, 各种限制性内切酶5 U, 37℃孵育过夜.
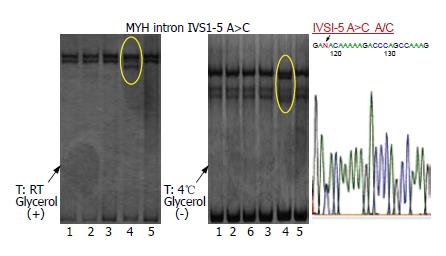
1.2.6 单链构像多态性分析(single strand confor-mation polymorphism, SSCP): PCR扩增后产物或PCR扩增酶切后产物17 μL与FEXB(950 mL/L甲酰胺, 0.02 mol/L EDTA, 0.25 g/L溴酚蓝)按1:1.5比例混合, 96℃变性15 min后置于冰中. 然后各取10 μL上样于120 g/L聚丙烯酰胺凝胶, 在4种条件下(常温, 常温+50 mmol/L甘油, 4℃, 4℃+50 mmol/L甘油)电泳, 电压为150 V. 常温电泳3.5 h, 4℃电泳4.5 h. 然后将聚丙烯酰胺凝胶银染, 观察结果, 如果在凝胶上出现与正常对照组不同的条带, 即泳动移位、多余条带或条带变宽者视为异常条带, 提示有突变的可能性, 待DNA测序分析.
1.2.7 DNA测序: 在凝胶上出现异常条带者, 应用Sanger双脱氧终止法对PCR-SSCP法检测出的可疑PCR产物进行测序. 所用测序仪器为ABI PRISM 3100, 测序前应用QIAquick PCR Purification Kit净化PCR产物, 使用Nanodrop ND-1000分光光度仪对DNA进行定量. 测序试剂为ABI BigDye® Terminater v3.1 Cycle Sequence Kit序列分析软件为GENETYX 8.
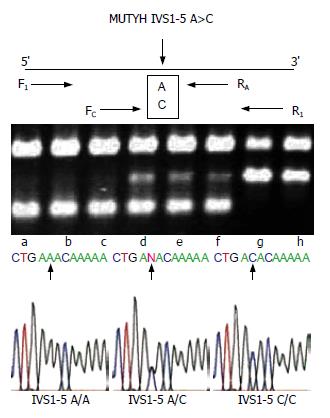
1.2.8 相对的两对引物-聚合酶链反应(polymerase chain reaction with confronting two-pair primers, PCR-CTPP): 针对MUTYH基因突变位点IVS1-5 A>C设计引物, 引物设计方法同上, PCR-CTPP反应体系里同时加入两对引物, 其序列为: Primer F1: 5'-GTC TTT GCA TGT CTC CAG GG-3'及Primer R1: 5'-CCA TGT TAC CCA AGC TGG TC-3'; Primer FT: 5'-CTT TGG CTG GGT CTT TTT GTT-3'及Primer RC: 5'-CTT CCT CAT GAT GGC CTG AC-3'(Sigma公司). 退火温度为60℃, 共40个循环. 引物所设位置及CTPP-PCR扩增所得产物见图1.
统计学处理 以χ2检验比较各基因型, 相关危险因素暴露在病例与对照之间分布的差异. 以比值比(odd ratios, OR)及其95% CI表示相对危险度, 其计算采用Logistic回归模型, 以MUTYH IVS1-5野生基因型(A/A)作参照; OR值经年龄、性别校正. 采用SPSS12.0统计软件进行分析, 所有的统计检验均为双侧概率检验.
本研究中患者年龄范围20-74岁, 结直肠癌组平均年龄为62.15±6.16岁, 对照组的平均年龄为58.81±6.78岁, 差异有显著性(u = 6.27, P<0.001). 结直肠癌组和对照组中男性频率分别为61.10%和52.10%, 经卡方检验有显著性差异(χ2= 4.87, P = 0.027). 受检者于2000年其父诊断为FAP时行纤维结肠镜检查, 未见异常, 7年来未再次检查. 3个受检家系如图2所示.
应用PCR-SSCP及基因测序方法检测3个疑似FAP家系患者MUTYH基因全部外显子, 发现MUTYH基因3个SNP位点, 分别为IVS1-5 A>C(A/C); IVS6+35 A>G(A/G, G/G)及c.G972C(Q335H)(G/C)如表1所示. 我们选择MUTYH IVS1-5 A>C SNP突变位点作为研究靶点(参见NCBI SNP数据库).
| 基因 | 位置 | 突变 | 家系一患者 | 家系二患者 | 家系三患者 |
| MYH | 内含子 | IVS1-5 A>CΔ | wild type | A/C | wild type |
| 内含子 | IVS6+35 A>G | wild type | A/G | G/G | |
| 外显子12 | c.G972C(Q335H) | wild type | G/C | wild type |
应用PCR-CTPP方法检测中国医科大学附属第一医院结直肠癌组与对照组患者在血液DNA中MUTYH IVS1-5 A>C SNP突变位点的情况如图3, 结果发现在283例结直肠癌患者中发生MUTYH IVS1-5 A/C与MUTYH IVS1-5 C/C突变的人数分别为11人、2人, 在307例对照组中发生MUTYH IVS1-5 A/C突变的人数为4人, 但未发现MUTYH IVS1-5 C/C纯合性突变.
结直肠癌组和对照组中MUTYH IVS1-5 A>C多态基因型的分布频率见表2. 对照组中MUTYH IVS1-5 A/C等位基因频率为0.65%, 结直肠癌组的MUTYH IVS1-5(A/C)及(C/C)频率为2.65%; 经卡方检验有显著性差异(χ2 = 7.43, P = 0.006).
结直肠癌患者中MUTYH IVS1-5多态基因型的调整比值比见表2. 以携带MUTYH IVS1-5基因野生型(A/A)的个体为参照组, 调整年龄、性别的混杂作用前后, 携带至少1个MUTYH IVS1-5等位基因(即A/C和C/C基因型)的个体罹患结直肠癌的危险显著增高, 调整分别为OR = 3.64(95% CI: 1.17-11.32)和OR = 3.60(95% CI: 1.21-10.48).
结直肠癌(colorectal cancer, CRC)是世界上最常见的恶性肿瘤之一, 仅2000年全球就有945 000新发病例, 每年近50万人死于结直肠癌, 仅次于肺癌乳癌居恶性肿瘤发病率的第3位[1]. 结直肠癌在我国也是最常见的恶性肿瘤之一, 目前居恶性肿瘤发病率第4位. 近年来, 结直肠癌的发病率呈明显上升趋势, 已引起人们的广泛关注.
结直肠癌的发生、发展是一个多因素、多阶段、多基因异常改变的复杂过程. 可因原癌基因和抑癌基因突变累积而成, DNA损伤修复系统缺陷亦可导致基因突变率增高, 促进肿瘤发生[2-3]. DNA损伤修复系统是机体内主要的防御屏障, 参与修复由内外环境因素所致的DNA损伤. DNA修复能力缺陷或低下将增加基因突变和细胞癌变的危险[4]. 研究表明, DNA修复能力低于一般人群平均水平的个体对肿瘤易感. 因此, DNA修复能力的个体差异可能是决定肿瘤遗传易感性极其重要的因素[5]. 现在知道, 许多DNA修复基因具有SNP, 越来越多的研究表明SNP能导致氨基酸替换进而改变相应修复酶的活性[6]. 因此, DNA修复基因SNP是导致DNA修复能力个体差异的重要原因, 特别是位于基因编码区或调节区的SNP. 研究表明, DNA修复基因的遗传多态性可导致个体发生癌症的危险性增高[7-8].
人类DNA损伤修复系统主要包括: 碱基切除修复(BER)、核酸切除修复(NER)和错配修复(MMR)等[9]. 而MUTYH是碱基切除修复(BER)的三级防御, MUTYH 基因定位于1号染色体短臂p32.1到p34.3, 长7.1 kb, 含有16个外显子, 编码一个535个氨基酸的蛋白[10], MUTYH蛋白是一种糖基化酶, 定位于细胞核和线粒体内[11]. 在DNA复制后他能迅速扫描子链DNA, 切除子链DNA中与母链8-oxodG错配的A[12-15], 如果MUTYH蛋白失活, 则易导致复制过程中G:C→A:T的颠换, 从而促进肿瘤的发生[16-17].
目前MUTYH基因已发现多个SNP[17], 其中研究比较多的是Y165C和G382D. 在家族遗传性胃癌中也发现了MUTYH的突变, 在日本发现IVS10-2 A>G剪切位点的突变[4], 在中国家族遗传性胃癌中, 也发现了两个新的突变位点: Pro18Leu和Gly25Asp[6]. 本研究首次报道了DNA修复基因MUTYH在人群中的一个新的SNP突变位点MUTYH IVS1-5 A>C, 并且就MUTYH IVS1-5 A>C多态性与结直肠癌易感性的关系进行了分析. 结果发现携带MUTYH IVS1-5基因突变型杂合子(A/C)或MUTYH IVS1-5基因突变型纯合子(C/C)基因型的个体罹结直肠癌的危险是携带MUTYH IVS1-5基因野生型纯合子(A/A)的3.64, 调整年龄、性别的混杂作用前后, OR值仍为3.60. 提示MUTYH IVS1-5 A>C位点基因多态性在结直肠癌发生中起着重要作用.
个别学者对MUTYH基因的点突变进行了功能分析[17]. 研究发现Y165C和G382D突变可以减低大肠杆菌中MUTY的表达数量. 他们同时使用底物类似物FA(2-fluoro-2-deoxyadenosine)对酶作用底物亲和力进行评价, 结果发现这两种突变均严重影响MUTYH识别FA以及区分鸟嘌呤与8-oxoG的能力. 也许MUTYH IVS1-5 A>C点突变也有类似的作用. 此外, MUTYH IVS1-5 A>C SNP突变位点位于MUTYH与复制蛋白A(replication protein A, RPA)的结合位点[18]. 而RPA具有单链结合和解旋的功能, 在DNA复制开始和延长阶段起着重要作用[19-20]. 在DNA复制过程中, RPA磷酸化可改变他与DNA结合的活性以及与参与DNA复制的各种蛋白质的相互作用, 进而调节DNA复制. 此外, RPA除了参与正常DNA的复制, 还参与了DNA损伤应激反应, 如核苷酸切除修复(nucleotide excision repair, NER)、DNA错配修复(DNA mismatch repair, MMR)、同源重组(homologous recombination, HR)和非同源末端连接(non-homologous end joining, NHEJ)等修复过程. 这些均可能是提高MUTYH IVS1-5基因突变型携带者的结直肠癌易感性的原因, 其具体机制还需进一步探讨.
本研究首次发现了DNA修复基因MUTYH一个新的SNP突变位点MUTYH IVS1-5 A>C, 并且分析了MUTYH IVS1-5 A>C多态性对结直肠癌发生存在一定的影响, 提示MUTYH IVS1-5 A>C多态性是构成结直肠癌遗传易感性的重要因素, 这对了解结直肠的发病机制及对于预防、早期诊断及早期治疗结直肠癌具有重大意义.
结直肠癌(CRC)是世界上最常见的恶性肿瘤之一. 每年近50万人死于结直肠癌, 已引起人们的广泛关注. 结直肠癌的发生、发展是一个多因素、多阶段、多基因异常改变的复杂过程. MUTYH基因定位于1号染色体短臂p32.1到p34.3,长7.1 kb, 含有16个外显子, 编码一个535个氨基酸的蛋白, MUTYH蛋白是一种糖基化酶, 定位于细胞核和线粒体内. 目前MUTYH基因已发现多个SNP, 在家族遗传性胃癌中也发现了MUTYH的突变.
倪润洲, 教授, 南通大学附属医院消化内科
近年来, 结直肠癌的发病率呈明显上升趋势, 已引起人们的广泛关注.
目前MUTYH基因已发现多个SNP, 其中研究比较多的是Y165C和G382D. 在家族遗传性胃癌中也发现了MUTYH的突变, 在日本发现IVS10-2 A>G剪切位点的突变, 在中国家族遗传性胃癌中, 也发现了两个新的突变位点: Pro18Leu和Gly25Asp.
本研究首次报道了DNA修复基因MUTYH在人群中的一个新的SNP突变位点MUTYH IVS1-5 A>C, 并且就MUTYH IVS1-5 A>C多态性与结直肠癌易感性的关系进行了分析, 并提示MUTYH IVS1-5 A>C位点基因多态性在结直肠癌发生中起着重要作用.
本研究选题较好, 统计方法合理, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol. 2001;2:533-543. [PubMed] [DOI] |
| 2. | Hoeijmakers JH. Genome maintenance mechanisms for preventing cancer. Nature. 2001;411:366-374. [PubMed] [DOI] |
| 3. | Risinger MA, Groden J. Crosslinks and crosstalk: human cancer syndromes and DNA repair defects. Cancer Cell. 2004;6:539-545. [PubMed] [DOI] |
| 4. | Tao H, Shinmura K, Hanaoka T, Natsukawa S, Shaura K, Koizumi Y, Kasuga Y, Ozawa T, Tsujinaka T, Li Z. A novel splice-site variant of the base excision repair gene MYH is associated with production of an aberrant mRNA transcript encoding a truncated MYH protein not localized in the nucleus. Carcinogenesis. 2004;25:1859-1866. [PubMed] [DOI] |
| 5. | Miyaki M, Iijima T, Yamaguchi T, Hishima T, Tamura K, Utsunomiya J, Mori T. Germline mutations of the MYH gene in Japanese patients with multiple colorectal adenomas. Mutat Res. 2005;578:430-433. [PubMed] [DOI] |
| 6. | Zhang Y, Liu X, Fan Y, Ding J, Xu A, Zhou X, Hu X, Zhu M, Zhang X, Li S. Germline mutations and polymorphic variants in MMR, E-cadherin and MYH genes associated with familial gastric cancer in Jiangsu of China. Int J Cancer. 2006;119:2592-2596. [PubMed] [DOI] |
| 7. | Kim IJ, Ku JL, Kang HC, Park JH, Yoon KA, Shin Y, Park HW, Jang SG, Lim SK, Han SY. Mutational analysis of OGG1, MYH, MTH1 in FAP, HNPCC and sporadic colorectal cancer patients: R154H OGG1 polymorphism is associated with sporadic colorectal cancer patients. Hum Genet. 2004;115:498-503. [PubMed] [DOI] |
| 8. | Lamlum H, Al Tassan N, Jaeger E, Frayling I, Sieber O, Reza FB, Eckert M, Rowan A, Barclay E, Atkin W. Germline APC variants in patients with multiple colorectal adenomas, with evidence for the particular importance of E1317Q. Hum Mol Genet. 2000;9:2215-2221. [PubMed] |
| 9. | Yu Z, Chen J, Ford BN, Brackley ME, Glickman BW. Human DNA repair systems: an overview. Environ Mol Mutagen. 1999;33:3-20. [PubMed] [DOI] |
| 10. | Aretz S, Uhlhaas S, Goergens H, Siberg K, Vogel M, Pagenstecher C, Mangold E, Caspari R, Propping P, Friedl W. MUTYH-associated polyposis: 70 of 71 patients with biallelic mutations present with an attenuated or atypical phenotype. Int J Cancer. 2006;119:807-814. [PubMed] [DOI] |
| 11. | Boldogh I, Milligan D, Lee MS, Bassett H, Lloyd RS, McCullough AK. hMYH cell cycle-dependent expression, subcellular localization and association with replication foci: evidence suggesting replication-coupled repair of adenine:8-oxoguanine mispairs. Nucleic Acids Res. 2001;29:2802-2809. [PubMed] [DOI] |
| 12. | Lu AL, Li X, Gu Y, Wright PM, Chang DY. Repair of oxidative DNA damage: mechanisms and functions. Cell Biochem Biophys. 2001;35:141-170. [PubMed] [DOI] |
| 13. | Slupska MM, Baikalov C, Luther WM, Chiang JH, Wei YF, Miller JH. Cloning and sequencing a human homolog (hMYH) of the Escherichia coli mutY gene whose function is required for the repair of oxidative DNA damage. J Bacteriol. 1996;178:3885-3892. [PubMed] |
| 14. | Slupska MM, Luther WM, Chiang JH, Yang H, Miller JH. Functional expression of hMYH, a human homolog of the Escherichia coli MutY protein. J Bacteriol. 1999;181:6210-6213. [PubMed] |
| 15. | Parker A, Gu Y, Mahoney W, Lee SH, Singh KK, Lu AL. Human homolog of the MutY repair protein (hMYH) physically interacts with proteins involved in long patch DNA base excision repair. J Biol Chem. 2001;276:5547-5555. [PubMed] [DOI] |
| 16. | Cheadle JP, Sampson JR. Exposing the MYtH about base excision repair and human inherited disease. Hum Mol Genet. 2003;12 Spec No 2:R159-R165. [PubMed] |
| 17. | Sampson JR, Jones S, Dolwani S, Cheadle JP. MutYH (MYH) and colorectal cancer. Biochem Soc Trans. 2005;33:679-683. [PubMed] [DOI] |
| 18. | Cheadle JP, Sampson JR. MUTYH-associated polyposis--from defect in base excision repair to clinical genetic testing. DNA Repair (Amst). 2007;6:274-279. [PubMed] [DOI] |
| 19. | Iftode C, Daniely Y, Borowiec JA. Replication protein A (RPA): the eukaryotic SSB. Crit Rev Biochem Mol Biol. 1999;34:141-180. [PubMed] [DOI] |
| 20. | Wold MS. Replication protein A: a heterotrimeric, single-stranded DNA-binding protein required for eukaryotic DNA metabolism. Annu Rev Biochem. 1997;66:61-92. [PubMed] [DOI] |