修回日期: 2008-07-04
接受日期: 2008-07-07
在线出版日期: 2008-11-08
目的: 探索幽门螺杆菌(Helicobacter pylori, H. pylori)对雷贝拉唑(rabeprazloe, RPZ)耐药的发生机制, 以期发现耐药相关基因, 为新型抗H. pylori药物的研发和改造提供新靶点, 新思路.
方法: 将带氯霉素抗性标签的Tn5转座子电转化到H. pylori 26695中, 使其随机插入到染色体上. 使用含氯霉素20 mg/L的哥伦比亚血平皿筛选所有插入了转座子的突变株, 再使用含雷贝拉唑2.25 mg/L的哥伦比亚血平皿筛选RPZ耐药克隆. 通过PCR技术对筛选到的RPZ耐药克隆进行转座子插入检测, 用LA-PCR试剂盒和测序技术检测插入失活位点.
结果: H. pylori 26695经电转化在RPZ抗性平皿上筛选到6个Tn5插入失活的耐药克隆, 对插入位点基因的测序发现失活基因与H. pylori 26695菌株中"hp1469"序列完全同源, 其编码产物为外膜蛋白Omp31, 功能为膜孔蛋白.
结论: H. pylori对RPZ耐药与"hp1469"基因失活引起的膜孔蛋白缺失密切相关.
引文著录: 赵飞, 何利华, 姜葵, 张建中. 一种新的幽门螺杆菌雷贝拉唑耐药相关基因. 世界华人消化杂志 2008; 16(31): 3547-3550
Revised: July 4, 2008
Accepted: July 7, 2008
Published online: November 8, 2008
AIM: To explore the mechanism underlying Helicobacter pylori (H. pylori) resistance to rabeprazole, and to search for a new target of anti-H. pyloridrugs.
METHODS: The EZ::TN transposon which includes a chloramphenicol resistance gene (camB) was transformed into H. pylori26695 strain by electroporation. The isolates randomly integrated the EZ::TN transposon were harvested on Columbia agar with 8% sheep blood and chloramphenicol (20 mg/L), and then all the isolates were inoculated on Columbia agar with rabeprazole (2.25 mg/L) to select rabeprazole-resistant isolates. The rabeprazole-resistant isolates inserted by the EZ::TN transposon were detected by camB gene PCR test, and the gene related was amplified by LA-PCR (using in vitro cloning kit) and sequenced.
RESULTS: Six rabeprazole-resistant isolates were acquired. They were all inserted by transposon into hp1469 gene, coding outer membrane protein (Omp31) which was a nonspecific porin of H. pylori 26695.
CONCLUSION: The mechanism of H. pylori resistant to rabeprazole may be associated with the mutant of "hp1469".
- Citation: Zhao F, He LH, Jiang K, Zhang JZ. A novel gene of Helicobacter pylori associated with resistance to rabeprazole. Shijie Huaren Xiaohua Zazhi 2008; 16(31): 3547-3550
- URL: https://www.wjgnet.com/1009-3079/full/v16/i31/3547.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i31.3547
自1982年Warren和Marshall从慢性胃炎患者体内分离出幽门螺杆菌(Helicobacter pylori, H. pylori)以来[1], 其一直倍受世界各地学者们的关注. 1994年WHO已将其列为胃癌的Ⅰ类致癌因子, 也是迄今第一个明确作为肿瘤病因的细菌. 中国人群H. pylori感染率为50%-60%, 根除H. pylori可治疗慢性胃炎、消化性溃疡, 可以使消化性溃疡的年复发率从80%降低至4%[2]. 抗H. pylori感染通常采用多药联合治疗, 包括抗生素、质子泵抑制剂(proton pump inhibitor, PPI)和/或铋剂. 耐药性H. pylori的感染率不断升高, 成为根除失败的主要原因之一. 目前临床多采用包括PPI和抗生素在内的三联或四联疗法治疗H. pylori感染, 具有良好的效果. 随后研究发现PPI除具有公认的胃酸分泌抑制作用和抗溃疡作用外, 本身还有类似抗生素的作用[3-5], 相关抑制H. pylori机制仍未完全明朗. 雷贝拉唑(rabeprazloe, RPZ)是新一代PPI, 其体外杀菌效果明显优于其他PPI[6]. 我们研究发现, H. pylori对于RPZ类似抗生素的抑制杀灭作用可以产生抗性, 并且获得了相关的耐药菌株. 我们拟通过转座子插入失活方法寻找耐药H. pylori菌株的发生机制, 寻找雷贝拉唑耐药基因. 同时为新型抗H. pylori药物的改造和研发提供新思路.
H. pylori 26695原始株, 来自中国疾病预防控制中心传染病预防控制所诊断室H. pylori菌种保存库. 雷贝拉唑原药, 由西安杨森公司惠赠. 含有氯霉素抗性基因的pMOD-2-<camB>质粒, 由张建中研究员自美国华盛顿大学医学院分子生物学系实验室构建并带回, 并由中国疾病预防控制中心传染病预防控制所传染病诊断室保存并提供. Labconco生物安全柜、混合气体培养箱、Eagle Eye Ⅱ型凝胶成像系统、EquiBio电击转化仪、Eppendorf PCR扩增仪和TaKaRa LA-PCR试剂盒.
将带氯霉素抗性基因的质粒pMOD-2-<camB>5 μL, 10×Buffer 2 μL, pvuII 1 μL, 灭菌TE(pH7.5)12 μL依次加入到0.5 mL的灭菌eppendorf管中, 混匀, 封口, 37℃水浴4 h酶切. 酶切产物纯化按照Qiagen纯化试剂盒说明书操作. 将酶切纯化后的Tn5-<camB>2.5 μL, EZ::TN转座酶5 μL, 灭菌葡萄糖溶液2.5 μL依次加入到0.5 mL的灭菌eppendorf管中, 37℃水浴0.5 h, 形成转座复合体. 取2 mm电击杯在750 mL/L的乙醇液中浸泡2 h左右, 取出后在生物安全柜中将乙醇完全挥发, 用紫外线照射, 盖紧塞后置于-20℃冰箱预冷; 在生物安全柜中取1 μL转座复合体加入到预处理的H. pylori 26695菌悬液中, 用移液器吹打均匀, 迅速转移至预冷的电击杯中, 放置在电转化仪上进行电转化.
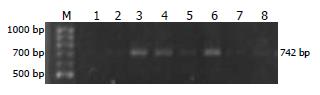
电击转化后的菌液均匀涂布于普通哥伦比亚血平皿, 在混合气体培养箱内培养24 h, 将菌苔全部刮下悬菌于400 μL的灭菌脑心浸液保存管内, 涂布于氯霉素(20 mg/L)抗性哥伦比亚血平皿筛选插入Tn5-<camB>的H. pylori, 平行接种相同A值的未转化H. pylori做阴性对照. 培养72 h后, 将氯霉素平皿上所有生长的克隆重悬于400 μL的灭菌脑心浸液保存管内, 涂布于RPZ(2.25 mg/L)抗性哥伦比亚血平皿筛选转座子插入失活的RPZ耐药株, 平行接种相同A值的未转化H. pylori做阴性对照. 筛选到的全部RPZ耐药株进行Tn5-<camB>的PCR检测, 双向引物分别为 cam1 5'-GAT ATA GAT TGA AAA GTG GAT-3'和cam2 5'-TTA TCA GTG CGA CAA ACT GGG-3', 目的片段742 bp. PCR阳性的耐药克隆用LA-PCR试剂盒检测插入位点附近基因片段, 测序分析Tn5插入位点及插入失活基因.
经电转化的H. pylori在氯霉素平皿培养72 h有细密菌落生长, 相同A值未经电转化H. pylori在氯霉素平皿上培养72 h未见生长. 上述通过氯霉素抗性标签获得的电转化插入Tn5-<camB>的菌接种在RPZ平皿上筛选插入失活的RPZ耐药菌, 培养96 h获得6个耐药克隆, 分别命名为R1-R6. 对照组H. pylori在RPZ平皿上无菌落生长. R1-R6转座插入株的检测: 转座子带有氯霉素抗性基因, 通过PCR检测, R1-R6均742 bp出现目的条带(图1). 筛选到的6个耐药株在RPZ平皿上传代生长良好, 接种到不含抗生素的哥伦比亚血平皿上稳定传代3次后重新转种RPZ平皿上仍然生长良好, 未转化H. pylori则不能生长. 利用LA-PCR试剂盒获得了转座子插入位点周遍基因序列, 测序结果经BLAST分析6个耐药克隆转座子插的入基因均为]hp1469".
PPI的类抗生素作用已得到公认, 但作用机制目前尚未明朗. 了解PPI的类抗生素作用机制有助于H. pylori的临床治疗和新型抗生素的研发. 耐药H. pylori的发现为研究PPI的药物靶点机制提供了新的线索和研究思路. 前期实验发现自然条件下筛选到耐药克隆的几率为10-9-10-10, 这与单基因突变导致耐药的概率比较接近, 推测H. pylori对PPI耐药原因可能是某基因突变或者失活, 可利用转座子寻找可能的耐药基因.
转座子Tn5长期以来被广泛应用于发现新基因、分析基因功能和构建突变体库[7-10]. 本实验以EZ::TN转座产品为工具, 利用了其如下特点: (1)可以随机插入到目的基因, 插入后稳定不会丢失; (2)带有氯霉素标签, 易于筛选; (3)序列已知, 带有测序引物. 实验通过2次耐药筛选获得目的克隆: 电转化后通过氯霉素耐药平皿获得带有转座子随机插入成功的H. pylori, 再次通过RPZ耐药平皿筛选到基因插入失活的耐药株. 将获得的6株耐药克隆, 普通哥伦比亚血平皿上生长正常, 重新转种RPZ平皿上仍然生长良好, 说明即使在失去抗性压力的条件下耐药株仍然可以将耐药性稳定传代, 此耐药为稳定的基因型耐药.
"hp1469"基因在26695中编码一种外膜蛋白(Omp31), 属于膜孔蛋白家族(hop family)[11], 其基因编码产物为HopV, 大小为248个氨基酸, 分子质量约为26.4 kDa. 该家族蛋白可在外膜上形成亲水性的孔, 对于水溶性的小分子物质进入菌体提供必要的通道. 外膜蛋白根据其形成的膜孔直径和物质转运的方式差异可分为两类: 非特异性和特异性膜孔[12]. 非特异性通道一般直径在0.6-2.3 nm, 可以将小于孔径的亲水小分子物质通过易化扩散作用被动转运到细胞内, 这种转运缺少特异性, 只与物质的大小和细胞内外浓度差有关, 抗生素通过该途径进入到细胞内. 特异性通道直径相对要小, 一般的物质不能通过, 只有能与通道上特异的结合位点结合的物质才能被转运[13]. HopV膜电导测量实验发现其与大肠杆菌非特异性膜孔蛋白OmpF形成的孔道的电导率(1.8nS)[14]非常接近. 认为是一种非特异膜孔蛋白[15], 是抗生素进入胞内的途径.
耐药菌株中"hp1469"基因由于Tn5转座子的插入失活造成其编码的膜孔蛋白Omp31的缺失, RPZ失去了部分进入菌体的途径, 可能造成胞内药达不到有效的杀菌浓度, 这可能是导致突变株耐药的重要原因之一. HopV是非特异膜孔蛋白, 其失活导致的耐药机制很可能是一种非特异的耐药途径, 可能针对PPI以外其他治疗H. pylori的药物都会有一定影响, 通过定位突变构建"hp1469"失活菌株可进一步验证实验结果的可靠性, 同时有助于检测HopV失活对其他抗生素敏感性的影响. 总之, 本耐药相关基因的发现, 为RPZ抗菌机制的研究、耐药研究和新药研发均具有较大的意义.
临床多采用包括质子泵抑制剂和抗生素在内的三联或四联疗法治疗H. pylori感染, 具有良好的效果. 耐药性H. pylori的感染率不断升高, 成为根除失败的主要原因之一. 研究发现质子泵抑制剂除具有公认的胃酸分泌抑制作用和抗溃疡作用外, 本身还有类似抗生素的作用, 对H. pylori有抑制作用.
白爱平, 副教授, 南昌大学第一附属医院消化内科
质子泵抑制剂的类似抗生素的作用相关抑制机制仍未完全明朗.
何利华 et al在对多种质子泵抑制剂的H. pylori MIC研究中发现了对质子泵抑制剂耐药的菌株, 经反复传代验证为稳定型耐药.
本文就H. pylori对雷贝拉唑的耐药机制进行了研究, 并初步筛选出一个新的耐药相关基因.
本研究基于转座子Tn5技术, 探索H. pylori对雷贝拉唑(RPZ)耐药的发生机制, 以期发现耐药相关基因, 为新型抗H. pylori药物的研发和改造提供新靶点、新思路, 选题准确, 具有重要的参考价值.
编辑: 李军亮 电编:何基才
| 1. | Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;1:1311-1315. [PubMed] [DOI] |
| 2. | Nervi G, Liatopoulou S, Cavallaro LG, Gnocchi A, Dal-Bo N, Rugge M, Iori V, Cavestro GM, Maino M, Colla G. Does Helicobacter pylori infection eradication modify peptic ulcer prevalence? A 10 years' endoscopical survey. World J Gastroenterol. 2006;12:2398-2401. [PubMed] |
| 3. | Iwahi T, Satoh H, Nakao M, Iwasaki T, Yamazaki T, Kubo K, Tamura T, Imada A. Lansoprazole, a novel benzimidazole proton pump inhibitor, and its related compounds have selective activity against Helicobacter pylori. Antimicrob Agents Chemother. 1991;35:490-496. [PubMed] |
| 4. | Bamba H, Kondo Y, Wong RM, Sekine S, Matsuzaki F. Minimum inhibitory concentration of various single agents and the effect of their combinations against Helicobacter pylori, as estimated by a fast and simple in vitro assay method. Am J Gastroenterol. 1997;92:659-662. [PubMed] |
| 5. | Altintas E, Sezgin O, Ulu O, Aydin O, Camdeviren H. Maastricht II treatment scheme and efficacy of different proton pump inhibitors in eradicating Helicobacter pylori. World J Gastroenterol. 2004;10:1656-1658. [PubMed] |
| 6. | Kawakami Y, Akahane T, Yamaguchi M, Oana K, Takahashi Y, Okimura Y, Okabe T, Gotoh A, Katsuyama T. In vitro activities of rabeprazole, a novel proton pump inhibitor, and its thioether derivative alone and in combination with other antimicrobials against recent clinical isolates of Helicobacter pylori. Antimicrob Agents Chemother. 2000;44:458-461. [PubMed] [DOI] |
| 7. | Jenks PJ, Chevalier C, Ecobichon C, Labigne A. Identification of nonessential Helicobacter pylori genes using random mutagenesis and loop amplification. Res Microbiol. 2001;152:725-734. [PubMed] [DOI] |
| 8. | Chang KC, Yeh YC, Lin TL, Wang JT. Identification of genes associated with natural competence in Helicobacter pylori by transposon shuttle random mutagenesis. Biochem Biophys Res Commun. 2001;288:961-968. [PubMed] [DOI] |
| 9. | Salama NR, Shepherd B, Falkow S. Global transposon mutagenesis and essential gene analysis of Helicobacter pylori. J Bacteriol. 2004;186:7926-7935. [PubMed] [DOI] |
| 10. | Ton-Hoang B, Guynet C, Ronning DR, Cointin-Marty B, Dyda F, Chandler M. Transposition of ISHp608, member of an unusual family of bacterial insertion sequences. EMBO J. 2005;24:3325-3338. [PubMed] [DOI] |
| 11. | Peck B, Ortkamp M, Nau U, Niederweis M, Hundt E, Knapp B. Characterization of four members of a multigene family encoding outer membrane proteins of Helicobacter pylori and their potential for vaccination. Microbes Infect. 2001;3:171-179. [PubMed] [DOI] |
| 12. | Exner MM, Doig P, Trust TJ, Hancock RE. Isolation and characterization of a family of porin proteins from Helicobacter pylori. Infect Immun. 1995;63:1567-1572. [PubMed] |
| 13. | Nikaido H. Porins and specific channels of bacterial outer membranes. Mol Microbiol. 1992;6:435-442. [PubMed] [DOI] |
| 14. | Benz R, Schmid A, Hancock RE. Ion selectivity of gram-negative bacterial porins. J Bacteriol. 1985;162:722-727. [PubMed] |
| 15. | Hancock RE, Schmidt A, Bauer K, Benz R. Role of lysines in ion selectivity of bacterial outer membrane porins. Biochim Biophys Acta. 1986;860:263-267. [PubMed] [DOI] |