修回日期: 2008-09-25
接受日期: 2008-10-07
在线出版日期: 2008-11-08
目的: 探讨Pim-3的异常表达在胃癌发展过程中的作用.
方法: 使用半定量RT-PCR法和免疫组化法检测40例胃癌组织及20例癌旁正常组织标本Pim-3的表达, 并比较Pim-3的表达与胃癌临床病理参数的关系.
结果: 与正常胃黏膜相比, Pim-3 mRNA的表达量在胃癌组织中更高(0.287±0.058 vs 0.053±0.055, P<0.001). 中分化腺癌中Pim-3蛋白的表达高于低分化腺癌组织中的表达, 两者比较差异显著(50% vs 20%, P<0.05). Pim-3的表达与淋巴转移、静脉转移密切相关(r = 0.385, 0.412, P = 0.014, 0.008)
结论: Pim-3可作为胃癌早期的生物标志物, 并可预示肿瘤的预后.
引文著录: 胡志方, 黄缘, 钟琼, 简捷. Pim-3异常表达在胃癌中的意义. 世界华人消化杂志 2008; 16(31): 3515-3518
Revised: September 25, 2008
Accepted: October 7, 2008
Published online: November 8, 2008
AIM: To investigate the role of Pim-3 aberrant expression in the development of gastric carcinoma.
METHODS: Semi-quantitative RT-PCR method and immunohistochemistry method were used to detect the expression of Pim-3 in 40 gastric carcinoma tissues and 20 adjacent normal tissues. We also compared relationship between Pim-3 expression and the clinicopathological parameters of gastric carcinoma.
RESULTS: Pim-3 mRNA expression was enhanced in gastric carcinoma compared with non-cancerous mucosa (0.287 ± 0.058 vs 0.053 ± 0.055, P < 0.001). Protein expression of Pim-3 was significantly higher in moderately differentiated adenocarcinoma tissue than in poorly differentiated adenocarcinoma tissue. Pim-3 expression was closely correlated with lymphatic metastasis and venous invasion (r = 0.385, 0.412, P = 0.014, 0.008).
CONCLUSION: Pim-3 can be seen as the biological marker for early phase of gastric carcinoma and a prognostic factor to predict the prognosis of cancer.
- Citation: Hu ZF, Huang Y, Zhong Q, Jian J. Significance of aberrant Pim-3 expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(31): 3515-3518
- URL: https://www.wjgnet.com/1009-3079/full/v16/i31/3515.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i31.3515
胃癌的发生是胃黏膜细胞增生和凋亡失衡的结果, 他是一个循序渐进的过程. 癌变过程是长期的细胞生物学行为由正常演变为异常的过程, 涉及多种肿瘤相关基因的参与. 丝/苏氨酸激酶Pim家族有3个成员[1]: Pim-1、Pim-2和Pim-3, 能磷酸化众多特异性底物, 分别在细胞增殖、分化、凋亡中发挥着重要的调控作用[2]. 目前, 国内外研究者在肝癌[3]、胰腺癌[4]、结肠癌[5]领域对Pim-3基因的研究已有较大的进展, 在胃癌的研究中对该基因的研究报道尚不多. 本研究拟应用半定量RT-PCR及免疫组化法检测Pim-3基因在人胃癌组织中的基因及蛋白水平的表达, 探讨该基因异常表达在胃癌发生发展中的作用及机制, 为胃癌的诊断及治疗提供新的靶点.
40例胃癌组织来自南昌大学第二附属医院普通外科手术标本, 其中20例中分化腺癌, 20例低分化腺癌. 患者手术前均未接受过化疗. 20例癌旁正常组织, 来源于患者肿瘤边缘2 cm以外区域, 经切片病理染色分析证实无癌变细胞. 时间均为2007-05/2008-05. 新鲜组织离体后分两部分, 一部分立即用液氮保存, 待提取总RNA, 一部分用甲醛固定, 石蜡包埋, 待免疫组化染色. 患者年龄、性别、肿瘤大小、分化程度、转移情况等资料来源于本院病案室.
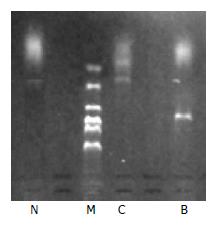
1.2.1 RT-PCR法: 应用TRIzol试剂, 按照说明书提取胃癌组织、癌旁正常胃组织总RNA. 逆转录反应合成CDNA. 取4 μL产物进行PCR扩增. 反应条件为: 94℃ 5 min; 94℃ 45 s; 57℃ 45 s; 72℃ 45 s; 72℃ 7 min, 35个循环. Pim-3上游引物序列: 5'-TCTCCAAGTTCGGCTCCCT-3'; 下游引物序列: 5'-TCACCCGCTCCTTCACCAC-3'. 本引物扩增产物为232 bp, 内参β-actin上游引物序列: 5'-CTTCCTGGGCATGGAGTC-3'; 下游引物序列5'-GCCGATCCACACGGAGTA-3', 内参扩增产物为740 bp, 反应结束后取产物于10 g/L琼脂糖凝胶中电泳. 应用天能Gis凝胶成像系统分析, PCR产物量以吸光度/面积表示, 以Pim-3产物量/β-actin产物量的比值作为Pim-3 mRNA表达量的最终结果.
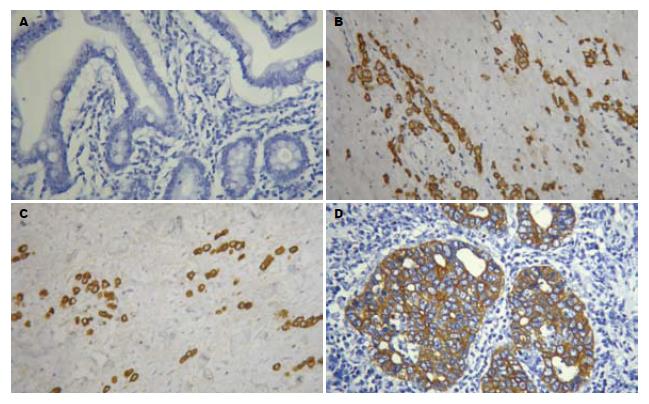
1.2.2 免疫组化法: 将经过石蜡包埋的标本行4 μm厚切片, 每例连续作3张切片, 1张常规HE染色, 另2张用于免疫组织化学染色(采用SP免疫组织化学法), 用PBS液代替一抗作为阴性对照. 实验流程按试剂盒说明步骤进行, 切片经60℃恒温箱烤30 min, 二甲苯脱蜡水洗, 蒸馏水泡5 min, 阻断内源性过氧化物酶, 一抗, 二抗, 酶标SP, DAB显色. 苏木素复染, 透明封固, 镜检. 主要试剂为羊抗人Pim-3多克隆抗体(美国Santa Cruz公司), 浓度为1:200. Pim-3阳性定位于细胞质, 细胞质染成棕黄色为阳性细胞, 每张切片选取5个具有代表性的高倍视野. 计数500个细胞中的阳性细胞数. 依据《全国免疫组织化学技术及诊断标准化专题研讨会》标准, 按阳性细胞所占比例进行分级: <25%为(-), 25%-50%为(+), 51%-75%为(++), >75%为(+++).
统计学处理 用SPSS12.0软件行相关数据分析, 分别用t检验和Spearman相关分析方法分析相应组数据, 当P<0.05时有统计学意义.
胃癌组织mRNA的表达量是0.287±0.058, 癌旁正常组织的是0.053±0.055, 两组经t检验分析P<0.001, 有统计学意义(图1).
中分化胃癌的蛋白阳性率是50%, 低分化胃癌的蛋白阳性率是20%, 癌旁正常组织的蛋白阳性率是0. 中分化胃癌与低分化胃癌Spearman相关分析比较, 有统计学意义(P = 0.024), 低分化胃癌与癌旁正常组织相关分析比较, 有统计学意义(P = 0.036, 表1, 图2).
Pim-3蛋白的表达与肿瘤大小、浸润黏膜深度、淋巴结转移灶无明显相关性, 与淋巴转移(r = 0.385, P = 0.014)、静脉转移(r = 0.412, P = 0.008)明显相关(表2).
| 临床病理特点 | n | Pim-3蛋白的表达 | 阳性率(%) | r | P | |||
| - | + | ++ | +++ | |||||
| 性别 | 0.237 | 0.141 | ||||||
| 男 | 25 | 14 | 3 | 5 | 3 | 40.0 | ||
| 女 | 15 | 12 | 1 | 1 | 1 | 26.7 | ||
| 年龄 | 0.159 | 0.327 | ||||||
| <60 | 18 | 13 | 2 | 2 | 1 | 27.8 | ||
| ≥60 | 22 | 13 | 2 | 4 | 3 | 40.9 | ||
| 肿瘤大小(cm) | 0.036 | 0.827 | ||||||
| <4 | 19 | 12 | 1 | 5 | 1 | 36.8 | ||
| ≥4 | 21 | 14 | 3 | 1 | 3 | 33.3 | ||
| 浸润深度 | 0.166 | 0.327 | ||||||
| 黏膜下层 | 10 | 5 | 1 | 2 | 2 | 50.0 | ||
| 固有肌层 | 12 | 8 | 2 | 2 | 0 | 33.3 | ||
| 浆膜层 | 18 | 13 | 1 | 2 | 2 | 27.8 | ||
| 淋巴转移 | 0.385 | 0.014 | ||||||
| - | 26 | 20 | 3 | 2 | 1 | 23.1 | ||
| + | 14 | 8 | 1 | 4 | 3 | 57.1 | ||
| 静脉转移 | 0.412 | 0.008 | ||||||
| - | 30 | 23 | 2 | 3 | 2 | 23.3 | ||
| + | 10 | 3 | 2 | 3 | 2 | 70.0 | ||
| 淋巴结转移病灶 | 0.046 | 0.777 | ||||||
| - | 22 | 15 | 2 | 2 | 3 | 31.8 | ||
| + | 18 | 11 | 2 | 4 | 1 | 38.9 | ||
肿瘤的发生发展是多基因参与的复杂过程, 包括癌基因的异常激活和抑癌基因失活, 从1997年人们发现Pim基因来, 对该基因的研究逐渐深入. 研究人员已发现Pim激酶家族能使促凋亡分子Bad发生磷酸化而失活[6], 同时使抗凋亡家族Bcl-XL、Bcl-2的表达增加, 从而导致肿瘤细胞的失控生长, 且Pim蛋白对某些正常或肿瘤细胞的增殖或细胞周期都具有调节功能, 能增强细胞的抗凋亡作用[7]. Pim-1最初是在鼠的T细胞淋巴瘤中被鉴定出来的一种癌基因, 当MMLV前病毒插入PIM-1基因的3'UTR区(3'-untranslated regions)可使Pim-1 mRNA稳定性增加, 而上调Pim-1蛋白的表达, 最终导致T细胞淋巴瘤的产生. Pim-3最初由Feldman et al以大鼠细胞系PC12去极化诱导的基因而被首先报道. 他在哺乳动物细胞中与Pim-1的序列具有72%的同源性, 在功能上也与前二者相似. Fujii et al[3]发现Pim-3 mRNA在人的心脏、骨骼肌、大脑、脾脏、肾脏、胎盘、肺和外周血白细胞中存在, 在心肌和骨骼肌中呈高表达; 相反, 在结肠、胸腺、肝脏和小肠的正常组织中不表达, 还证实了Pim-3蛋白在人肝细胞癌的癌旁组织、一部分癌组织及再生的胆管细胞中表达, 且在癌旁组织中表达较癌组织高. 那么, Pim-3在另一内胚层来源器官胃中的表达情况如何呢? 在本研究中, 通过半定量RT-PCR方法检测Pim-3基因mRNA的表达, 发现胃腺癌Pim-3基因mRNA的表达明显高于在正常胃黏膜中的表达(P<0.001), Pim-3基因mRNA在正常胃黏膜中基本不表达, 可能是在正常胃黏膜细胞中Pim-3 mRNA不稳定, 而在胃癌变组织中Pim-3 mRNA稳定性增加, 使促凋亡分子Bad发生磷酸化而失活, 从而导致肿瘤细胞的失控生长, 因此, 我们认为Pim-3是种理想的胃癌的生物标志物. 另外, 我们又通过免疫组化的方法检测Pim-3蛋白的表达, 发现Pim-3蛋白在分化程度高的胃癌组织中的表达明显高于在分化程度低的胃癌组织中的表达(P<0.05). 而Popivanova et al[5]发现分化越高的结肠腺癌组织里Pim-3蛋白表达阳性率越高, 这和本研究结果类似. 可能原癌基因激活后, 蛋白表达增多, 使促凋亡分子Bad发生磷酸化, 抑制了细胞凋亡, 导致组织细胞异常增生, 即在肿瘤早期阶段起作用, 在肿瘤后期基因的稳定性降低, 使蛋白的表达下降. 我们认为Pim-3可能是细胞对生长因子发生反应的早期基因, 其高表达可能是胃癌发生过程中的一个早期事件. 从Pim-3蛋白和一些病理资料的相关性分析结果来看, Pim-3蛋白的表达与肿瘤大小、浸润黏膜深度、淋巴结转移灶无明显相关性, 与淋巴转移(P = 0.014)、静脉转移(P = 0.008)明显相关, 这和Zheng et al[8]的研究结果相似, 不同的是我们发现Pim-3蛋白的表达和性别(P = 0.141)无明显相关, 我们知道如果肿瘤细胞发生淋巴转移或静脉转移则患者的预后不良的几率就会增高, 因此, 一定程度上Pim-3可被认为是种能预示肿瘤预后的预后因子.
总之, Pim-3在正常胃组织中不表达, 在胃癌组织里的表达明显增高, 其高表达可能是胃癌发生过程中的一个早期事件, 可被认为是种反映胃癌早期阶段的生物标志物, 并且可被认为是种能预示肿瘤预后的预后因子.
Pim-3作为一种丝/苏氨酸蛋白激酶Pim家族中的成员, 能磷酸化众多特异性底物, 在细胞增殖、分化、凋亡中发挥着重要的调控作用. 科研人员在肝癌、胰腺癌、结肠癌中均发现Pim-3高表达. 因此, Pim-3可能成为抗肿瘤治疗的一个新靶点. 探讨Pim-3在胃癌中的表达情况将有助于从一个新的方面揭示胃癌的发生机制, 为将来能早期诊断和治疗胃癌提供理论依据.
蓝宇, 教授, 北京积水潭医院消化科
科研人员发现Pim-3与消化系肿瘤的发生有密切联系, 在不同肿瘤中Pim-3的作用机制存在差异, 研究Pim-3对胃癌发生的作用途径正被广泛关注.
研究已发现Pim-3在正常肝、胰、结肠组织中不表达, 在癌组织中高表达, 尤其在结肠腺瘤中的表达最高.
本研究分别通过半定量RT-PCR和免疫组化方法发现Pim-3在正常胃组织中不表达, 在分化程度越高的胃腺癌组织中表达更高, 并发现Pim-3的表达与淋巴转移、静脉转移密切相关.
本研究选题新颖, 研究方法较先进, 统计正确, 结论较客观, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S. The protein kinase complement of the human genome. Science. 2002;298:1912-1934. [PubMed] [DOI] |
| 2. | Fox CJ, Hammerman PS, Thompson CB. The Pim kinases control rapamycin-resistant T cell survival and activation. J Exp Med. 2005;201:259-266. [PubMed] [DOI] |
| 3. | Fujii C, Nakamoto Y, Lu P, Tsuneyama K, Popivanova BK, Kaneko S, Mukaida N. Aberrant expression of serine/threonine kinase Pim-3 in hepatocellular carcinoma development and its role in the proliferation of human hepatoma cell lines. Int J Cancer. 2005;114:209-218. [PubMed] [DOI] |
| 4. | Li YY, Popivanova BK, Nagai Y, Ishikura H, Fujii C, Mukaida N. Pim-3, a proto-oncogene with serine/threonine kinase activity, is aberrantly expressed in human pancreatic cancer and phosphorylates bad to block bad-mediated apoptosis in human pancreatic cancer cell lines. Cancer Res. 2006;66:6741-6747. [PubMed] [DOI] |
| 5. | Popivanova BK, Li YY, Zheng H, Omura K, Fujii C, Tsuneyama K, Mukaida N. Proto-oncogene, Pim-3 with serine/threonine kinase activity, is aberrantly expressed in human colon cancer cells and can prevent Bad-mediated apoptosis. Cancer Sci. 2007;98:321-328. [PubMed] [DOI] |
| 6. | Yan B, Zemskova M, Holder S, Chin V, Kraft A, Koskinen PJ, Lilly M. The PIM-2 kinase phosphorylates BAD on serine 112 and reverses BAD-induced cell death. J Biol Chem. 2003;278:45358-45367. [PubMed] [DOI] |
| 7. | Bachmann M, Möröy T. The serine/threonine kinase Pim-1. Int J Biochem Cell Biol. 2005;37:726-730. [PubMed] [DOI] |
| 8. | Zheng HC, Tsuneyama K, Takahashi H, Miwa S, Sugiyama T, Popivanova BK, Fujii C, Nomoto K, Mukaida N, Takano Y. Aberrant Pim-3 expression is involved in gastric adenoma-adenocarcinoma sequence and cancer progression. J Cancer Res Clin Oncol. 2008;134:481-488. [PubMed] [DOI] |