修回日期: 2008-09-25
接受日期: 2008-10-14
在线出版日期: 2008-11-08
目的: 明确血管紧张素Ⅱ(AngⅡ)在酒精性肝纤维化发生中的作用, 为临床治疗提供新的靶点.
方法: Wisar大鼠110只随机分为对照组(n = 30), 酒精组(n = 50), Captopril组(n = 30); 酒精组采用乙醇灌胃法制备酒精性肝病动物模型, Captopril组在乙醇灌胃2 wk后, 加用Captopril 8g/(kg·d), 日2次灌胃, 同时继续乙醇灌胃, 共12 wk. 应用HE和VG染色观察肝脏病理组织学改变; 放射免疫分析法检测血清HA、LN含量以及血浆和肝组织内AngⅡ水平; 免疫组织化学染色检测肝组织内Ⅰ、Ⅳ型胶原含量.
结果: 酒精组血浆AngⅡ水平在8 wk后开始升高, 12 wk时达到顶点, 明显高于对照组(1250.50±170.06 vs 598.20±83.73, P<0.0005). 实验4, 8, 12 wk, 肝组织内AngⅡ进程进行性升高, 与对照组相比差异具有统计学意义(1083.4±197.45 vs568.2±89.82, 1382.5±154.88 vs 570.2±77.63, 1504.00±173.12 vs 579.2±87.65, 均P<0.0005). Captopril组未见明显的肝细胞脂肪变性、坏死及炎性细胞浸润, 无纤维条索形成; 而这些改变在酒精组均非常明显. 12 wk末, 酒精组血清LN和HA与对照组及Captopril组比较差异具有统计学意义(33.9±2.77 vs 22.0±2.31, 24.2±1.9; 72.5±3.31 vs 54.4±3.15, 56.7±3.22, 均P<0.05); Ⅰ、Ⅳ型胶原的定位在两组没有明显差别, 但在染色强度及染色面积上, Captopril组明显低于酒精组(6.45±0.41, 7.01±0.49 vs 17.23±0.62, 18.04±0.89, 均P<0.0005).
结论: 酒精性肝纤维化时血浆及肝组织内AngⅡ增高, 血管紧张素转换酶抑制剂Captopril能抑制酒精性肝纤维化的形成. AngⅡ具有促进酒精性肝纤维化发生的作用.
引文著录: 于继红, 陈玉帅, 林红, 傅宝玉. 血管紧张素Ⅱ在大鼠酒精性肝纤维化发病机制中的作用. 世界华人消化杂志 2008; 16(31): 3492-3497
Revised: September 25, 2008
Accepted: October 14, 2008
Published online: November 8, 2008
AIM: To determine role of angiotensin Ⅱ (AngⅡ) in alcoholic liver fibrosis and to provide a new suitable agent for clinical treatment.
METHODS: Wistar male rats were randomly divided into 3 groups: control group (n = 30), experimental group (n = 50) which were intragastricaly infused with NS or alcohol, and Captopril group (n = 30) treated with captopril twice a day for 12w [8 g/(kg·d)] following two weeks' of alcohol infusion. HE and van Giesion staining were used to observe the histological changes, and serum or hepatic hyaluronic acid, laminin and angiotensin Ⅱ were detected using radioimmunoassay method. Immunohistochemistry staining was used to detect the expressions of type Ⅰ and type Ⅳ collagen in liver.
RESULTS: The serum AngⅡ level began to increase after eight weeks' of ethanol feeding in alcohol-fed rats and reached the highest level at the end of 12 weeks, significantly higher than controls (1250.50 ± 170.06 vs 598.20 ± 83.73, P < 0.0005). AngⅡ, detected in liver, progressing increased and showed significant difference between alcohol-fed rats and controls (1083.4 ± 197.45 vs 568.2 ± 89.82, 1382.5 ± 154.88 vs 570.2 ± 77.63, 1504.00 ± 173.12 vs 579.2 ± 87.65, all P < 0.0005). HE and van Giesion staining showed no degeneration or necrosis or inflammatory cell infiltration or fibroproliferation in captopril-treated rats, whereas dramatic changes were observed in alcohol-fed rats. At the end of week 12, serum hepatic hyaluronic acid and laminin level were significantly increased in alcohol-fed rats than either the controls or the captopril-treated rats (33.9 ± 2.77 vs 22.0 ± 2.31, 24.2 ± 1.9; 72.5 ± 3.31 vs 54.4 ± 3.15, 56.7 ± 3.22, all P < 0.05). The result of immunohistochemistry staining showed no different location of positive staining, but the strength and areas of type Ⅰ or type Ⅳ collagen-positive staining were significantly lower in captopril-treated rats than in alcohol-fed rats (6.45 ± 0.41, 7.01 ± 0.49 vs 17.23 ± 0.62, 18.04 ± 0.89, all P < 0.0005).
CONCLUSION: AngⅡ is increased both in plasma and also in liver tissue. Captopril inhibits formation of liver fibrosis, decreases the plasma level of HA and LN and reduces the expression of collagen type Ⅰ and Ⅳ in liver. Thus AngⅡ promotes the alcohol-induced liver fibrosis.
- Citation: Yu JH, Chen YS, Lin H, Fu BY. Role of angiotens Ⅱ in pathogenesis of alcoholic liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(31): 3492-3497
- URL: https://www.wjgnet.com/1009-3079/full/v16/i31/3492.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i31.3492
随着我国人民生活水平的提高和乙肝疫苗预防的普及, 我国乙型肝炎的发病率逐年下降, 但酒精性肝病的发病率明显上升[1]. 由酒精引起的肝硬化、肝癌已经成为威胁人类健康的严重疾病, 其发病机制还不十分清楚. 肾素-血管紧张素-醛固酮系统(rennin-angiotension-aldosterone system, RAAS)是一类血管调节因子, 通过调节血管收缩和水钠潴留来维持机体血流动力学的稳定[2]. 近年来发现RAAS中的血管紧张素Ⅱ(AngⅡ)还有上调细胞因子、促进细胞增生和调节细胞外基质代谢等非血流动力学作用[3], 能够促进心脏和肾脏纤维化的形成. 肝脏并不是合成RAAS的经典器官, RAAS在酒精性肝纤维化形成中的作用还不确定, 因此我们应用乙醇灌胃法制备酒精性肝纤维化动物模型, 观察血浆和肝脏Ang Ⅱ的动态变化以及血管紧张素转换酶抑制剂(ACEI)Captopril能否抑制酒精性肝纤维化的形成, 以明确AngⅡ在酒精性肝纤维化发生中的作用, 为临床治疗提供新的思路.
♂Wistar大鼠110只, 6-8周龄, 体质量160-200 g, 清洁级, 由中国医科大学实验动物中心提供. 分析纯无水乙醇, 沈阳生威试剂厂; Captopril, 美国Sigma公司; HA、LN放射免疫分析试剂盒, 上海海军科学研究所; AngⅡ放射免疫分析试剂盒, 北京生物技术研究所; 抗Ⅰ、Ⅳ型胶原多克隆抗体, 美国Santa Cruz公司; SABC免疫组化试剂盒, 北京中衫金桥公司.
1.2.1 造模: 实验动物按随机数字表随机分为3组. 对照组30只, 给予生理盐水2.0 mL/只, 每天ig 3次, 共12 wk. 酒精组50只, 参照文献[4]给予乙醇, 每天ig 3次, 共12 wk, 其中0-4 wk给予400 mL/L乙醇8 g/(kg·d); 4-8 wk, 500 mL/L乙醇9 g/(kg·d); 8-12 wk, 500 mL/L乙醇10 g/(kg·d). Captopril组30只, 在给予乙醇ig 2 wk后, 加用Captopril 8 g/(kg·d), 每天ig 2次, 同时继续乙醇ig, 用量、用法同酒精组, 总疗程12 wk. 实验4、8、12 wk末分批处死动物, 各个时间点每组动物10只. 下腔静脉采血并大循环灌流去除肝脏血液后留取肝脏组织标本待检.
1.2.2 肝脏组织病理学检查: 肝脏标本置于甲醛中固定, 石蜡包埋, HE及VG染色, 观察肝脏病理形态学改变.
1.2.3 血清透明质酸(HA)、层粘连蛋白(LN)检测: 应用放射免疫分析法, 严格按照说明书进行操作.
1.2.4 血浆、肝组织内AngⅡ水平检测: 下腔静脉采血2 mL注入含有酶抑制剂的抗凝管中, 2500 r/min 4℃离心7 min分离血浆待用. 100 mg肝组织制成肝细胞匀浆待用. 标准管及样品管各加入标准液及待测样品200 µL, 然后加入125I标记的AngⅡ 100 µL, 兔抗AngⅡ抗体100 µL, 充分混匀, 4℃ 24 h; 加入驴抗兔免疫分离剂500 µL, 充分混匀后室温放置15 min, 3000 r/min离心15 min后吸去上清, 沉淀物在γ-放射免疫计数器下测定.
1.2.5 Ⅰ、Ⅳ型胶原免疫组织化学染色: 采用SABC法. 石蜡包埋的肝组织切成4 μm厚的切片, 常规二甲苯, 梯度乙醇脱蜡至水. 30 mL/L H2O2 37℃孵育15 min以去除内源性过氧化物酶, PBS冲洗5 min×3; 高压30 s进行抗原修复, PBS洗5 min×3; 加入正常山羊血清37℃封闭30 min, 不洗即加入兔抗大鼠多克隆α1(Ⅰ)、α1(Ⅳ)型胶原抗体(1:50倍稀释), 阴性对照用PBS代替一抗, 4℃过夜; PBS洗5 min×3, 加入生物素标记的羊抗兔-IgG抗体, 37℃孵育20 min; PBS洗5 min×3, 加入SABC液, 37℃孵育20 min; PBS洗5 min×3, DAB显色, 显微镜下控制显色时间, 3 min左右; 自来水冲洗, 苏木素复染40 s, 盐酸-乙醇分化, 常规脱水透明, 树胶封片. 结果应用病理图像分析仪对染色强度和染色面积进行分析, 分析时每张切片选取阳性染色最明显的10个视野.
统计学处理 以mean±SD表示, 应用SPSS13.0对各组间数据进行单因素方差分析(AVONA), 各组间两两比较应用LSD方法,P<0.05有统计学意义.
实验4 wk末, 酒精组大鼠毛色晦暗, 竖毛, 反应迟钝, 食欲不佳, 体质量下降; 而Captopril组大鼠活跃, 毛色光滑, 体质量持续增长. 整个实验过程中, 对照组、酒精组及Captopril组分别死亡1、8和1只大鼠, 死亡率分别为3.3%, 16%和3.3%.
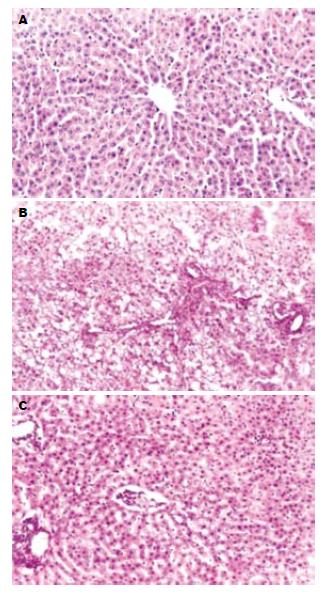
HE及VG染色结果显示: 对照组肝小叶结构完整, 肝细胞放射状排列, 无变性、坏死和炎细胞浸润, 无纤维组织增生. 酒精组4 wk末即出现局限性肝小叶中央静脉区小泡状脂肪变, 肝细胞点片状坏死, 炎性细胞浸润; 12 wk末, 大于2/3肝小叶形成弥漫性以大泡为主的混合性脂肪变, 肝细胞坏死增多, 并可见中央静脉及汇管区周围纤维组织增生, 呈条索状向肝小叶内延伸, 部分包绕肝小叶, 但无假小叶形成, 窦周亦有明显的纤维组织增生. 而Captopril组8 wk末才出现局限性轻度脂肪变性, 肝细胞坏死及炎性细胞浸润均不明显; 12 wk末脂肪变略有增加, 无纤维条索形成(图1).
实验4 wk末各组间血清LN浓度差异无统计学意义(P = 0.231); 实验8 wk末酒精组血清LN浓度开始升高, 12 wk末进一步升高, 与对照组及Captopril组比较差异具有统计学意义(P = 0.001, P = 0.012). 血清HA浓度在实验4和8 wk末时各组间比较无统计学差异(P = 0.496, P = 0.201); 12 wk末酒精组血清HA浓度明显高于对照组及Captopril组, 差异具有统计学差异(P<0.0005, 表1).
| 分组 | LN | HA | ||||
| 4 wk | 8 wk | 12 wk | 4 wk | 8 wk | 12 wk | |
| 对照组 | 20.4±2.06 | 21.2±2.03 | 22.0±2.31 | 53.7±3.09 | 52.5±3.03 | 54.4±3.15 |
| 酒精组 | 23.6±2.15 | 31.1±2.87 | 33.9±2.77 | 52.6±3.75 | 58.1±3.24 | 72.5±3.31 |
| Captopril组 | 21.9±2.23 | 24.3±1.87 | 24.2±1.90 | 46.8±4.22 | 47.8±3.87 | 56.7±3.22 |
实验4 wk末酒精组血浆AngⅡ水平与对照组比较差异没有统计学意义(P = 0.067). 实验8 wk末酒精组血浆AngⅡ水平开始升高, 12 wk末仍维持于较高水平, 与对照组比较差异有统计学意义(P<0.0005). 肝组织内亦可检测到AngⅡ, 实验4 wk末酒精组肝组织内AngⅡ水平即开始升高, 8 wk末进一步升高, 12 wk末达到顶点, 与对照组比较差异有统计学意义(P<0.0005, 表2).
| 分组 | 血浆AngⅡ | 肝组织AngⅡ | ||||
| 4 wk | 8 wk | 12 wk | 4 wk | 8 wk | 12 wk | |
| 对照组 | 611.00±138.12 | 607.00±107.81 | 598.20±83.73 | 568.20±89.82 | 570.20±77.63 | 579.20±87.65 |
| 酒精组 | 729.00±132.54 | 1113.40±187.51 | 1250.50±170.06 | 1083.40±197.45 | 1382.50±154.88 | 1504.00±173.12 |
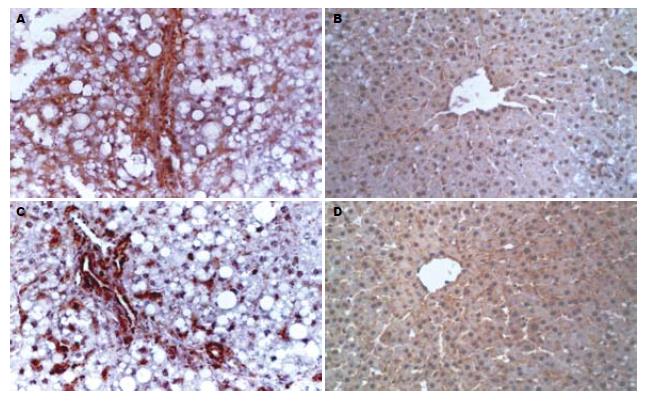
对照组和Captopril组大鼠中Ⅰ型胶原主要分布于汇管区的结缔组织、血管壁及胆管壁, 并沿肝窦壁成丝状着色; Ⅳ型胶原主要位于中央静脉、汇管区的血管壁, 两者均呈弱阳性染色. 酒精组中Ⅰ型胶原主要分布于中央静脉、汇管区周围及增生的纤维组织处, 形成宽而粗大的纤维条索; Ⅳ型胶原大量沉积于增生的纤维间隔内, 呈强阳性染色, 并可见沿肝窦壁连续分布的强阳性线性染色. 病理图像分析仪所示酒精组Ⅰ、Ⅳ型胶原阳性面积百分比(17.23±0.62, 18.04±0.89)均明显高于对照组(5.14±0.29, 5.26±0.33)和Captopril组(6.45±0.41, 7.01±0.49), 差异有统计学意义(P<0.0005, 图2).
RAAS的研究已有上百年历史, 在维持机体血流动力学的稳定方面发挥重要作用, 并认为其对血流动力学的调节参与肝脏疾病所致门脉高压和肝肾综合征的发生[5-6]. 近年来发现RAAS与心、肺、皮肤、肾等器官和组织的纤维化密切相关[7-11]. 肝纤维化与其他器官组织纤维化过程相似, 是机体对损伤的一种过度修复[12-13]. 那么RAAS是否在肝纤维化的进程中发挥重要作用, 成为新的研究热点. 随后的研究发现, 在慢性乙型病毒性肝炎和肝硬化患者中存在血清AngⅡ和血管紧张素转换酶的升高, 血管紧张素转换酶抑制剂和血管紧张素受体拮抗剂可以抑制CCl4引起的大鼠肝纤维化[14-19]. 这说明RAAS在肝纤维化的形成中发挥重要作用.
酒精性肝病与乙型病毒性肝炎或CCl4引起的肝脏损害有不同的特点. 酒精性肝病时脂质过氧化反应更加明显, 由氧应激引起的血管内皮系统的增生更加显著[20], 这可以由临床上酒精性肝病的患者蜘蛛痣、肝脾大要比其他肝病患者更加常见、更加严重来证实. 因此酒精性肝病进程中RAAS可能占据更加重要的地位, 为了验证这一观点, 我们利用乙醇灌胃法制备了酒精性肝纤维化动物模型, 观察了在肝纤维化过程中, RAAS最关键的活性物质AngⅡ的动态变化以及ACEI的经典药物Captopril对酒精性肝纤维化形成的影响.
结果发现, 在乙醇灌胃4 wk末时, 血浆AngⅡ水平即开始升高, 8 wk末时进一步升高, 12 wk末虽然没有继续升高, 但仍维持在较高水平, 说明在酒精性肝病时确实存在RAAS的活化. 在心、肾等脏器纤维化的研究中发现, 纤维化的形成与局部RAAS的激活有关. 但是心脏和肾脏是能够合成RAAS的全部或大部分成分的, 而肝脏目前能够证实的仅有血管紧张素原的合成, 是否能够合成AngⅡ和ACE还是未知. 因此我们应用大循环灌流去除肝脏血液成分的影响, 检测了肝组织内AngⅡ的含量. 结果发现在乙醇灌胃4 wk末时, 肝组织内AngⅡ水平即表现为较高水平, 8 wk末时进一步升高, 12 wk末达到高峰, 并且明显高于血浆内AngⅡ水平, 这说明肝脏局部确实存在AngⅡ, 而不是来源于血液循环.
ACE是AngⅡ合成的限速酶, 能够促进Ang Ⅰ转化为AngⅡ. 为了进一步验证AngⅡ的促纤维化作用, 我们应用Captopril抑制AngⅡ的合成, 从肝脏组织病理学、血清HA、LN含量和肝组织内Ⅰ、Ⅳ型胶原的表达几个方面观察了Captopril对酒精性肝纤维化进程的影响. 结果表明, 在乙醇灌胃12 wk末时, 中央静脉、汇管区及窦周间隙纤维组织明显增生, 条索状向肝小叶内延伸, 说明此时已经形成肝纤维化, 而Captopril组未见明确的纤维组织增生, 说明Captopril抑制了肝纤维化的形成. 另一方面乙醇可以引起反应肝纤维化程度的血清HA、LN的明显升高, 而Captopril阻止了这种改变. 肝组织内Ⅰ、Ⅳ型胶原免疫组织化学染色存在类似的结果, 在酒精组12 wk末时, 中央静脉、汇管区周围增生的纤维组织及纤维间隔内可见Ⅰ型胶原的强阳性染色, 在血管壁和肝窦间隙可见连续的Ⅳ型胶原强阳性染色, 而在Captopril组仅能看见较弱的非连续性染色. 以上这些结果证明ACEI能够抑制酒精性肝纤维化的形成, AngⅡ确实是促进酒精性肝纤维化形成的重要因子.
酒精性肝病既往是西方国家的常见疾病. 近年来, 在我国已成为引起肝硬化、肝癌的主要因素. 酒精性肝病的发病机制不十分清楚, 临床治疗缺乏有效手段. 肾素-血管紧张素-醛固酮系统已被证实介导心、肺、肾等器官纤维化过程, 但其在酒精性肝纤维化发病过程中的作用还不十分清楚, 本文就这一问题进行研究.
朴云峰, 教授, 吉林大学第一临床医院消化科
酒精性肝纤维化形成的核心是肝星状细胞的激活, 但肝星状细胞活化的启动因素, 参与因子及相关信号通路尚不十分清楚, 临床针对肝星状细胞活化的治疗缺乏靶点.
柳怿 et al应用CCl4诱导大鼠肝实质损伤性肝纤维化模型, 从肝、脾指数, 肝HE和Masson染色以及透射电镜下肝细胞超微结构变化等几个方面, 证实了血管紧张素转化酶抑制剂依那普利对肝纤维化具有治疗作用.
本文首次报道了AngⅡ在酒精性肝纤维化发病机制中的作用, 并确定肝脏在病理情况下能够自主合成AngⅡ.
本研究证实AngⅡ能够促进酒精性肝纤维化的形成, 为临床应用血管紧张素转换酶抑制剂进行干预, 治疗酒精性肝纤维化提供了实验基础.
本研究内容有特色, 技术路线合理, 研究结果可靠, 有一定新意, 对同行有参考价值.
编辑: 李军亮 电编:何基才
| 2. | Suo M, Hautala N, Földes G, Szokodi I, Tóth M, Leskinen H, Uusimaa P, Vuolteenaho O, Nemer M, Ruskoaho H. Posttranscriptional control of BNP gene expression in angiotensin II-induced hypertension. Hypertension. 2002;39:803-808. [PubMed] [DOI] |
| 3. | Border WA, Noble N. Maximizing hemodynamic-independent effects of angiotensin II antagonists in fibrotic diseases. Semin Nephrol. 2001;21:563-572. [PubMed] [DOI] |
| 5. | 张 剑平, 魏 红山, 孙 继云, 肖 凡, 张 毅, 徐 道振, 成 军. 肝病患者血清血管紧张素转化酶活性变化的临床意义. 世界华人消化杂志. 2007;15:2553-2556. [DOI] |
| 7. | Barlucchi L, Leri A, Dostal DE, Fiordaliso F, Tada H, Hintze TH, Kajstura J, Nadal-Ginard B, Anversa P. Canine ventricular myocytes possess a renin-angiotensin system that is upregulated with heart failure. Circ Res. 2001;88:298-304. [PubMed] |
| 8. | Schultz Jel J, Witt SA, Glascock BJ, Nieman ML, Reiser PJ, Nix SL, Kimball TR, Doetschman T. TGF-beta1 mediates the hypertrophic cardiomyocyte growth induced by angiotensin II. J Clin Invest. 2002;109:787-796. [PubMed] |
| 10. | Selman M, Pardo A. Idiopathic pulmonary fibrosis: an epithelial/fibroblastic cross-talk disorder. Respir Res. 2002;3:3. [PubMed] [DOI] |
| 11. | Selman M, King TE, Pardo A. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134:136-151. [PubMed] |
| 12. | Moreira RK. Hepatic stellate cells and liver fibrosis. Arch Pathol Lab Med. 2007;131:1728-1734. [PubMed] |
| 13. | Parsons CJ, Takashima M, Rippe RA. Molecular mechanisms of hepatic fibrogenesis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S79-S84. [PubMed] [DOI] |
| 14. | 张 晶, 宗 春华, 李 定国, 周 仁建, 杜 学亮, 周 馨, 徐 芹芳, 陆 汉明. 肝内肾素-血管紧张素-醛固酮系统与大鼠肝纤维化的关系. 世界华人消化杂志. 2002;10:397-400. [DOI] |
| 15. | Jonsson JR, Clouston AD, Ando Y, Kelemen LI, Horn MJ, Adamson MD, Purdie DM, Powell EE. Angiotensin-converting enzyme inhibition attenuates the progression of rat hepatic fibrosis. Gastroenterology. 2001;121:148-155. [PubMed] [DOI] |
| 16. | Yoshiji H, Kuriyama S, Yoshii J, Ikenaka Y, Noguchi R, Nakatani T, Tsujinoue H, Fukui H. Angiotensin-II type 1 receptor interaction is a major regulator for liver fibrosis development in rats. Hepatology. 2001;34:745-750. [PubMed] |
| 17. | Paizis G, Gilbert RE, Cooper ME, Murthi P, Schembri JM, Wu LL, Rumble JR, Kelly DJ, Tikellis C, Cox A. Effect of angiotensin II type 1 receptor blockade on experimental hepatic fibrogenesis. J Hepatol. 2001;35:376-385. [PubMed] [DOI] |
| 18. | Ohishi T, Saito H, Tsusaka K, Toda K, Inagaki H, Hamada Y, Kumagai N, Atsukawa K, Ishii H. Anti-fibrogenic effect of an angiotensin converting enzyme inhibitor on chronic carbon tetrachloride-induced hepatic fibrosis in rats. Hepatol Res. 2001;21:147-158. [PubMed] [DOI] |
| 19. | Wei H, Lu H, Li D, Zhan Y, Wang Z, Huang X. The expression of AT1 receptor on hepatic stellate cells in rat fibrosis induced by CCl4. Chin Med J (Engl). 2001;114:583-587. [PubMed] |
| 20. | Mello T, Ceni E, Surrenti C, Galli A. Alcohol induced hepatic fibrosis: role of acetaldehyde. Mol Aspects Med. 2008;29:17-21. [PubMed] [DOI] |