修回日期: 2008-10-16
接受日期: 2008-10-27
在线出版日期: 2008-11-08
目的: 研究模拟失重环境下大鼠肝脏组织中NF-κB的表达及意义.
方法: 成年♂Wistar大鼠84只, 随机分为模拟失重组和对照组, 每组又分别设1、2、3、4、5、6和7 d共7个时相点, 每时相点模拟失重和同步对照各6只大鼠. 采用尾悬吊法建立模拟失重动物模型. 各组大鼠肝组织中NF-κB表达分别应用Western blot和免疫组化PV-6001法进行检测.
结果: 在尾悬吊1-2 d期间, 大鼠焦躁不安, 饮食量减少, 精神较差, 活动减弱, 2-3 d后有所适应, 逐渐恢复稳定状态. 模拟失重环境下大鼠肝脏NF-κB表达水平明显升高, 1、2 d悬尾组大鼠肝组织中NF-κB表达率明显高于对照组(F = 271.36, P<0.01), 其后, NF-κB表达水平呈明显下降趋势(F = 60.68, P<0.05), 5-7 d悬尾组NF-κB表达水平接近对照组, 差异无统计学意义. NF-κB阳性产物主要见于实验大鼠肝细胞内, 亦见于炎细胞及Kupffer细胞内, 可分为胞质型、核型、核浆型等三个类型, 单独或混合存在.
结论: 模模拟失重使大鼠肝脏组织中NF-κB表达发生明显变化, 提示在失重环境中肝脏NF-κB的早期高表达和逐渐恢复过程与失重应激反应及失重耐受有密切关系.
引文著录: 崔彦, 董家鸿, 张铭, 周金莲, 刘子沛, 王平, 李成林, 张建中. 模拟失重大鼠肝组织中NF-κB的表达及意义. 世界华人消化杂志 2008; 16(31): 3480-3484
Revised: October 16, 2008
Accepted: October 27, 2008
Published online: November 8, 2008
AIM: To investigate the expression of nuclear factor-kappa B (NF-κB) in liver tissus of rats under the condition of simulated weightlessness.
METHODS: Eighty-four male adult Wistar rats weighing 280-310 g were randomly assigned to simulated weightlessness group and control group, each with 7 subgroups from 1 to 7 according time sequence in day unit. Tail-suspension was used to simulate the weightlessness condition. The expression of NF-κB p65 was detected by Western blotting analysis and PV-6001 immunohistochemistry respectively.
RESULTS: The tail-suspended rats were upset at the beginning, and seemed adapted to the microgravity condition after 2 to 3 days. Tail-suspension significantly increased liver NF-κB expression in rats, as compared with the controls (F = 271.36, P < 0.01), with peak expression on day 1 and 2, followed by a gradual decline to the normal level on day 5, 6 and 7 (F = 60.68, P < 0.05). NF-κB expression stained as brown particles was mainly detected in rat hepatocytes, also in the infiltrated cells and Kupffer cells. There were three types of intracellular expression according to the location of positive NF-κB particles, i.e. cytoplasm, nucleus, and cytoplasm plus nucleus, existing alone or co-existing in rat liver.
CONCLUSION: Simulated weightlessness, especially in the early stage, acts as a kind of stress to induce the activation of NF-κB in liver tissues of rats, suggesting that NF-κB plays an important role in the cascade reactions and adaptation to the weightlessness stress.
- Citation: Cui Y, Dong JH, Zhang M, Zhou JL, Liu ZP, Wang P, Li CL, Zhang JZ. Expression of nuclear factor-kappa B and its significance in liver tissues of rats during simulated weightlessness. Shijie Huaren Xiaohua Zazhi 2008; 16(31): 3480-3484
- URL: https://www.wjgnet.com/1009-3079/full/v16/i31/3480.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i31.3480
微重力环境对于机体来说, 是一种特殊类型的不良刺激. 机体在失重环境中发生诸多变化, 导致一系列病理生理改变[1]. 肝脏受到瀑布式的直接和间接的失重应激作用, 正常生理机能受到影响. Merrill et al[2]研究搭乘Cosmos 2044生物卫星大鼠的肝脏, 发现失重可对肝脏的蛋白质、糖原及多种酶的代谢产生重要影响. Abraham et al[3]研究搭乘苏联Cosmos 936生物卫星的大鼠, 发现肝脏的部分代谢酶水平发生变化, 但短期后即能恢复. Rivera et al[4]进行地面模拟失重动物实验, 发现微重力环境下胃肠道蠕动缓慢, 菌群移位, 黏膜屏障发生障碍, 导致内毒素成分进入门静脉而对肝脏造成损伤. 近年来, 我国航天事业迅猛发展, 航天员特殊训练和载人航天飞行的成功及后续重大任务对航天医学提出了新的要求, 但迄今国内尚未见有关失重和模拟失重应激环境下肝脏生理和病理研究的报道[5]. 本研究通过尾悬吊法模拟失重动物实验, 观察实验大鼠肝脏组织中NF-κB表达特性, 探讨失重环境对肝脏造成的影响及其机制.
清洁级成年健康♂Wistar大鼠84只, 体质量280-310 g, 由中国农业大学实验动物研究所提供. NF-κB mAb(Sigma, USA), GAPDH(Ambion, USA), 碱性磷酸酶标记山羊抗小鼠IgG(GAR-AP, Zymed, USA). NF-κB p65 mAb(Santa Cruz, USA), PV-9000即用型二步法检测盒(北京中山生物技术有限公司). NBT(Sigma, USA), BCIP(Sigma, USA), DTT(Sigma, USA), PVDF膜(Bio-Rad Laboratories, Hercules, USA), TEMED(Sigma, USA). 转膜仪(Bio-Rad Laboratories, Hercules, USA), 低温离心机5810R(Eppendorf, Hamburg, Germany), 微型高速离心机(Eppendorf, Hamburg, Germany), 垂直电泳槽(Bio-Rad Laboratories, Hercules, USA), 琼脂糖水平电泳槽(Bio-Rad Laboratories, Hercules, USA), 凝胶成像系统(AlphaImagerTM 2200, USA).
1.2.1 分组: 大鼠适应饲养1 wk后进行实验. 随机分为模拟失重组和对照组, 每组又分别设1、2、3、4、5、6及7 d共7个时相点, 每时相点模拟失重和同步对照各6只大鼠.
1.2.2 造模与取材: 参照陈杰 et al的方法采用尾悬吊法建立模拟失重大鼠模型[6]. 大鼠单笼饲养, 实验组大鼠尾部悬于笼顶, 前肢踏于笼底. 对照组大鼠置于相同鼠笼中, 自由活动. 所有大鼠可自由进食、饮水. 动物室温度保持在23℃±2℃, 每天灯光照明12 h与黑暗交替循环, 保持适当湿度及通风条件. 各时相点实验结束时, ip戊巴比妥钠(45 mg/kg)将实验及对照动物麻醉, 无菌操作, 经腹正中线剖腹, 取肝右叶组织保存于液氮中, 左叶肝组织浸入40 g/L中性甲醛中固定.
1.2.3 Western blot检测大鼠肝组织NF-κB蛋白表达: (1)蛋白质提取: 从液氮中取出肝组织, 放入玻璃匀浆器中, 加入200 μL细胞裂解液, 在冰上将组织制成匀浆并在液氮中反复冻溶裂解细胞3-5次, 然后转移至离心管中, 4℃高速离心(12 000 r/min)80 min. 吸出上清液, 分装, -80℃保存备用; (2)加样, 电泳, 160 V, 1 h; (3)转膜: 电泳完毕后切取60-94 kDa和27-45 kDa区, 转膜液浸泡20 min, 转膜100 V, 100 min; (4)免疫反应: 水平摇床上用TBST浸泡PVDF膜10 min, 室温下脱色摇床上摇动封闭1-3 h, 用TBS稀释一抗NF-κB 1:200, GAPDH 1:10000, 与PVDF膜一起4℃条件下摇动孵化过夜. 然后用TBST在脱色摇床上洗10 min×3次. 加TBS稀释碱性磷酸酶标记的二抗与PVDF膜在常温下育孵2-3 h, 继用TBST在脱色摇床上洗10 min×3次; (5)显色: 用碱性磷酸酶底物BCIP/NBT显色10 min.
1.2.4 免疫组化检测大鼠肝组织NF-κB表达: (1)免疫组化PV-6001法: 常规切片, 脱蜡至水; 3%过氧化氢室温10 min以阻断内源性过氧化物酶; PBS冲洗3 min×3次, 枸橼酸钠高压锅热修复2 min后自然冷却, PBS洗3 min×3次; 加入一抗NF-κB(1:100)于湿盒中4℃过夜; PBS洗3 min×3次, 加入辣根酶羊抗兔多聚体, 室温30 min; PBS洗3 min×3次; 染色按照PV-9000即用型二步法检测盒说明进行操作. 用PBS缓冲液代替一抗作为阴性对照; (2)NF-κB阳性表达判定: 以细胞核和(或)胞质中有明显的棕黄色颗粒为阳性. 每张切片随机计数5个高倍视野(×400)下的阳性细胞数, 切片边缘视野不计, 以排除"边缘效应"的干扰. 阳性指数以NF-κB阳性细胞占所有细胞的百分率(%)表示.
统计学处理 数据以mean±SD表示, 结果用SPSS11.0统计软件进行t检验和方差分析. P<0.05认为有统计学意义.
本研究各组动物在实验期间无死亡. 在尾悬吊1-2 d, 大鼠焦躁不安, 饮食量减少, 精神较差, 活动减弱, 2-3 d后有所适应, 逐渐恢复稳定状态.
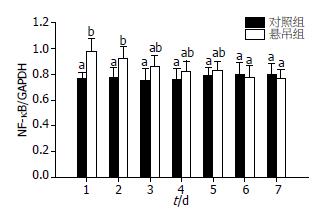
肝组织中NF-κB的Western blot分析结果表明, 各实验组及对照组大鼠肝脏组织中均可检测到70 kDa的NF-κB表达(图1). 与对照组比较, 模拟失重1 d组大鼠肝脏组织中NF-κB蛋白水平显著升高, 并形成高峰, 差异有统计学意义(F方差值 = 13.27, P<0.05). 随着模拟失重时间的延长, NF-κB蛋白表达水平呈下降趋势, 其中3-5 d组NF-κB仍在较高水平表达, 与对照组相比差异不显著. 而6-7 d组NF-κB表达则低于正常对照, 差异无统计学意义(图2).
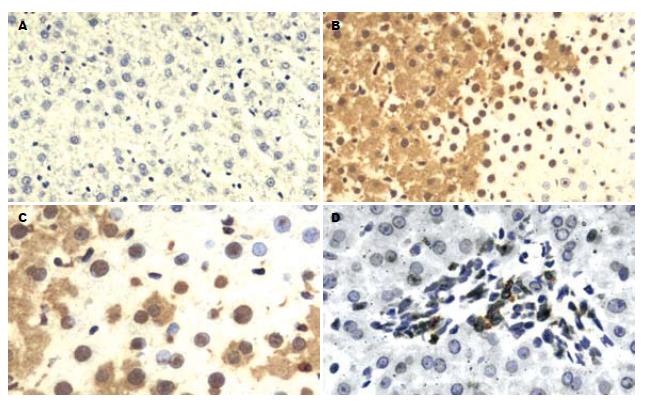
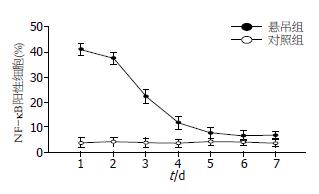
NF-κB阳性产物主要见于实验大鼠的肝细胞内, 亦可见于炎细胞及Kupffer细胞内. 棕黄色颗粒状的NF-κB表达位于细胞质及细胞核中, 分布不均, 呈单个散在或小片状分布, 可分为胞质型、核型、核浆型等三个类型, 单独或混合存在. 在肝细胞核型表达阳性中, 可见全核阳性者, 也可见局部碎点状阳性者, 且主要位于核仁区(图3). 结果显示, 1、2 d悬尾组大鼠肝组织中NF-κB表达率明显高于对照组(F方差值 = 271.36, P<0.01), 随着模拟失重时间的延长, NF-κB表达水平呈明显下降趋势(F方差值 = 60.68, P<0.05), 5-7 d悬尾组NF-κB表达水平接近对照组, 差异无统计学意义(图4).
NF-κB是Sen和Baltimore于1986年首先报道从B淋巴细胞核抽提物中检出的可与免疫球蛋白轻链基因增强子κB序列特异结合的核蛋白因子[7]. NF-κB广泛存在于真核细胞内, 属于Rel蛋白家族, 为二聚体蛋白分子, 包含多种亚单位结构, NF-κB p65是其主要成员之一, 表达最广泛, 相对稳定, 生物活性最强. NF-κB调控大量基因的表达与活性, 介导多种炎性介质和急性期反应蛋白等的转录表达, 参与细胞凋亡的调节, 具有多向性特征. 通常情况下, 细胞内NF-κB与IκB抑制蛋白结合在一起, 处于失活状态. 多种因素可激活NF-κB, 活化后的NF-κB从细胞质转移到细胞核内的DNA特定黏附部位, 进而启动和调控转录程序, 发挥生物学效应[7-9].
研究发现, NF-κB与肝脏的多种病变相关, 在肝脏的急性损伤过程中发挥重要作用[10]. 杨文军 et al[11]报道大鼠创伤性炎症肝脏损伤后NF-κB活性明显升高, 与肝脏结构和功能改变基本一致. Salazar-Montes et al[12]研究发现肝脏急性损伤30 min后NF-κB即被激活. 王春妍 et al[13]研究认为, NF-κB通过调控其下游基因加重肝脏损伤.
失重和模拟失重环境下肝脏NF-κB的表达特征如何? 国内外尚未见研究报道. 本实验结果发现, 在模拟失重早期(48 h内), 大鼠肝脏组织中NF-κB表达水平明显升高, 应用Western blot半定量检测和免疫组化PV6001组织染色的结果一致. 分析NF-κB的这种变化, 可能缘自失重环境所造成的肝脏分子水平的应激反应. Wise et al[14]的研究表明, 微重力环境引起脑组织氧化应激(oxidative stress)并活化NF-κB, 引发转录因子高表达. 近期还有学者研究发现, NF-κB在模拟失重小鼠睾丸组织中表达异常, 伴随睾丸重量减轻和睾酮水平下降的同时, NF-κB以及Caspase-8和Caspase-3的表达水平明显升高, 认为失重环境导致NF-κB及Caspase-8、Caspase-3过度活化进而激活了与细胞凋亡有关的信号通路[15]. 显然, 模拟失重环境下肝组织NF-κB高表达应是肝脏失重应激反应的一部分, 对NF-κB高表达是否导致肝脏细胞凋亡笔者将做进一步研究. 本实验还发现, 在尾悬吊初期, 大鼠焦躁不安, 饮食量减少, 精神较差, 活动减弱, 而24-48 h后则有所适应, 逐渐恢复稳定状态, 这一现象与肝组织中NF-κB表达先升后降的结果似乎同步, 提示肝脏NF-κB表达在失重耐受(microgravity tolerance)过程中亦可能发挥一定作用. 理论上推测, NF-κB表达及基因调控对失重应激环境可形成一种应激耐力, 此机制是否成立及其在航天员强化训练中的意义则有待深入研究.
本研究结果显示, 实验大鼠肝组织中NF-κB阳性产物主要见于肝细胞, 亦见于炎细胞及Kupffer细胞. 笔者依据NF-κB在细胞内表达部位的不同而将其分为胞质型、核型、核浆型等三种类型, 各种类型可单独或混合存在. 在核型NF-κB阳性表达类型中, 可见全核阳性者, 也可见局部碎点状阳性者, 且主要位于核仁区. 分析认为, NF-κB在肝脏细胞内的分布及其表达特征说明了NF-κB的应激活化和发挥生物学效应的程序、部位、强度及消长过程; 核仁是rRNA基因存储、rRNA合成加工以及核糖体亚单位的装配场所, NF-κB在核仁功能区染色形态的不同, 可能涉及失重应激反应的程度及时相效应, 与NF-κB功能演变和对靶基因信息转录的调控力度有关.
总之, 在失重应激环境中, 肝脏乃至机体全身的应激损伤、保护与适应, 基因调控过程的启动、瀑布效应与反馈等机制, 显然是一个十分复杂的系统, NF-κB在其中发挥的具体作用以及所涉及的其他介导因素, 尚需要进一步探讨.
机体在失重环境中受到瀑布式的直接和间接的失重应激作用, 正常生理机能受到影响. 近年来, 我国航天事业迅猛发展, 航天员特殊训练和载人航天飞行的成功及后续重大任务对航天医学提出了新的要求, 但迄今国内尚未见有关失重和模拟失重应激环境下肝脏生理和病理研究的报道.
丁惠国, 主任医师, 首都医科大学附属北京佑安医院肝病消化科
NF-κB控制着大量基因的激活, 介导多种炎性介质和急性期反应蛋白等的转录表达, 参与细胞凋亡的调控. NF-κB在机体应激反应过程中的重要作用及机制是目前研究的热点问题.
研究尾悬吊模拟失重大鼠肝脏组织中NF-κB的表达特点并探讨其作用机制, 国内外尚未见类似研究报道.
本研究应用Western blot和免疫组化PV-6001法研究模拟失重大鼠肝脏组织中NF-κB表达特性, 发现在模拟失重环境中实验大鼠肝脏NF-κB表达发生明显变化, 其早期高表达及渐降过程与失重应激反应和失重耐受有一定关系.
本研究为进一步探讨失重和模拟失重环境对肝脏的影响奠定基础, 为航天员特殊强化训练及航天飞行过程中的有害因素防护及保健提供理论基础.
本文立题新颖, 设计合理, 结果可信, 对我国航空航天员的合理训练可能有一定的指导作用.
编辑: 李军亮 电编:何基才
| 1. | Graebe A, Schuck EL, Lensing P, Putcha L, Derendorf H. Physiological, pharmacokinetic, and pharmacodynamic changes in space. J Clin Pharmacol. 2004;44:837-853. [PubMed] [DOI] |
| 2. | Merrill AH Jr, Wang E, LaRocque R, Mullins RE, Morgan ET, Hargrove JL, Bonkovsky HL, Popova IA. Differences in glycogen, lipids, and enzymes in livers from rats flown on COSMOS 2044. J Appl Physiol. 1992;73:142S-147S. [PubMed] |
| 3. | Abraham S, Lin CY, Volkmann CM, Klein HP. Biochemical changes in rat liver after 18.5 days of spaceflight. Proc Soc Exp Biol Med. 1983;172:334-339. [PubMed] |
| 4. | Rivera CA, Tcharmtchi MH, Mendoza L, Smith CW. Endotoxemia and hepatic injury in a rodent model of hindlimb unloading. J Appl Physiol. 2003;95:1656-1663. [PubMed] |
| 7. | Sen R, Baltimore D. Inducibility of kappa immunoglobulin enhancer-binding protein Nf-kappa B by a posttranslational mechanism. Cell. 1986;47:921-928. [PubMed] [DOI] |
| 8. | Leeman JR, Gilmore TD. Alternative splicing in the NF-kappaB signaling pathway. Gene. 2008;423:97-107. [PubMed] [DOI] |
| 10. | Czaja MJ. Cell signaling in oxidative stress-induced liver injury. Semin Liver Dis. 2007;27:378-389. [PubMed] [DOI] |
| 11. | 杨 文军, 余 正平, 张 启瑜, 宋 其同, 梁 华平, 徐 祥, 朱 冠保, 施 红旗, 蒋 飞照. 核因子-κB活性在创伤性炎症大鼠肝脏损伤中的变化及其意义. 肝胆胰外科杂志. 2006;18:13-15. |
| 12. | Salazar-Montes A, Ruiz-Corro L, Sandoval-Rodriguez A, Lopez-Reyes A, Armendariz-Borunda J. Increased DNA binding activity of NF-kappaB, STAT-3, SMAD3 and AP-1 in acutely damaged liver. World J Gastroenterol. 2006;12:5995-6001. [PubMed] |
| 13. | 王 春妍, 范 玉强, 迟 宝荣, 曹 武奎, 李 海. 核因子-kappa B及其下游因子TNF-alpha、Bcl-2在急性肝损伤中的作用及机制. 世界华人消化杂志. 2008;16:2804-2808. [DOI] |
| 14. | Wise KC, Manna SK, Yamauchi K, Ramesh V, Wilson BL, Thomas RL, Sarkar S, Kulkarni AD, Pellis NR, Ramesh GT. Activation of nuclear transcription factor-kappaB in mouse brain induced by a simulated microgravity environment. In Vitro Cell Dev Biol Anim. 2005;41:118-123. [PubMed] [DOI] |
| 15. | Sharma CS, Sarkar S, Periyakaruppan A, Ravichandran P, Sadanandan B, Ramesh V, Thomas R, Hall JC, Wilson BL, Ramesh GT. Simulated microgravity activates apoptosis and NF-kappaB in mice testis. Mol Cell Biochem. 2008;313:71-78. [PubMed] [DOI] |