修回日期: 2008-09-17
接受日期: 2008-09-22
在线出版日期: 2008-10-28
目的: 探讨氧化应激(OS)在大鼠创伤性脑损伤(TBI)后应激性肝损害(HSI)中的作用.
方法: 用改良Allen法建立TBI模型. 40只健康Wister大鼠随机分为5组, 正常对照组、颅脑致伤后6、12、24、48 h时相组. 酶学法检测血清ATL和AST水平, ABC-ELISA法测定血清TNF-α水平. 硫代巴比妥酸法测定MDA水平变化, 化学发光法测定SOD水平变化. 光镜及电镜下观察肝脏组织学改变.
结果: 颅脑致伤后12 h, 各组血ALT和AST、TNF-α水平及肝组织MDA明显增加, 肝组织SOD显著减少, 与对照组比较差异均显著(252.92±56.29 vs 41.17±7.88; 283.12±45.28 vs 45.22±6.57; 1138.27±212.02 vs 210.56±28.22; 15.21±0.36 vs 6.14±0.25; 78.13±3.12 vs 135.58±5.58, P<0.01或0.05); TBI各组光镜和电镜可观察到肝组织不同程度受损.
结论: TBI后早期可出现HSI, OS可能参与了其发病过程.
引文著录: 朱玉群, 栾伟华, 王燕斌, 王天懿, 杨昭徐. 氧化应激在大鼠创伤性脑损伤后应激性肝损害中的作用. 世界华人消化杂志 2008; 16(30): 3433-3436
Revised: September 17, 2008
Accepted: September 22, 2008
Published online: October 28, 2008
AIM: To explore the effect of oxidative stress (OS) on hepatic stress injury (HSI) secondary to traumatic brain injury (TBI).
METHODS: The animal model was established using an improved Allen's method. Forty healthy male Wistar rats had been divided randomly into five groups: control group and 6, 12, 24 and 48 h TBI posttraumatic groups. The serum levels of ALT and AST were measured using enzymic assay. The serum tumor necrosis factor-α (TNF-α) was detected using ABC-ELISA technique. The MDA values of liver tissue were measured with thiobarbituric acid method, and SOD of liver tissue was measured using chemiluminescence. And pathological changes of liver tissue were observed under light and electronic microscopy.
RESULTS: At early period of HSI, the serum levels of ALT, AST and TNF-α and the MOD values of liver tissue were markedly increased in all TBI groups, and the SOD values of liver tissue were significantly decreased compared with control group (252.92 ± 56.29 vs 41.17 ± 7.88; 283.12 ± 45.28 vs 45.22 ± 6.57; 1138.27 ± 212.02 vs 210.56 ± 28.22; 15.21 ± 0.36 vs 6.14 ± 0.25; 78.13 ± 3.12 vs 135.58 ± 5.58, P < 0.01 or 0.05). Liver tissue injuries at varied degrees were observed under light and electron microscopy in each TBI group.
CONCLUSION: Oxidative stress may be involved in the pathogenesis of HSI which occurs early secondary to traumatic brain injury.
- Citation: Zhu YQ, Luan WH, Wang YB, Wang TY, Yang ZX. Effect of oxidative stress on hepatic stress injury following traumatic brain injury in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(30): 3433-3436
- URL: https://www.wjgnet.com/1009-3079/full/v16/i30/3433.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i30.3433
创伤性脑损伤(traumatic brain injury, TBI)后可出现内脏并发症[1-2], 不仅增加了治疗的复杂性, 还是导致患者死亡的直接原因. 应激性肝损害(hepatic stress injury, HSI)是一种常见而又不易被觉察到的内脏损害, 发生于多种临床病理生理过程, 影响机体多方面功能, 发病机制尚未阐明[3-4]. 本研究拟通过观察TBI后不同时期的大鼠肝功能、氧自由基(oxygen free radicals, OFRs)和肝脏超微结构改变等, 探讨氧化应激(oxidative stress, OS)在TBI后HSI发病中的作用.
40只♂Wister大鼠, 体质量250-280 g.
1.2.1 分组: 实验大鼠随机分为5组: 正常对照组(C)和TBI后6、12、24、48 h时相组(T6、T12、T24、T48), 每组8只. 采用改良Allen自由落体撞击伤法[5]建立TBI模型.
1.2.2 血清ATL、AST和TNF-α检测: 左心室取血, ATL、AST采用酶学法, TNF-α采用ABC-ELISA法测定.
1.2.3 肝组织MDA、SOD检测: 取肝组织200 mg制备组织匀浆, 硫代巴比妥酸法测定MDA, 化学发光法测定SOD, Lorry法测定匀浆液蛋白含量. 试剂盒由南京生物工程研究所提供.
1.2.4 病理学检查: 取肝右后叶组织标本, 光镜、电镜下观察组织学改变.
统计学处理 采用SPSS11.0统计学软件包处理数据. 结果用mean±SD表示. 组间比较采用t检验或F检验, P<0.05为差异显著.
TBI后各组大鼠血清ALT于伤后6 h明显升高, 24 h达峰值水平. AST于伤后12 h开始升高, 峰值在48 h(表1). 血清TNF-α于伤后6 h开始上升, T12达峰值(表1).
肝脏组织MDA于伤后6 h明显升高, 24 h达峰值. SOD于12、24、48 h均显著低于对照组(表2).
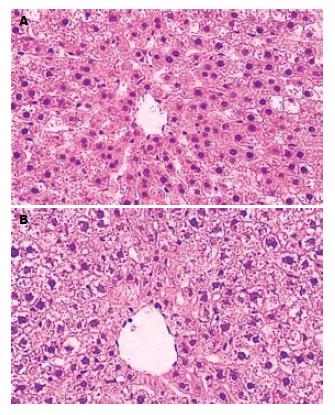
光镜下, 伤后12 h可见细胞空泡变性; 24 h见胞质广泛水肿, 少许核破碎; 48 h见多处核破碎、细胞膜消失融合(图1).
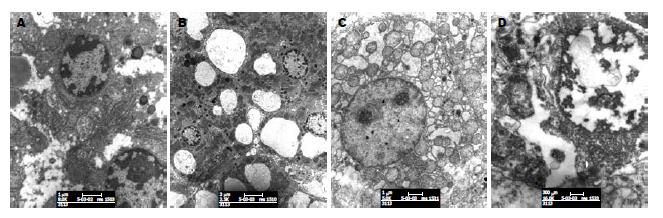
电镜下伤后6 h见肝窦扩张、Disse间隙增宽, 少量核染色质边集. 12 h见空泡变, 广泛核染色质凝聚边集. 24 h见广泛胞质水肿, 大量空泡形成, 枯否细胞增多, 核破碎, 内质网高度扩张. 48 h见细胞胞膜消失融合, 细胞器大量崩解, 核固缩深染, 核破碎崩解; 枯否细胞核内染色质凝聚(图2).
本组实验显示大鼠TBI后6 h即有血清肝酶升高和肝脏组织学改变, 并随病程延长肝损害由变性到坏死呈逐渐加重趋势, 支持肝脏是TBI早期易受损伤的脏器之一.
关于HSI的发病机制尚不清楚, 可能是多因素共同作用的结果[6-9], OS损伤可能是重要机制之一[10]. 本组实验发现, 肝组织MDA于TBI后6 h各组均明显升高, SOD于伤后12 h均显著降低, 与肝酶和肝病理改变一致, 支持这个观点.
TBI后, 机体首先通过"脑-内脏反射", 引起肝脏缺血、再灌注损伤(hepatic ischemia -reperfusion injury, HIRl)[11-12], 一方面肝脏在缺血时, 线粒体呼吸链功能失调, 氧被还原, 生成活性OFRs. 另一方面, 缺血时黄嘌呤脱氢酶转化为黄嘌呤氧化酶, 后者在分子氧存在时催化次黄嘌呤代谢过程中, 产生超OFRs. SOD为机体主要的自由基清除酶, 肝脏有效血流量下降造成内源性OFRs清除剂SOD下降, 同时SOD合成减少, OFRs清除不足, 反过来又进一步抑制SOD的活性. SOD活性下降引发脂质过氧化物, 在金属离子存在下催化裂解产生MDA, MDA对细胞有毒性作用, 可与蛋白质分子内和分子间交联, 损害肝细胞.
此外, OS可通过TNF-α介导引起肝损害, 二者互为因果. 本研究中TBI后各时相组TNF-α的显著升高, 表明TNF-α也参与了HSI的发病过程. TNF-α在OS时可大量产生, 通过迅速启动单核-巨噬细胞系统, 促进趋化因子和黏附因子的合成, 促成中性粒细胞在肝内聚集与激活的级联反应; TNF-α反过来又可诱导OFRs大量生成. 有学者[13]通过实验发现自由基在介导TNF后, 通过呼吸爆发, 释放大量的超氧阴离子、过氧化氢等. 此外, TNF-α还可通过刺激其他促炎介质的生成, 如IL-1、IL-6、IL-8等, 扩大其生物学效应[14-15].
总之, HSI可发生于TBI后早期, OS是其重要机制之一, OS可能通过与TNF-α级联或协同作用, 引起或加重HSI.
铂创伤性脑损伤(TBI)后可出现多种内脏并发症, 应激性肝损害(HSI)是其中常见而又不易被觉察到的内脏损害, 引起机体多方面功能障碍, 影响患者的治疗和预后, 但其发病机制尚未阐明.
张锦生, 教授, 复旦大学上海医学院病理学系; 姜春萌, 教授, 大连医科大学附属第二医院消化科.
HSI的发病机制尚不清楚, 涉及肠黏膜屏障功能、内毒素血症、细胞早期凋亡、炎性介质、氧化应激(OS)等, 可能为多因素共同作用的结果, 其中OS性损伤可能是其中关键因素之一.
该研究以改良Allen氏法建立创伤性脑损伤引起的HSI模型, 观察氧自由基和肝脏形态的动态改变, 得出TBI后早期可出现HSI, OS可能参与其发病过程的结论.
由于肝损伤可引起细菌、内毒素逃逸和炎性介质扩增, 是MODS的重要环节之一. 因此对OS等因素在TBI后HSI发病中的作用研究, 对临床预防和控制"脑-内脏综合症"的发生和发展、提高重症患者的生存率具有指导意义.
本文以改良Allen氏法建立创伤性脑损伤引起的HIS模型, 观察氧自由基和肝脏形态的动态改变, 未见报道, 有一定的新意和学术价值.
编辑: 李军亮 电编:何基才
| 2. | Zygun D. Non-neurological organ dysfunction in neurocritical care: impact on outcome and etiological considerations. Curr Opin Crit Care. 2005;11:139-143. [PubMed] [DOI] |
| 3. | Szabo G, Romics L Jr, Frendl G. Liver in sepsis and systemic inflammatory response syndrome. Clin Liver Dis. 2002;6:1045-1066, x. [PubMed] [DOI] |
| 4. | Streetz KL, Wüstefeld T, Klein C, Manns MP, Trautwein C. Mediators of inflammation and acute phase response in the liver. Cell Mol Biol (Noisy-le-grand). 2001;47:661-673. [PubMed] |
| 6. | Ott L, McClain CJ, Gillespie M, Young B. Cytokines and metabolic dysfunction after severe head injury. J Neurotrauma. 1994;11:447-472. [PubMed] |
| 7. | Kamei H, Yoshida S, Yamasaki K, Tajiri T, Ozaki K, Shirouzu K. Severity of trauma changes expression of TNF-alpha mRNA in the brain of mice. J Surg Res. 2000;89:20-25. [PubMed] [DOI] |
| 8. | Fang CW, Yao YM, Zhai HX, Yu Y, Wu Y, Lu LR, Sheng ZY, Sheng CY. Tissue lipopolysaccharide-binding protein expression in rats after thermal injury: potential role of TNF-alpha. Burns. 2004;30:225-231. [PubMed] [DOI] |
| 9. | Xie GQ, Jiang JX, Chen YH, Liu DW, Zhu PF, Wang ZG. Induction of acute hepatic injury by endotoxin in mice. Hepatobiliary Pancreat Dis Int. 2002;1:558-564. [PubMed] |
| 10. | Jaeschke H. Reactive oxygen and mechanisms of inflammatory liver injury. J Gastroenterol Hepatol. 2000;15:718-724. [PubMed] [DOI] |
| 11. | Suzuki M, Takeuchi H, Kakita T, Unno M, Katayose Y, Matsuno S. The involvement of the intracellular superoxide production system in hepatic ischemia-reperfusion injury. In vivo and in vitro experiments using transgenic mice manifesting excessive CuZn-SOD activity. Free Radic Biol Med. 2000;29:756-763. [PubMed] [DOI] |
| 12. | Tselepidis S, Papazoglou L, Dessiris A, Vlemas I, Papageorgiou G, Stournara A, Minas A. Liver injury after ischemia and reperfusion: the role of oxygen free radicals. Mil Med. 2004;169:531-535. [PubMed] |
| 13. | Camussi G, Montrucchio G, Dominioni L, Dionigi R. Septic shock--the unravelling of molecular mechanisms. Nephrol Dial Transplant. 1995;10:1808-1813. [PubMed] |
| 14. | Sheron N, Williams R. IL-8 as a circulating cytokine: induction by recombinant tumour necrosis factor-alpha. Clin Exp Immunol. 1992;89:100-103. [PubMed] |