修回日期: 2008-10-08
接受日期: 2008-10-14
在线出版日期: 2008-10-28
目的: 研究青藤碱对三硝基苯磺酸诱导的实验性结肠炎的防治作用.
方法: 三硝基苯磺酸/乙醇制备大鼠结肠炎模型, 40只SD大鼠随机均分为正常组、模型组、5-ASA组及青藤碱治疗组. 正常组与模型组每天每只给予生理盐水2 mL, 5-ASA组给予5-ASA 100 mg/(kg·d), 青藤碱组给予青藤碱120 mg/(kg·d), 连续灌胃14 d. 评价各组大鼠结肠大体形态损伤指数(CMDI)和组织学损伤指数(TDI), ELISA法检测血清TNF-α、MMP-2和MMP-9含量, 免疫组织化学法检测结肠组织MMP-2和MMP-9的表达.
结果: 模型组大鼠CMDI、TDI, 血清TNF-α、MMP-2和MMP-9含量, 结肠组织MMP-2和MMP-9表达均显著高于正常组(均P<0.01), 5-ASA和青藤碱能明显减弱CMDI和TDI(1.30±1.16, 1.00±0.82 vs 6.50±1.27; 1.10±1.20, 0.90±0.99 vs 5.10±0.74, 均P<0.01), 降低血清TNF-α、MMP-2和MMP-9含量及结肠组织MMP-2和MMP-9的表达(35.37±4.44, 32.50±4.91 vs 74.72±5.30; 2.44±0.83, 2.50±0.82 vs 10.40±2.10; 5.88±1.84, 5.32±1.81 vs 15.85±2.39; 1.30±1.25, 1.00±0.94 vs5.00±1.41; 1.50±1.35, 1.40±0.97 vs 6.30±0.67; 均P<0.01), 5-ASA组与青藤碱组差异无显著统计学意义.
结论: 青藤碱能明显降低结肠炎大鼠TNF-α、MMP-2和MMP-9的表达, 对大鼠结肠炎发挥良好的抗炎作用.
引文著录: 周国胜, 吴正祥, 杨九华, 吴强, 杨枫, 周进. 青藤碱对结肠炎大鼠基质金属蛋白激酶的作用. 世界华人消化杂志 2008; 16(30): 3387-3393
Revised: October 8, 2008
Accepted: October 14, 2008
Published online: October 28, 2008
AIM: To evaluate the preventive and therapeutic effect of sinomenine on experimental rats with 2, 4, 6-trinitrobenzene sulfonic acid (TNBS)/ ethanol induced colitis.
METHODS: The colitis model of rats was established with TNBS/ethanol. Forty rats were randomly divided into four treatment groups (n = 10): normal control group (Receiving normal saline, 2 mL), model group (normal saline, 2 mL), 5-ASA treatment group [100 mg/(kg·d)], and sinomenine treatment group [120 mg/(kg·d)]. After continuous administration for 14 d, the colon macroscopic damage index (CMDI) and the tissue damage index (TDI) in each group were evaluated respectively. Serum Levels of TNF-α, MMP-2 and MMP-9 were detected using ELISA, and the expressions of MMP-2 and MMP-9 in the colon tissues of rats were detected using immunohistochemical method.
RESULTS: The CMDI and TDI, the serum levels of TNF-α, MMP-2 and MMP-9, the expressions of MMP-2 and MMP-9 in colon tissues were significantly higher in model group than in normal group respectively (all P < 0.01). 5-ASA and sinomenine reduced the CMDI and TDI (1.30 ± 1.16, 1.00 ± 0.82 vs 6.50 ± 1.27; 1.10 ± 1.20, 0.90 ± 0.99 vs 5.10 ± 0.74, all P < 0.01), and decreased significantly the levels of TNF-α, MMP-2 and MMP-9 in blood serum and the expressions of MMP-2, MMP-9 in the colon tissues (35.37 ± 4.44, 32.50 ± 4.91 vs 74.72 ± 5.30; 2.44 ± 0.83, 2.50 ± 0.82 vs 10.40 ± 2.10; 5.88 ± 1.84, 5.32 ± 1.81vs 15.85 ± 2.39; 1.30 ± 1.25, 1.00 ± 0.94 vs 5.00 ± 1.41; 1.50 ± 1.35, 1.40 ± 0.97 vs 6.30 ± 0.67; all P < 0.01). No significant difference was detected between 5-ASA treatment group and sinomenine treatment group.
CONCLUSION: Sinomenine reduces significantly the levels of TNF-α, MMP-2 and MMP-9 in TNBS-induced colitis in rats, hence produces good anti-inflammatory effect on colitis in rats.
- Citation: Zhou GS, Wu ZX, Yang JH, Wu Q, Yang F, Zhou J. Effects of sinomenine on matrix metalloproteinases of trinitrobenzene sulfonic acid-induced colitis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(30): 3387-3393
- URL: https://www.wjgnet.com/1009-3079/full/v16/i30/3387.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i30.3387
炎症性肠病(inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 受遗传、环境、免疫和精神心理等因素影响, 为肠道非特异性炎症性疾病. 基质金属蛋白激酶(matrix metalloproteinases, MMP)是具有降解细胞外基质成分(extracellular matrix, ECM)效应的一种内肽酶类. 肠黏膜组织ECM的代谢主要受MMP调控, 代谢紊乱会导致肠黏膜屏障破坏, 引起肠黏膜糜烂溃疡形成[1]. 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)是公认的参与炎症性肠病炎症反应的炎性细胞因子. 青藤碱(sinomenine)是从中药青风藤中提取的生物碱单体, 临床多用其盐酸盐. 青藤碱具有显著的抗炎作用, 对体液免疫和细胞免疫均有不同程度的抑制作用. 青藤碱除发挥清除自由基[2]、抗炎及免疫调节等药理作用外, 还有镇静、镇痛和抗心律失常等作用. 并可抑制离体家兔或鼠的肠等平滑肌收缩, 对抗乙酰胆碱、组胺所致的肠痉挛. 青藤碱具有毒副作用小, 肠道易吸收等优点, 对体细胞无致突变活性, 不具有身体依赖性及精神依赖性, 可能无成瘾性. 为了探讨青藤碱对炎症性肠病是否具有抗损伤和保护作用, 本实验采用半抗原建立结肠炎大鼠模型, 青藤碱ig给药, 进行相关实验研究, 观察结肠炎大鼠TNF-α和MMP的表达及青藤碱对他们表达的影响.
清洁级♂SD大鼠40只(安徽医科大学动物实验中心), 体质量180-220 g; 盐酸青藤碱片剂(湖南正清制药集团股份有限公司, 20 mg/片, No: Z4300278); 5-氨基水杨酸颗粒(5-aminosalicylic, 5-ASA), (浙江众益药业有限公司, 0.25 g/粒, No: H20010061); 2, 4, 6-三硝基苯磺酸(trinitrobenzene sulfonic acide, TNBS), Sigma公司; MMP-2、MMP-9及TNF-α, 酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)试剂盒(武汉博士德生物技术有限公司); MMP-2、MMP-9一抗与过氧化物酶标记的链酶卵白素(SP)染色试剂盒(北京博奥森生物技术有限公司); DAB显示剂(北京中山生物技术有限公司).
1.2.1 实验设计与分组: 大鼠随机均分为4组: 正常组(N)、模型组(M)、5-ASA组(C)和青藤碱组(S). 采用TNBS/乙醇法构造结肠炎模型[3], 大鼠适应性饲养1 wk, 禁食不禁水24 h, 按30 mg/kg剂量ip 30 g/L戊巴比妥钠, 麻醉后, 倒悬位, 将直径约2 mm的聚丙烯管经肛门缓慢插入直肠约8 cm处, 正常组灌入生理盐水1 mL, 造模组灌入500 mL/L乙醇(30 mg TNBS)1 mL. 造模24 h后开始, ig, 每天1次, 5-ASA和青藤碱溶解于生理盐水, 浓度为10 g/L, 正常组与模型组给予生理盐水2 mL/只, ig, C组100 mg/(kg·d)5-ASA, ig, S组120 mg/(kg·d)青藤碱ig, 连续给药14 d.
1.2.2 标本采集: ig 14 d后, 禁食不禁水18 h, 处死动物, 采血, 离心(1500 r/min, 5 min), 留血清, -75℃保存待检. 游离结肠, 沿肠系膜纵轴剖开, 冰生理盐水清洗, 剪取病变明显处组织2 cm放于40 g/L多聚甲醛中固定, 石蜡包埋备用.
1.2.3 检测方法: ELISA法检测大鼠血清MMP-2、MMP-9及TNF-α的含量, 按试剂说明书操作. 免疫组织化学SP法检测大鼠结肠组织MMP-2、MMP-9的表达, 按试剂说明书操作, PBS代替一抗作为阴性对照, MMP-2和MMP-9阳性表达为棕黄色或棕褐色, 主要位于胞质, 胞核也可见少量表达.
1.2.4 指标评分: 结肠大体形态损伤指数(colon macroscopic damage index, CMDI)[4]观察结肠充血水肿、溃疡等变化. 组织学损伤指数(tissues damage index, TDI)[5]石蜡切片HE染色, 观察溃疡、炎性细胞浸润等变化. 免疫组织化学评分: 组织切片先于低倍镜下观察, 于染色相对密集区随机选取5个视野分别进行计数, 计数200个细胞, 以16D目镜测微网为面积单位在400倍放大下(面积为0.1024 mm2)计数阳性细胞数, 每例计数10个网格, 取其均值. 采用以下评分标准, 染色强度分为4级: 0 = 阴性, 1 = 弱阳性染色, 2 = 中度阳性, 3 = 强阳性染色; 每张切片按所见阳性细胞数/计数细胞的百分率分为5级: 0 = 阴性, 1 = 阳性细胞占1%-25%, 2 = 阳性细胞占26%-50%. 3 = 阳性细胞占51%-75%, 4 = 阳性细胞占76%-100%, 每张切片的染色积分以两者之和表示, 盲法评分.
统计学处理 数据以mean±SD表示, 运用SPSS13.0统计分析软件, 采用单因素方差分析及t检验, 以P<0.05为有统计学意义.
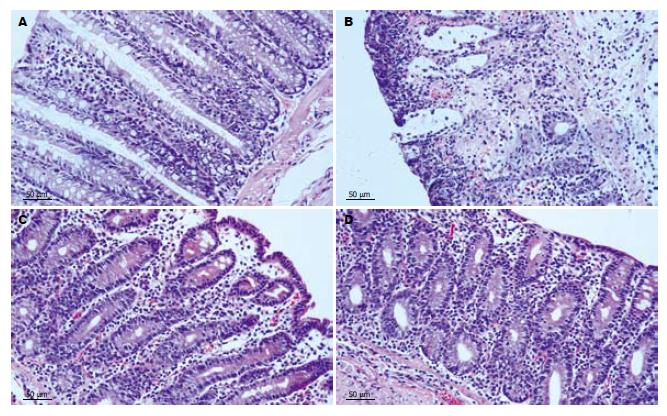
正常组黏膜皱襞纹理清晰, 无糜烂和溃疡等表现. 与正常组比较, 模型组(t = 14.436, P<0.01)肠管增粗, 肠壁增厚, 与外周组织粘连, 黏膜充血水肿明显, 糜烂及溃疡形成. 与模型组比较, 5-ASA组和青藤碱组(t = 9.565, t = 11.524, 均P<0.01)均有不同程度的改善, 肠管增粗与肠壁增厚不明显, 与外周组织粘连少, 黏膜充血水肿减轻, 糜烂及溃疡形成不明显. 5-ASA组与青藤碱组表现无显著差异性(t = 0.669, P = 0.512)(CMDI评分见表1). 镜下见正常组结肠黏膜上皮完整, 细胞形态正常, 固有层腺体排列规则, 含丰富的杯状细胞, 黏膜分泌正常, 固有层有少量淋巴细胞表达, 黏膜下层、肌层、浆膜层结构清晰. 模型组黏膜组织上皮坏死脱落, 黏膜及黏膜下层有大量中性粒细胞、淋巴细胞、浆细胞及嗜酸性粒细胞浸润, 可见出血性坏死, 腺体破坏且结构紊乱, 杯状细胞少, 隐窝脓肿形成, 可见范围较广的溃疡, 并深入到固有层, 与正常组比较有显著差异性(t = 18.233, P<0.01). 5-ASA组和青藤碱组均有不同程度的改善, 黏膜及黏膜下炎症细胞浸润少, 腺体结构改善, 充血水肿减轻, 增生的边缘上皮细胞覆盖溃疡面, 肉芽组织纤维化改变, 与模型组相比较, 表现差异显著性(t = 8.994, t = 10.726, 均P<0.01). 5-ASA组与青藤碱组无差异显著性(t = 0.406, P = 0.689)(表1, 图1).
与正常组比较, 模型组大鼠血清MMP-2、MMP-9及TNF-α的含量均显著增高(t = 14.25, t = 15.549, t = 23.926, 均P<0.01); 与模型组比较, 5-ASA组大鼠血清MMP-2、MMP-9及TNF-α的含量均明显降低(t = 11.174, t = 10.454, t = 17.985, 均P<0.01); 与模型组比较, 青藤碱组大鼠血清MMP-2、MMP-9及TNF-α的含量均明显降低(t= 11.109, t = 11.117, t = 18.468, 均P<0.01); 5-ASA组与青藤碱组大鼠血清MMP-2、MMP-9及TNF-α的含量比较, 无显著性差异(t = 0.171, P = 0.866; t = 0.689, P = 0.500; t = 1.367, P = 0.188)(表2).
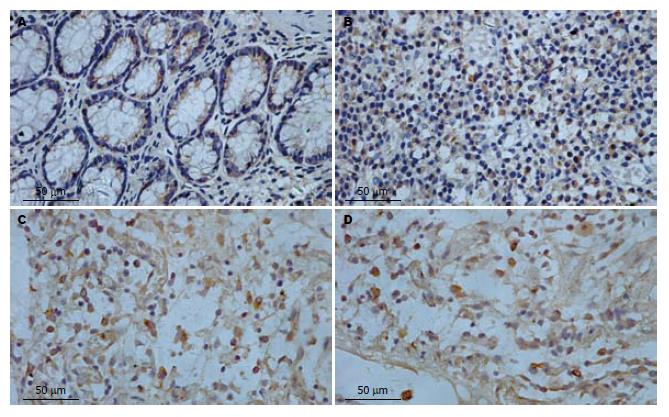
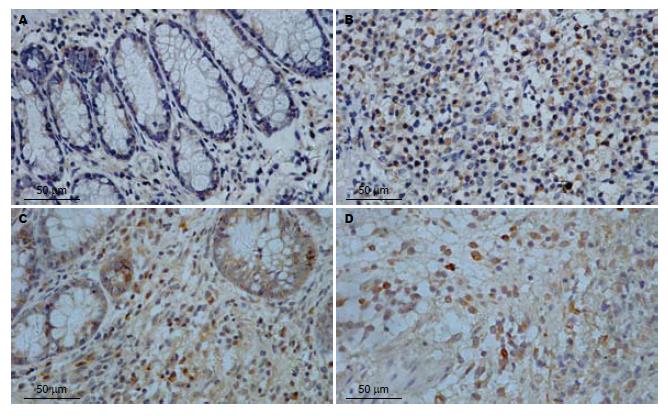
正常组结肠组织MMP-2、MMP-9有少量较弱的表达, 见于结肠黏膜、黏膜下层的炎性细胞和上皮细胞, 以胞质表达为主, 胞核也有少量表达. 与正常组比较, 模型组结肠组织MMP-2、MMP-9阳性表达显著增高(t = 9.242, t = 21.418, 均P<0.01), 主要分布在炎症和溃疡区的黏膜及黏膜下层, 主要表达于炎性细胞, 上皮细胞也可见表达, 主要表达于细胞胞质内, 细胞胞核也有少量表达. 5-ASA组MMP-2、MMP-9的表达显著低于模型组(t = 6.195, t = 10.033, 均P<0.01), 青藤碱组MMP-2、MMP-9的表达也显著低于模型组(t = 7.442, t = 13.148, 均P<0.01), 5-ASA组与青藤碱组MMP-2、MMP-9的表达无显著差异性(t = 0.605, t = 0.552; t = 0.190, P = 0.851)(表3, 图2-3).
模型组TNF-α与结肠组织和血清的MMP-2呈正相关(r = 0.950, r = 0.982, P<0.001); 与结肠组织和血清的MMP-9呈正相关(r = 0.929, r = 0.986, P<0.001). 模型组结肠组织MMP-2与血清MMP-2呈正相关(r = 0.941, P = 0.000); 结肠组织MMP-9与血清MMP-9呈正相关(r = 0.879, P = 0.001). 青藤碱组TNF-α与血清的MMP-2和MMP-9呈正相关(r = 0.993, r = 0.999, P<0.001); 与结肠组织的MMP-2和MMP-9呈正相关(r = 0.843, P = 0.002; r = 0.882, P = 0.001).
TNF-α是炎症反应中关键的细胞因子, 在UC[6]、CD[7]患者中TNF-α的表达显著增高, 实验性结肠炎[8]也表明TNF-α的高表达, TNF-α与其抑制因子之间分泌不平衡可能是IBD发病的原因[9]. 本研究模型大鼠TNF-α的含量显著高于正常组, 与文献报道一致. TNF-α具有广泛的生物活性, 能引起肠上皮内淋巴细胞增殖、分化及移位[10], 促进炎症细胞释放大量炎症因子, 引发肠上皮细胞凋亡, 破坏肠黏膜. 或经肌球蛋白轻链激酶(MLCK)[11]、蛋白激酶C(PKC)及丝裂原活化蛋白激酶(MAPK)等途径改变紧密连接蛋白功能, 增高肠黏膜屏障通透性, 引起肠黏膜屏障功能受损. 崔巍 et al[12]的研究证实. 本研究模型大鼠肠道有上皮细胞脱落坏死, 杯状细胞减少, 隐窝脓肿以及肠黏膜糜烂溃疡等表现, 可能与过量TNF-α表达有关.
青藤碱具有良好的抗炎和免疫抑制作用, 其作用的发挥与其抑制促炎细胞因子(如环氧化合酶, 前列腺素E以及一氧化氮等)的过度表达相关. 在关节炎和免疫移植排斥等方面的研究已经左证了其功能. 青藤碱能够降低TNF-α表达[13], 抑制核转录因子-κB(NF-κB)p65核移位和IκB-α降解[14], 可能通过抑制NF-κB活性阻止TNF-α mRNA的转录[15], 降低TNF-α蛋白质合成. 本研究青藤碱组TNF-α的表达明显低于模型组, 同时CMDI和TDI降低, 提示青藤碱抑制TNF-α大量合成, 促进肠黏膜修复.
在促炎症细胞因子的作用下MMPs被激活参与破坏肠黏膜. 研究显示肠黏膜损伤区域的MMPs的表达明显高于正常黏膜组织, Gao et al[16]证实MMP-2和MMP-9在UC中显著增高, 并与炎症程度相关. 本研究模型大鼠MMP-2及MMP-9均增加, MMP-2和MMP-9阳性表达主要位于黏膜固有层和黏膜下层的炎症黏膜及溃疡区的中性粒细胞、嗜酸性粒细胞、巨噬细胞及单核细胞等炎性细胞, 上皮细胞及内皮细胞也可见表达. 二者在模型组的表达显著高于正常组, 提示MMP-2和MMP-9参与结肠炎炎症反应. MMP-2诱导上皮细胞迁延, 参与局部的上皮炎症性过程+. MMP-9引起结肠透壁性损伤[18], 诱导颗粒性白细胞移动并浸润血管, 引起炎症免疫反应. 二者均能促使炎性细胞浸润并致炎症扩散, 降解细胞外基质成分, 诱发肠黏膜糜烂和溃疡形成. 青藤碱能抑制白细胞介素-1β诱导的肾小管上皮细胞MMP-2和MMP-9的活性表达, 阻止肾小管上皮细胞迁移[19]. 本研究发现青藤碱干预后, MMP-2和MMP-9活性表达均显著降低, 说明青藤碱能抑制MMP-2和MMP-9的合成与分泌, 减轻炎症细胞浸润, 阻止MMP-2和MMP-9对结肠组织ECM过度降解, 促进结肠损伤黏膜的愈合.
有学者报道TNF-α能够促进MMP-2[20]和MMP-9[21]的表达. 本研究模型大鼠TNF-α、MMP-2和MMP-9均显著增高, 相关性分析表明TNF-α与MMP-2和MMP-9呈正相关, 提示MMP-2、MMP-9的合成和分泌与TNF-α的高表达密切相关. 结肠炎发病可能是TNF-α引起MMP-2和MMP-9大量生成, 形成炎症级联反应链, 导致ECM过度降解, 破坏肠黏膜. TNF-α促进MMP-2和MMP-9的表达很可能是通过p42/p44MAPK[22]、JNK、NF-κB和p38MAPK[23]等途径实现的. 经青藤碱干预后, TNF-α、MMP-2和MMP-9的表达均显著降低. 青藤碱可能通过抑制TNF-α的合成阻止MMP-2和MMP-9的产生, 减少炎症细胞趋化和浸润结肠组织, 抑制ECM的过度降解, 维护肠黏膜屏障作用.
总之, 实验性结肠炎大鼠肠壁增厚, 肠管变粗, 肠黏膜广泛充血水肿, 大量炎症细胞浸润, 局部黏膜糜烂溃疡形成, 同时有TNF-α、MMP-2和MMP-9的活性表达增高. 青藤碱干预后, 有效地抑制TNF-α、MMP-2和MMP-9的表达, 减轻结肠炎炎症反应, 发挥抗炎作用. 其机制可能与抑制TNF-α的合成降低MMP-2和MMP-9的表达有关, 但具体的机制尚需我们进一步研究阐明.
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD), 受遗传、环境、免疫和精神心理等因素影响, 为非特异性肠道炎症, 病程迁延, 难以治愈. 研究表明IBD炎症结肠组织中MMPs的表达水平增加, 并与疾病的活动度和严重程度密切相关. 当前对炎症性肠病的治疗, 中西医都无特效的药物, 但研究证明单味中药对实验性结肠炎的病理生理过程有明显影响.
房静远, 教授, 上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所.
治疗炎症性肠病传统药物包括SASP、糖皮质激素和免疫抑制剂等, 虽然有效, 但存在风险大、效益低、副作用多和依从性差等缺点. 生物制剂如英夫利昔单抗等治疗IBD有效, 但目前主要在临床试验阶段且价格昂贵, 难以推广应用.
李晓娟 et al报道青藤碱能抑制TNF-α蛋白质表达; 方勇飞 et al报道青藤碱可能经抑制NF-κB活性阻止TNF-α mRNA的转录, 以致降低TNF-α蛋白质合成; 杨汝春 et al报道青藤碱能抑制白细胞介素-1b诱导的肾小管上皮细胞MMP-2和MMP-9的活性表达, 阻止肾小管上皮细胞迁移.
本研究在实验性结肠炎的基础上, 应用青藤碱进行干预, 并与5-ASA作比较, 从免疫学角度评价青藤碱的疗效, 更具有科学性.
随着深入研究中药对IBD的抗炎保护作用, 采用单味中药治剂治疗实验性结肠炎, 其抗炎和免疫抑制效果明确. 本研究希望为IBD的治疗提供新的方法和思路, 将来有可能开辟以中医为主、西医为辅的中西医结合治疗IBD的新途径.
本文分析了青藤碱对结肠炎大鼠基质金属蛋白激酶的作用及其机制, 设计较简单明了, 有一定的新意.
编辑: 李军亮 电编:何基才
| 1. | Heuschkel RB, MacDonald TT, Monteleone G, Bajaj-Elliott M, Smith JA, Pender SL. Imbalance of stromelysin-1 and TIMP-1 in the mucosal lesions of children with inflammatory bowel disease. Gut. 2000;47:57-62. [PubMed] [DOI] |
| 4. | Zingarelli B, Hake PW, Burroughs TJ, Piraino G, O'connor M, Denenberg A. Activator protein-1 signalling pathway and apoptosis are modulated by poly(ADP-ribose) polymerase-1 in experimental colitis. Immunology. 2004;113:509-517. [PubMed] [DOI] |
| 5. | Akcan A, Muhtaroglu S, Akgun H, Akyildiz H, Kucuk C, Sozuer E, Yurci A, Yilmaz N. Ameliorative effects of bombesin and neurotensin on trinitrobenzene sulphonic acid-induced colitis, oxidative damage and apoptosis in rats. World J Gastroenterol. 2008;14:1222-1230. [PubMed] [DOI] |
| 7. | Murch SH, Braegger CP, Walker-Smith JA, MacDonald TT. Location of tumour necrosis factor alpha by immunohistochemistry in chronic inflammatory bowel disease. Gut. 1993;34:1705-1709. [PubMed] [DOI] |
| 8. | Zhou YH, Yu JP, Liu YF, Teng XJ, Ming M, Lv P, An P, Liu SQ, Yu HG. Effects of Ginkgo biloba extract on inflammatory mediators (SOD, MDA, TNF-alpha, NF-kappaBp65, IL-6) in TNBS-induced colitis in rats. Mediators Inflamm. 2006;2006:92642. [PubMed] |
| 9. | Noguchi M, Hiwatashi N, Liu Z, Toyota T. Secretion imbalance between tumour necrosis factor and its inhibitor in inflammatory bowel disease. Gut. 1998;43:203-209. [PubMed] |
| 10. | Ebert EC. Tumour necrosis factor-alpha enhances intraepithelial lymphocyte proliferation and migration. Gut. 1998;42:650-655. [PubMed] |
| 11. | Wang F, Graham WV, Wang Y, Witkowski ED, Schwarz BT, Turner JR. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am J Pathol. 2005;166:409-419. [PubMed] |
| 13. | 李 晓娟, 王 培训, 刘 良, 陈 光星, 肇 静娴, 曾 耀英, 陈 纪藩. 青藤碱对T淋巴细胞活化及TH1类细胞内细胞因子表达的 影响. 中国免疫学杂志. 2004;20:249-252, 258. |
| 16. | Gao Q, Meijer MJ, Kubben FJ, Sier CF, Kruidenier L, van Duijn W, van den Berg M, van Hogezand RA, Lamers CB, Verspaget HW. Expression of matrix metalloproteinases-2 and -9 in intestinal tissue of patients with inflammatory bowel diseases. Dig Liver Dis. 2005;37:584-592. [PubMed] [DOI] |
| 17. | Pirilä E, Ramamurthy NS, Sorsa T, Salo T, Hietanen J, Maisi P. Gelatinase A (MMP-2), collagenase-2 (MMP-8), and laminin-5 gamma2-chain expression in murine inflammatory bowel disease (ulcerative colitis). Dig Dis Sci. 2003;48:93-98. [PubMed] [DOI] |
| 18. | Medina C, Santana A, Paz MC, Díaz-Gonzalez F, Farre E, Salas A, Radomski MW, Quintero E. Matrix metalloproteinase-9 modulates intestinal injury in rats with transmural colitis. J Leukoc Biol. 2006;79:954-962. [PubMed] [DOI] |
| 21. | 朱 军华, 陶 凯雄, 王 国斌. TNF-α对肝癌细胞VEGF和MMP-9表达的影响. 中国普外基础与临床杂志. 2005;12:384-389. |
| 22. | Lin CC, Tseng HW, Hsieh HL, Lee CW, Wu CY, Cheng CY, Yang CM. Tumor necrosis factor-alpha induces MMP-9 expression via p42/p44 MAPK, JNK, and nuclear factor-kappaB in A549 cells. Toxicol Appl Pharmacol. 2008;229:386-398. [PubMed] [DOI] |
| 23. | Wiehler S, Cuvelier SL, Chakrabarti S, Patel KD. p38 MAP kinase regulates rapid matrix metalloproteinase-9 release from eosinophils. Biochem Biophys Res Commun. 2004;315:463-470. [PubMed] [DOI] |