修回日期: 2008-10-04
接受日期: 2008-10-07
在线出版日期: 2008-10-28
目的: 探讨外源性FHIT基因表达对长春新碱诱导的胃癌细胞凋亡的影响及其分子机制.
方法: 通过脂质体将重组FHIT基因PRC/CMV质粒和空载体转染到人胃癌细胞MKN-28, Western blot法检测外源性FHIT蛋白的表达; 使用不同浓度的长春新碱分别处理各组细胞, MTT法分析细胞增殖, 流式细胞术检测细胞的凋亡; Western blot法检测细胞Bcl-2和Bax的表达.
结果: 转染FHIT基因后, MKN-28细胞检测到FHIT蛋白的表达; 长春新碱处理48 h后, 转染FHIT基因组细胞、转染空载体组细胞及未转染组细胞的凋亡率分别是30.967%±2.122%、11.033%±1.724%、10.733%±1.021%, 转染FHIT基因组细胞凋亡更明显(F = 142.045, P<0.05); 转染FHIT基因组细胞经长春新碱处理后Bcl-2蛋白表达减少, Bax蛋白表达增加.
结论: 外源性FHIT基因表达可以增强长春新碱诱导的胃癌细胞凋亡, 其机制可能与凋亡相关蛋白Bcl-2和Bax表达有关.
引文著录: 王俊, 段晓明, 周自华, 贺修胜. 外源性FHIT基因表达对长春新碱诱导人胃癌MKN-28细胞凋亡的影响. 世界华人消化杂志 2008; 16(30): 3367-3371
Revised: October 4, 2008
Accepted: October 7, 2008
Published online: October 28, 2008
AIM: To investigate effect of exogenous fragile histidine triad (FHIT) gene expression on gastric cancer cells MKN-28 apoptosis induced by vincristine as well as its molecular mechanism.
METHODS: The recombinant FHIT gene was transfected into human gastric cancer cells MKN-28 through liposomes. The expression of exogenous FHIT gene was detected using western blot. The MKN-28-pRcCMV-FHIT, MKN-28-pRcCMV and MKN-28 cells were treated with vincristine of different concentrations. After treatment with vincristine, the inhibition rates of the cells in 3 groups were examined using MTT assay. The apoptosis of cells was determined by flow cytometry. The expressions of Bcl-2 and Bax were measured using Western blot.
RESULTS: The expression of FHIT protein was detected in MKN-28 cells after transfection with FHIT gene. After being treated with vincristine for 48 h, the apoptosis rates of the cells transfected with FHIT gene, the cells transfected with empty vector and the non-transfected cells were 30.967% ± 2.122%, 11.033% ± 1.724% and 10.733% ± 1.021%, respectively. The apoptosis of the cells transfected with FHIT gene was more obvious (F = 142.045, P < 0.05). The expression of Bcl-2 was down-regulated and that of Bax was up-regulated after treatment with vincristine.
CONCLUSION: The expression of exogenous FHIT gene can enhance the vincristine-induced apoptosis in gastric cancer cells, which may be related to the expressions of apoptosis-related protein Bcl-2 and Bax.
- Citation: Wang J, Duan XM, Zhou ZH, He XS. Effect of exogenous FHIT gene expression on vincristine-induced apoptosis of human gastric cancer cells MKN-28. Shijie Huaren Xiaohua Zazhi 2008; 16(30): 3367-3371
- URL: https://www.wjgnet.com/1009-3079/full/v16/i30/3367.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i30.3367
1996年Ohta et al[1]采用外显子捕获法于染色体3p14.2上克隆出FHIT基因, 该基因被视为候选抑癌基因. 大量的研究证实, 在多种肿瘤中存在FHIT基因转录异常和表达缺失. 胃癌是人类最常见的恶性肿瘤之一, 在化疗中经常产生耐药, 影响治疗效果. 长春新碱(VCR)是临床肿瘤化疗中的常用药物, 但胃癌细胞对其敏感性不高, 甚至产生耐药[2]. 本实验用长春新碱处理经过FHIT基因转染的胃癌MKN-28细胞, 观察外源性FHIT蛋白与长春新碱是否具有协同抗肿瘤作用, 并探讨其分子机制, 为基因治疗和化疗联合作用治疗胃癌提供实验依据.
人胃癌细胞株MKN-28(FHIT蛋白表达缺失[3])来自南华大学肿瘤研究所. FHIT基因的重组载体(含FHIT基因第5-8个外显子)及其空载体PRC/CMV均由美国俄亥俄州立大学K. Huebner教授惠赠. 细胞培养所用RPMI 1640培养基购于美国Gibco公司; 脂质体Lipofectamine 2000购于Invitrogen公司; 兔抗人FHIT多克隆抗体购于美国Zymed公司; 鼠抗人Bax和Bcl-2购于北京中杉金桥公司; 长春新碱购于广州明兴制药厂.
1.2.1 细胞培养、FHIT基因转染及其单克隆细胞株筛选: 于6孔板内接种处于对数生长期的MKN-28细胞2×105, 在37℃、50 mL/L CO2及饱和湿度的培养箱内培养24 h, 待细胞贴壁完全, 密度接80%-90%时, 按脂质体试剂盒说明进行质粒转染. 分组: 转FHIT基因组(MKN-28- pRcCMV-FHIT), 转空载体(MKN-28-pRcCMV), 空白组(MKN-28). 转染细胞于转染后48 h开始用G418浓度为300 mg/L的RPMI 1640培养基进行筛选, 待空白组细胞全部死亡时, 降低G418的浓度为150 mg/L维持, 继续筛选14 d后, 形成细胞克隆, 将细胞克隆接种入24孔板, 用有限稀释法稀释, 挑选单克隆继续培养、传代.
1.2.2 Western blot法检测外源性FHIT蛋白以及VCR处理前后Bcl-2和Bax蛋白表达: 加入细胞裂解液裂解细胞后, 离心提取蛋白. 定量, 上样, 电泳分离蛋白, 转膜, 封闭1 h, 孵一抗, 4℃过夜, 洗膜后孵二抗, 室温下1 h, 洗膜, 加发光剂, 压片, 显影, 定影.
1.2.3 MTT法检测VCR对胃癌细胞增殖的影响: 取对数生长期的3组细胞分别接种于96孔板. 在37℃, 50 mL/L CO2条件下培养过夜后, 分别加入不同浓度的VCR 100 μL, 调零组(用于调零, 去除背景干扰)和对照组加入相应体积的培养液, 每组设4个平行孔. 继续培养24, 48, 72 h后, 向每孔加入5 g/L MTT 20 μL(调零组除外), 再培养4 h, 倾去培养液, 加DMSO 100 μL/孔, 避光震荡20 min后, 用酶联免疫仪在波长570 nm处调零组调零后读取吸光度值. 取4孔值的均数按公式计算细胞抑制率. 抑制率 = (1-试验孔均值/对照孔均值)×100%. 实验重复3次.
1.2.4 流式细胞术检测细胞凋亡: 向转FHIT基因组、转空载体组、空白组细胞中分别加入终浓度为0.03 mg/L的VCR, 同时取未使用VCR处理的上述3组细胞进行检测. 培养48 h后收集细胞, 用750 mL/L乙醇4℃固定过夜, 上机前1 h加碘化丙啶, 送流式细胞仪室检测. 实验重复3次.
统计学处理 应用SPSS13.0软件分析. 数据用mean±SD表示, 实验数据采用方差分析, P<0.05认为有统计学意义.
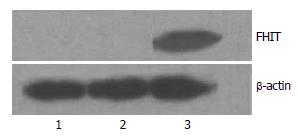
转染FHIT基因的MKN-28细胞可以检测到FHIT蛋白的表达, 而转染空载体的MKN-28细胞和未转染的MKN-28细胞中均未检测到FHIT蛋白的表达(图1).
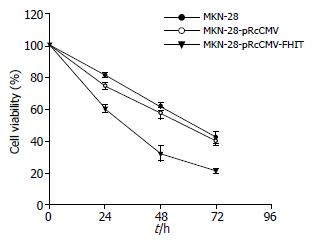
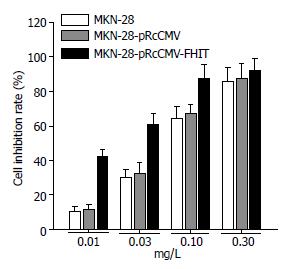
用0.03 mg/L VCR处理3组细胞, 在24、48、72 h时观察, 转FHIT基因组细胞在各个时间段的生存率都明显的低于转空载体组和空白组细胞(P<0.05, F = 83.79), 而转空载体组与空白组比较没有显著性差异(图2). 三组细胞经过不同浓度的VCR处理48 h后, 在VCR浓度分别为0.01、0.03、0.1 mg/L的浓度组中, 转FHIT基因组细胞的生长抑制率明显高于转空载体组和空白组细胞(P<0.05, F = 165.57), 而在0.3 mg/L浓度组, 3组细胞的生长抑制率没有明显差别(图3).
用0.03 mg/L VCR处理后, 转FHIT基因组细胞凋亡率明显高于转空载体组和空白组细胞(P<0.05, F = 142.045); 也明显高于未使用VCR处理的转FHIT基因组细胞(P<0.05, F = 97.075, 表1).
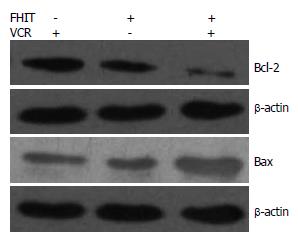
经过0.03 mg/L VCR处理48 h后的转FHIT基因组细胞中, Bcl-2表达下调, Bax表达上调; 由VCR处理的转空载体组细胞及未经VCR处理的转FHIT基因组细胞中的Bcl-2和Bax表达, 经Western blot灰度分析软件分析, 他们之间没有显著性差异(图4).
近年来越来越多的研究表明, 在染色体3p区域发现的脆性组氨酸三联体基因(FHIT)是将脆性位点与肿瘤基因的变异联系起来的抑癌基因[4], 他在人类许多肿瘤组织和细胞系中表现为高频率缺失和异常转录. 胃癌中FHIT基因的异常, 可能是这一脆性位点对致癌因素易感的结果, 随后在3p14.2也发现了FHIT基因并确定了他的特征, 显示他在胃肠道肿瘤中表达异常. 有研究发现FHIT蛋白缺失出现在大多数胃癌中, 无论是弥漫型还是肠型胃癌, 这说明FHIT功能的丧失是胃癌发生的关键一步[5]. 近年来有研究表明FHIT基因具有抑制肿瘤细胞生长, 促进肿瘤细胞凋亡等特点[6], 同时也有FHIT基因替代疗法进行了临床前期评估工作的报道[7]. 因此可以认为FHIT基因能成为基因治疗的新靶点[8-9]. 本实验通过脂质体将外源性FHIT基因导入FHIT表达缺失的MKN-28细胞中, 经证实FHIT蛋白在MKN-28细胞中稳定表达, 从而为后续实验奠定了基础.
VCR是临床常用化疗药物之一, 但胃癌细胞对其敏感性差. 本实验用VCR处理导入外源性FHIT基因的MKN-28细胞, 通过MTT法发现, 在同一浓度的VCR作用下, 转染了FHIT基因的MKN-28细胞的生存率明显低于转空载体组和空白组细胞, 且随着时间的增加, 转FHIT基因组细胞的生存率降低, 呈时间依赖性; 不同浓度的VCR作用于3组细胞, 转FHIT基因组细胞的凋亡率显著高于转空载体组和空白组, 且随着浓度的增加, 转FHIT基因组细胞的凋亡率增加, 呈浓度依赖性. 流式细胞术检测也发现, VCR处理后的转FHIT基因组细胞凋亡率显著高于未用VCR处理的转FHIT基因组细胞, 与Andriani et al[10]研究结果相似. 以上表明FHIT基因治疗与VCR的联合治疗效果要明显优于单独FHIT基因治疗或单独VCR治疗效果. Ottey et al[11]发现小鼠的正常肾脏细胞和人类胃癌细胞株MKN74在暴露于丝裂霉素C和短波紫外线(UVC)后, 无论是正常细胞还是癌细胞, FHIT阴性组均较FHIT阳性组细胞存活时间长, 表明FHIT表达丢失使细胞对化疗药和射线的抵抗性增强.
FHIT基因及其基因产物的抑癌机制目前研究的还不是很清楚, FHIT可能从多条途径发挥肿瘤抑制作用. 通过线粒体释放凋亡酶激活因子激活Caspase是细胞凋亡途径之一, 而Caspase活化又被Bcl-2家族调控. 众所周知, Bax是Bcl-2家族中的促凋亡基因, Bcl-2是抑制凋亡基因. Bcl-2可与Bax形成二聚体作为细胞凋亡信号通路上的分子开关, 如果Bax相对量高于Bcl-2, 则Bax同二聚体的数量增多, 从而促进细胞凋亡; 而如果Bcl-2相对量高于Bax, 则促进形成Bcl-2/Bax异二聚体, 并使Bcl-2同二聚体的量增多, 从而抑制细胞凋亡. 在我们的研究中, 经VCR处理的转空载体组细胞与未经VCR处理的转FHIT基因组细胞中的Bcl-2和Bax的表达无显著性差异, 而由VCR处理的转FHIT基因组细胞中的Bcl-2表达下调, Bax表达上调. 这些结果说明在重新表达FHIT基因的MKN-28细胞中, VCR诱导细胞凋亡的作用被增强可能和Bcl-2家族中促凋亡蛋白Bax上调, 抑制凋亡蛋白Bcl-2下调有关. 我们的结果和Kim et al[12]报道相似. Dumon et al[13]研究发现, 在缺乏FHIT表达的胰腺癌细胞中, 由于腺病毒介导的FHIT蛋白高表达使细胞线粒体跨膜电位发生变化, 从而导致线粒体凋亡途径改变. 我们目前的研究也只是表明在表达FHIT蛋白的细胞中, 经VCR处理后细胞凋亡的增加可能与Bcl-2家族成员改变有关, 但是他们之间的关系仍不明了.
本研究结果提示基因治疗与化疗联合应用,可以更大程度地杀灭肿瘤细胞、提高化疗药物的敏感性, 从而为胃癌的联合治疗提供了实验依据, 并对联合治疗诱导胃癌细胞凋亡的分子机制进行了初步探讨, 但其是否还通过其他的凋亡途径或者调控其他凋亡相关基因的改变而诱导胃癌细胞凋亡, 还有待进一步研究.
研究表明, FHIT基因是一种重要的候选抑癌基因, 在胃癌中存在着较高频率的FHIT基因转录异常和(或)FHIT基因表达降低或缺失. 胃癌细胞对化疗药物敏感性差, 在化疗中经常产生耐药.
孙延平, 副主任医师, 中国人民解放军第二军医大学附属长征医院普外科.
FHIT基因能够成为基因治疗的新靶点, 但是仅依靠复原其功能来诱导所有肿瘤细胞凋亡显然是不够的. FHIT基因治疗联合化疗可以更大程度地杀灭肿瘤细胞, 但联合治疗的细胞内分子机制还有待进一步研究.
国内外均有报道FHIT基因重新表达可以增强肿瘤细胞对凋亡诱导剂的敏感性. 在动物模型中, FHIT基因的转导可阻止肿瘤的生长, 延长实验小鼠的生存时间.
本文的创新之处在于把FHIT基因转入本身不表达FHIT蛋白的胃癌MKN-28细胞中, 并用长春新碱处理, 观察外源性FHIT蛋白与长春新碱是否具有协同抗肿瘤作用, 并探讨其分子机制.
FHIT基因可增强胃癌MKN-28细胞对化疗药物的敏感性, 并初步探讨了其可能的分子机制, 这为今后的临床肿瘤治疗提供了新思路.
脆性组氨酸三联体(FHIT): 位于人类染色体3p14.2区域, 全长约500 kb, 有10个外显子组成, 分子质量约为16.8 kDa, 在全身正常组织器官均有低水平表达.
本文对外源性FHIT基因表达对长春新碱诱导人胃癌MKN-28细胞凋亡的影响作了一些的研究, 文章通顺, 条理清楚, 具有较高的研究价值和创新性.
编辑: 李军亮 电编:何基才
| 1. | Ohta M, Inoue H, Cotticelli MG, Kastury K, Baffa R, Palazzo J, Siprashvili Z, Mori M, McCue P, Druck T. The FHIT gene, spanning the chromosome 3p14.2 fragile site and renal carcinoma-associated t(3;8) breakpoint, is abnormal in digestive tract cancers. Cell. 1996;84:587-597. [PubMed] [DOI] |
| 2. | Wu DL, Xu Y, Yin LX, Lu HZ. Reversal of multidrug resistance in vincristine-resistant human gastric cancer cell line SGC7901/VCR by LY980503. World J Gastroenterol. 2007;13:2234-2237. [PubMed] |
| 3. | Lee SH, Kim HS. [Sequence analyses of aberrant FHIT transcripts in gastric cancer cell lines]. Korean J Gastroenterol. 2003;42:476-483. [PubMed] |
| 4. | Weiske J, Albring KF, Huber O. The tumor suppressor Fhit acts as a repressor of beta-catenin transcriptional activity. Proc Natl Acad Sci U S A. 2007;104:20344-20349. [PubMed] [DOI] |
| 5. | Bragantini E, Barbi S, Beghelli S, Moore PS, de Manzoni G, Roviello F, Tomezzoli A, Vindigni C, Baffa R, Scarpa A. Loss of Fhit expression is associated with poorer survival in gastric cancer but is not an independent prognostic marker. J Cancer Res Clin Oncol. 2006;132:45-50. [PubMed] [DOI] |
| 6. | Iliopoulos D, Guler G, Han SY, Druck T, Ottey M, McCorkell KA, Huebner K. Roles of FHIT and WWOX fragile genes in cancer. Cancer Lett. 2006;232:27-36. [PubMed] [DOI] |
| 7. | Pichiorri F, Trapasso F, Palumbo T, Aqeilan RI, Drusco A, Blaser BW, Iliopoulos D, Caligiuri MA, Huebner K, Croce CM. Preclinical assessment of FHIT gene replacement therapy in human leukemia using a chimeric adenovirus, Ad5/F35. Clin Cancer Res. 2006;12:3494-3501. [PubMed] [DOI] |
| 8. | Ishii H, Wang Y, Huebner K. A Fhit-ing role in the DNA damage checkpoint response. Cell Cycle. 2007;6:1044-1048. [PubMed] |
| 9. | Semba S, Trapasso F, Fabbri M, McCorkell KA, Volinia S, Druck T, Iliopoulos D, Pekarsky Y, Ishii H, Garrison PN. Fhit modulation of the Akt-survivin pathway in lung cancer cells: Fhit-tyrosine 114 (Y114) is essential. Oncogene. 2006;25:2860-2872. [PubMed] [DOI] |
| 10. | Andriani F, Perego P, Carenini N, Sozzi G, Roz L. Increased sensitivity to cisplatin in non-small cell lung cancer cell lines after FHIT gene transfer. Neoplasia. 2006;8:9-17. [PubMed] [DOI] |
| 11. | Ottey M, Han SY, Druck T, Barnoski BL, McCorkell KA, Croce CM, Raventos-Suarez C, Fairchild CR, Wang Y, Huebner K. Fhit-deficient normal and cancer cells are mitomycin C and UVC resistant. Br J Cancer. 2004;91:1669-1677. [PubMed] |
| 12. | Kim CH, Yoo JS, Lee CT, Kim YW, Han SK, Shim YS, Yoo CG. FHIT protein enhances paclitaxel-induced apoptosis in lung cancer cells. Int J Cancer. 2006;118:1692-1698. [PubMed] [DOI] |
| 13. | Dumon KR, Ishii H, Vecchione A, Trapasso F, Baldassarre G, Chakrani F, Druck T, Rosato EF, Williams NN, Baffa R. Fragile histidine triad expression delays tumor development and induces apoptosis in human pancreatic cancer. Cancer Res. 2001;61:4827-4836. [PubMed] |