修回日期: 2007-11-17
接受日期: 2008-01-15
在线出版日期: 2008-01-28
目的: 研究甲珠对肝纤维化大鼠α-肌动蛋白(α-SMA)和转化生长因子-β1(TGF-β1)表达影响, 并探讨其抗纤维化机制.
方法: 采用400 mL/L CCL4 sc, 制备肝纤维化模型并以高[2.0 g/(kg·d)], 中[1.0 g/(kg·d)], 低剂量[0.5 g/(kg·d)]甲珠干预, 测定各组肝功能、血清TGF-β1, 免疫组织化学法检测肝组织α-SMA、TGF-β1表达, RT-PCR检测α-SMA、TGF-β1 mRNA 的表达.
结果: 甲珠各组较模型组肝功能明显改善, 丙氨酸转氨酶、天冬氨酸转氨酶显著降低, 总蛋白及白蛋白显著升高, 胆红素降低; 血清TGF-β1显著降低; 高, 中, 低甲珠剂量组肝组织α-SMA及TGF-α1 mRNA表达, 染色面积比, 灰度值与模型组相比均有显著性意义(α-SMA: 9.21±1.12、12.63±2.42、14.23±1.57 vs 16.32±2.14, P<0.01、P<0.01、P<0.05; TGF-β1 mRNA: 5.58±0.80、8.62±1.16、11.92±1.35 vs 14.57±1.59, P<0.01、P<0.01、P<0.01), (α-SMA染色面积比: 9.21%±1.29%、12.63%±1.44%、14.23%±1.41% vs 16.32%±1.75%, P<0.01、P<0.01、P<0.05; TGF-β1染色面积比: 5.31%±0.70%、8.37%±1.09%、11.92%±1.42% vs 14.47%±1.48%, P<0.01、P<0.01、P<0.01), (α-SMA灰度值: 91.29±9.53、99.55±11.83、107.18±12.06 vs 116.44±12.97, P<0.01、P<0.01、P<0.05; TGF-β1灰度值: 89.96±9.64、106.92±13.90、110.50±12.91 vs 127.13±14.88, P<0.01、P<0.01、P<0.05).
结论: 甲珠对CCL4诱导的实验鼠肝纤维化有良好的抑治作用.
引文著录: 付德才, 杨世忠, 孙钰玮, 于春艳, 毛丽珍, 姜相莲, 关瑞锋. 超分子铂类药物西茜铂体内外对消化系肿瘤的抑制作用. 世界华人消化杂志 2008; 16(3): 253-258
Revised: November 17, 2007
Accepted: January 15, 2008
Published online: January 28, 2008
AIM: To investigate the effect of Jiazhu on α-SMA and TGF-β1 expression in the liver of rats with hepatic fibrosis and its anti-fibrosis mechanism.
METHODS: A model of rat hepatic fibrosis was induced by injecting 40% CCl4, which was interfered with high [2.0 g/(kg·d)], medium [1.0 g/(kg·d)] and low doses [0.5 g/(kg·d)] of Jiazhu. Hepatic function and serum TGF-β1 were examined. Expression of α-SMA and TGF-β1 was detected by immunohistochemistry and RT-PCR.
RESULTS: Compared with the model group, the levels of aspartate transaminase and alanine transaminase were significantly decreased in the high, medium and low Jiazhu dose groups. Total protein and albumin increased while serum bilirub and TGF-β1 were significantly reduced. The expression of α-SMA and TGF-β1 in liver tissue was decreased. The mRNA expression, stained area and gray scale of α-SMA and TGF-β1 in the high, medium and low Jiazhu dose groups were significantly different compared with the model group(α-SMA: 9.21 ± 1.12、12.63 ± 2.42、14.23 ± 1.57 vs 16.32 ± 2.14, P < 0.01、P < 0.01、P < 0.05; TGF-β1 mRNA: 5.58 ± 0.80、8.62 ± 1.16、11.92 ± 1.35 vs 14.57±1.59, P < 0.01、P < 0.01、P < 0.01), (dyeing area of α-SMA: 9.21% ± 1.29%、12.63% ± 1.44%、14.23% ± 1.41% vs 16.32% ± 1.75%, P < 0.01、P < 0.01、P < 0.05; dyeing area of TGF-β1: 5.31% ± 0.70%、8.37% ± 1.09%、11.92% ± 1.42% vs 14.47% ± 1.48%, P < 0.01、P < 0.01、P < 0.01), (gray scale of α-SMA: 91.29 ± 9.53、99.55 ± 11.83、107.18 ± 12.06 vs 116.44 ± 12.97, P < 0.01、P < 0.01、P < 0.05; gray scale of TGF-β1: 89.96 ± 9.64、106.92 ± 13.90、110.50 ± 12.91 vs 127.13 ± 14.88, P < 0.01、P < 0.01、P < 0.05).
CONCLUSION: Jiazhu can inhibit rat hepatic fibrosis induced by CCL4.
- Citation: Fu DC, Yang SZ, Sun YW, Yu CY, Mao LZ, Jiang XL, Guan RF. Effect of Jiazhu on α-SMA and TGF-β1 expression in rats with hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2008; 16(3): 253-258
- URL: https://www.wjgnet.com/1009-3079/full/v16/i3/253.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i3.253
肝纤维化作为肝硬化的前期阶段, 其可逆性为延缓或阻止各种慢性肝病发展为肝硬化提供了可能, 对肝纤维化的防治已成为该领域的研究热点. 近年来研究显示许多中医方药对肝纤维化有很好的治疗效果, 并已展示良好的应用前景[1-5]. 甲珠为穿山甲的鳞片, 主归肝经, 具有软坚、通络、散结的功效, 是历代医家治疗癥、瘕、集、聚的常用药, 近年来被广泛用于治疗肝硬化, 取得了较好的临床效果. 但目前国内外尚无甲珠抗肝纤维化的基础及临床研究.
本实验采用四氯化碳(CCL4)大鼠肝纤维化模型, 观察甲珠的抗肝纤维化作用, 并探讨其对α-肌动蛋白(α-SMA)、转化生长因子-β1(TGF-β1)影响, 及甲珠抗肝纤维化的机制.
♂Wistar大鼠108只, 体质量180±30 g, 由吉林大学实验动物中心提供. 甲珠(由牡丹江中医院提供)研细末. CCL4购自北京北化精细化学品有限责任公司: 秋水仙碱(colchicine)购自昆明股份制药有限公司; 谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)试剂盒购自上海科欣生物技术研究所; 血清总胆红素(TBIL)试剂盒购自上海科华东菱诊断用品有限公司; TGF-β1酶联免疫吸附试剂盒购自武汉博士德生物工程有限公司, 单克隆即用型鼠抗人α-SMA试剂盒购自北京中杉生物公司, 兔抗大鼠TGF-β1多克隆抗体购自武汉博士德生物工程有限公司, 即用型SP免疫组化试剂盒购自福州迈新试剂公司, DAB购自北京中山生物公司. RT-PCR两步法试剂盒购自TaKaRa公司, TRizol购自Sangon公司.
1.2.1 模型制作: 模型制作参照文献[6]方法, 实验第1天除正常空白对照组(简称对照组)外, 其余动物sc CCL4分析纯5 mL/kg体质量, 以后每隔3 d注射400 mL/L CCL4橄榄油剂3 mL/kg体质量, 连续8 wk. 实验前2 wk饲喂高脂玉米粉饲料(795 g/kg玉米粉+200 g/kg猪油+5 g/kg胆固醇), 第3-6 周饲喂1000 g/kg玉米粉和300 mL/L乙醇饮料.
1.2.2 分组及给药方法: 采用成组设计, 将108只大鼠随机分为6组, 每组18只, 第1组对照组, 饲喂正常饮食; 第2组模型组, 按上述造模方法给予饮食; 第3组秋水仙碱组, 于造模第3周开始给予秋水仙碱0.1 mg/(kg·d), 第4组甲珠高剂量治疗组, 于造模第3周开始, ig甲珠混悬液, 2.0 g/(kg·d)(体质量); 第5组甲珠中剂量治疗组, 于造模第3周开始, ig甲珠混悬液, 1.0 g/(kg·d)(体质量); 第6组甲珠高剂量治疗组, 于造模第3周开始, 给予甲珠混悬液ig, 0.5 g/(kg·d)(体质量), 共8 wk. 造模结束时模型组死亡3只, 中剂量组死亡3只, 低剂量组死亡2只, 秋水仙碱组死亡2只, 高剂量组死亡1只, 为增加可比性, 每组均采用15只.
1.2.3 标本制作: 上述造模及处理过程结束后, 禁食12 h后称质量, 心包取血, 分离血清置-20 ℃保存; 并立刻完整摘取肝脏及脾脏, 肝右叶置于40 g/L中性甲醛液中常规固定后, 石蜡包埋, 用于制作组织芯片.
1.2.4 血清及组织纤维化指标检测: 测定血清肝功能包括TBIL、ALT、AST、ALB、TGF-β1, 严格按说明书操作.
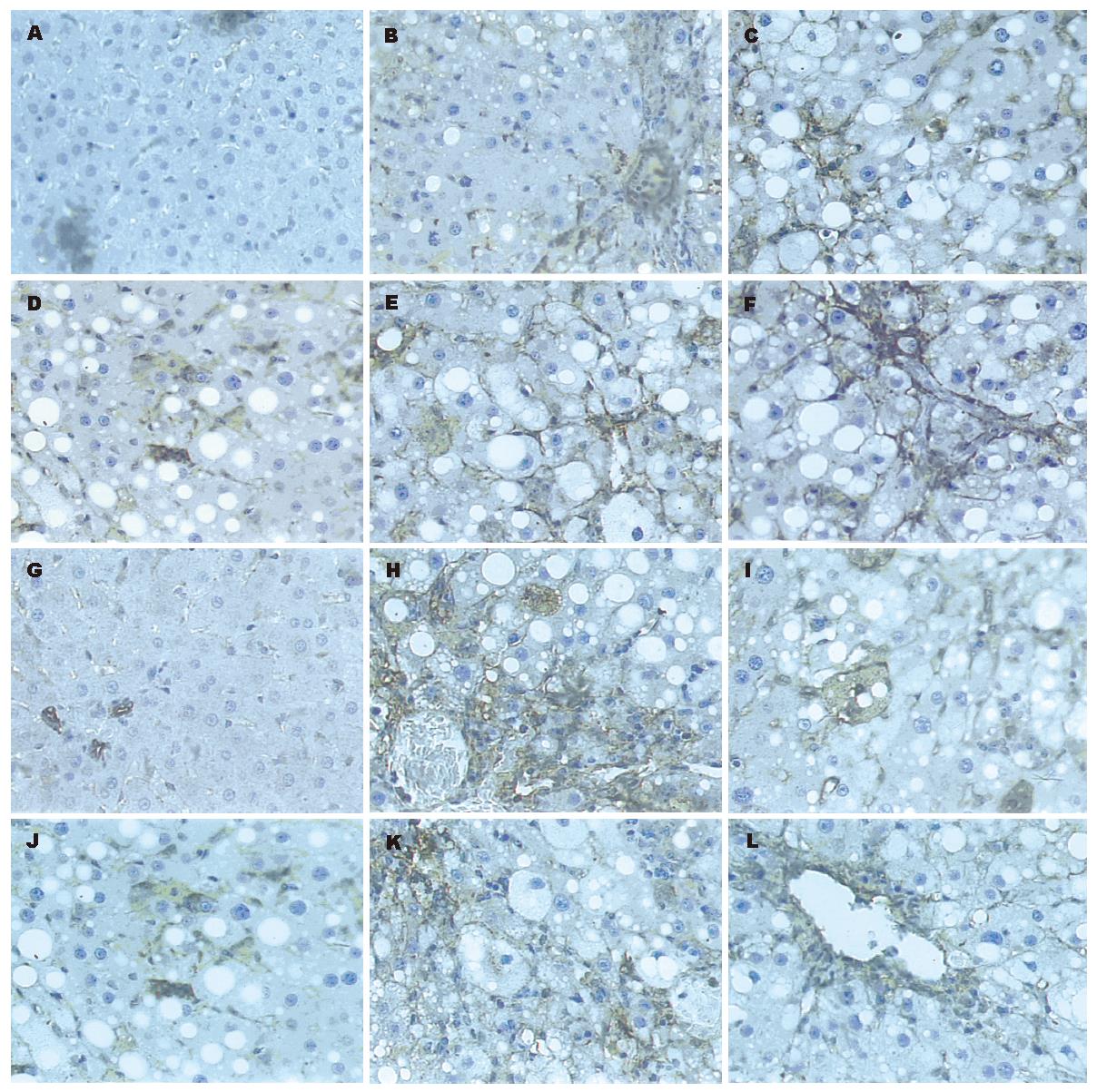
1.2.5 免疫组织化学检查: α-SMA、TGF-β1: 采用石蜡包埋常规切片, SP法, 兔抗鼠TGF-β1, 多克隆抗体及鼠抗鼠α-SMA单克隆抗体均以1:100 稀释, DAB显色, 苏木素复染. PBS代替一抗作为阴性对照. 阳性组织呈棕色, 阴性组织呈蓝色. 在全自动图像分析系统上, 采用HPIAS-2000型图像分析软件进行定量分析, 随机选取每张切片10个视野(×200)倍测定阳性细胞的灰度值与所占视野面积, 灰度值在0-249之间, 灰度值越高, 染色越浅, 表达产物越少; 灰度值越低, 染色越深, 表达产物越多.
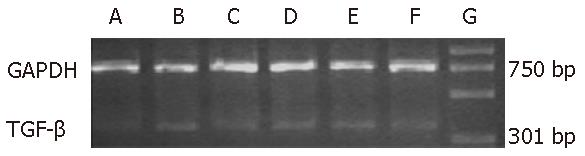
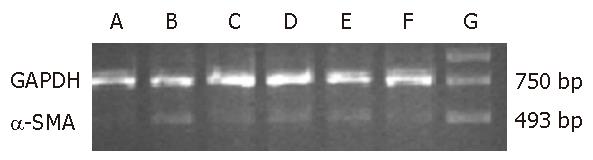
1.2.6 RT-PCR: 大鼠GAPDH上游引物: 5'-CATGACCACAGTCCATGCCATC-3', 下游引物: 5'-CACCCTGTTGCTGTAGCCATATTC-3', 全长756 bp; TGF-β1上游引物: 5'-ACTACTGCTTCAGCTCCACA-3', 下游引物: 5'-ATCATGTTGGACAACTGCTC-3', 全长301 bp; α-SMA上游引物: 5'-TGTGCTGGACTCTGGAGATG-3', 下游引物: 5'-CTTCTGCATCCTGTCAGCAA-3', 全长493 bp. 称取50-100 mg肝组织用TRIzol提取总RNA, 采用分光光度法测定其含量及纯度, 测定A260/A280值. 取2 μg总RNA, 42 ℃逆转录90 min. 参数设置94 ℃变性, 3 min×1 循环. 94 ℃变性30 s, 53 ℃退火30 s, 72 ℃延伸45 s, 共35个循环. 最后72 ℃彻底延伸7 min×1循环. 同法扩增GAPDH作为内参照. 取5 μL PCR产物150 mL/L琼脂糖凝胶电泳. 凝胶图像分析系统检测灰度, TGF-β1/GAPDH比值表示TGF-β1 mRNA相对水平. α-SMA/GAPDH比值表示 α-SMA mRNA相对水平.
统计学处理 实验结果数据以mean±SD表示, 采用SPSS11.5软件进行统计分析, 各组间比较采用单因素方差分析, 组间比较采用基于方差分析两两比较LSD法.
(1)HE染色: 光镜下正常对照组大鼠未见肝细胞变性及坏死, 门脉区不增宽, 肝组织及肝小叶结构清晰, 未见胶原纤维增生. 模型组大鼠可见大量肝细胞变性、坏死, 汇管区周围大量炎症细胞浸润, 大量胶原纤维增生, 伸入到肝实质中, 可见含铁血黄素, 肝小叶结构破坏; (2)Masson染色见蓝色胶原纤维明显增多. 汇管-中央静脉区纤维间隔明显增宽, 包绕、分隔肝小叶, 部分形成假小叶. 甲珠各组及秋水仙碱组较模型组肝细胞变性、坏死明显减轻, 纤维增生及炎细胞浸润程度较模型组明显减轻.
模型组ALT、AST显著升高, ALB显著降低; 不同剂量甲珠(2.0、1.0、0.5 g/kg)与秋水仙碱(0.1 mg/kg) ig, 可不同程度降低ALT、AST、TBIL水平(P<0.01, P<0.05), 可不同程度升高ALB(P<0.01, P<0.05). 与正常组相比, 模型组大鼠TGF-β1明显升高(P<0.01), 甲珠各组及秋水仙碱干预组与模型组比较, TGF-β1明显降低(P<0.01), 但未达到正常对照组的水平(表1).
| 分组 | ALT(U/L) | AST(U/L) | ALB(g/L) | TBIL(μmol/L) | TGF-β1(μg/L) |
| 正常对照组 | 53.42±6.54 | 47.26±7.33 | 39.32±3.45 | 13.47±2.42 | 0.79±0.13 |
| 模型组 | 216.29±18.90b | 197.63±19.36b | 29.35±2.68b | 76.10±7.82b | 8.56±1.37b |
| 秋水仙碱组 | 172.88±17.16 | 165.89±16.80 | 33.64±2.94 | 58.97±6.64 | 4.03±0.66 |
| 甲珠高剂量组 | 163.74±17.28 | 157.34±14.87 | 33.49±2.86 | 57.51±7.43 | 5.64±0.62 |
| 甲珠中剂量组 | 194.07±18.02a | 170.34±18.38a | 31.87±3.13a | 64.21±8.08a | 6.39±0.76 |
| 甲珠低剂量组 | 197.53±19.50a | 175.43±17.05a | 32.61±2.72a | 68.86±7.19a | 6.93±0.81 |
正常组肝组织中几乎不表达TGF-β1, 模型组TGF-β1阳性细胞主要位于中央小叶和门静脉周围纤维带及肝纤维间隔中, 主要见于Kuffer细胞、类间质细胞质及其周围, 不同剂量甲珠(2.0、1.0、0.5 g/kg)与秋水仙碱(0.1 mg/kg)灌胃较模型组灰度值升高, 表达产物减少, 阳性染色程度不同程度减轻(P<0.01, P<0.05)(图1). 模型组TGF-β1免疫组织化学染色阳性面积明显升高, 显著高于正常组(P<0.01). 甲珠治疗各组及秋水仙碱干预组明显低于模型组(P<0.01). α-SMA在胞质表达, 正常对照组只表达于小动脉及小静脉, 在胆管无表达. 模型组α-SMA主要表达于汇管区及纤维间隔, 且呈长椭圆形或梭形. 实验表明不同剂量甲珠与秋水仙碱灌胃较模型组α-SMA灰度值升高, 表达产物减少, 阳性染色程度不同程度减轻(P<0.01, P<0.05). 模型组α-SMA免疫组织化学染色阳性面积明显升高, 显著高于正常组(P<0.01). 甲珠治疗各组及秋水仙碱干预组明显低于模型组(P<0.01, P<0.05)(表2).
| 分组 | 染色灰度值 | 染色阳性面积比 | ||
| TGF-β1 | α-SMA | TGF-β1(%) | α-SMA(%) | |
| 正常对照组 | 127.13±14.30 | 116.44±12.60 | 1.29±0.22 | 1.48±0.24 |
| 模型组 | 84.29±10.14b | 79.48±9.13b | 14.47±1.48b | 16.32±1.75b |
| 秋水仙碱组 | 106.92±13.95 | 99.55±11.78 | 7.16±1.04 | 9.45±1.27 |
| 甲珠高剂量组 | 110.50±12.46 | 107.18±12.02 | 5.31±0.70 | 9.21±1.29 |
| 甲珠中剂量组 | 99.56±11.12 | 94.24±10.05 | 8.37±1.09 | 12.63±1.44 |
| 甲珠低剂量组 | 89.96±9.60a | 91.29±9.79a | 11.92±1.42 | 14.23±1.41a |
正常肝组织几乎不表达TGF-β1 mRNA, 而模型组为强表达, 不同剂量甲珠(2.0、1.0、0.5 g/kg)与秋水仙碱(0.1 mg/kg)灌胃组TGF-β1 mRNA表达明显减少(图2), 各组TGF-β1 mRNA/GAPDH比值见表3, 与模型组比较(P<0.01); α-SMA mRNA模型组表达较正常组明显增强, 不同剂量甲珠(2.0、1.0、0.5 g/kg)与秋水仙碱(0.1 mg/kg)灌胃组α-SMA mRNA表达明显减少(图3), 各组α-SMA mRNA/GAPDH比值见表3, 与模型组比较(P<0.01, P<0.05).
目前的研究认为, 肝纤维化的病理改变是细胞外基质(ECM)的增生和降解失衡所致, 而病理情况下细胞外基质的主要细胞来源是肝星状细胞(HSC), 其激活和增生在肝纤维化过程中起主要作用[7-8]. 是肝纤维化发生、发展的核心环节.激活的肝星状细胞的特点之一是表达α-SMA, α-SMA是HSC活化的标志[9]. 常作为肝星状细胞激活的标志物[10-25]. TGF-β1是HSC活化的强有力刺激因子和肝纤维化形成的始动细胞因子[24-25], TGF-β1在肝纤维化发生、发展中的作用: (1)促进HSC转化为FSC, 并刺激FSC合成ECM[26-27], (2)抑制胶原酶及基质降解, 刺激TIMP产生, 抑制MMP的活性[28-29]. (3)对FSC单核细胞等有[30-31]趋化作用. 此外, 研究还显示, TGF-β1可抑制谷氨酰半胱氨酸连接酶的表达, 促进肝细胞损害[32], TGF-β1还能抑制肝细胞DNA合成, 阻止肝细胞再生[33-34]. 从祖国医学辩证, 认为肝纤维化是由于气滞、血瘀、络阻所致, 肝纤维化初期主要为气滞, 进而血瘀, 最后络阻, 气机不畅, 肝纤维化、肝硬化形成. 甲珠为穿山甲的鳞片, 主归肝经, 具有软坚、通络、散结的功效, 是历代医家治疗癥、瘕、集、聚的常用药. 本实验证实了甲珠具有保护实验鼠肝功能的作用, 甲珠高剂量组、中剂量组、低剂量组ALT、AST较模型组均明显降低, ALB较模型组明显升高, 甲珠各组与模型组比较差别显著(P<0.01, P<0.05); 血清中TGF-β1含量甲珠高剂量组、中剂量组、低剂量组较模型组均显著降低(P<0.01); 甲珠能够减少或阻抑实验鼠TGF-β1及α-SMA的表达, 免疫组化结果甲珠高剂量组、中剂量组、低剂量组肝组织α-SMA及TGF-β1表达面积较模型组均明显减少(P<0.01, P<0.05); 灰度值明显升高(P<0.01, P<0.05); RT-PCR证实TGF-β1及α-SMA的表达量较模型组明显降低, 两者比较差别显著(P<0.01, P<0.05). 实验结果证实甲珠具有降低实验鼠血清及肝组织中肝纤维化指标的作用, 可以防治或阻抑肝纤维化.
肝纤维化的病理改变是细胞外基质(ECM)的增生和降解失衡所致, 而病理情况下细胞外基质的主要细胞来源是肝星状细胞(HSC), 他的激活和增生在肝纤维化过程中起主要作用. TGF-β1是HSC活化的强有力刺激因子和肝纤维化形成的始动细胞因子, α-SMA是HSC活化的标志. 研究TGF-β1、α-SMA的表达变化可反映肝纤维化的变化情况.
高春芳, 研究员, 第二军医大学附属长征医院实验诊断科
肝纤维化的可逆性是防治肝硬化的研究热点, 其中星状细胞的激活及细胞外基质的分泌与代谢机制是该领域的研究重点, 找到安全、高效、来源充足的抗肝纤维化药物是当务之急.
Sakata et al报道肝星状细胞(HSC), 其激活和增生在肝纤维化过程中起主要作用, 是肝纤维化发生、发展的核心环节. Ballardini et al报道激活的肝星状细胞的特点之一是表达α-SMA, α-SMA是HSC活化的标志. Border et al报道TGF-β1是HSC活化的强有力刺激因子和肝纤维化形成的始动细胞因子. Pan et al报道研究显示许多中医方药对肝纤维化有很好的治疗效果, 并已展示出良好的应用前景.
甲珠可改善肝功能, 可降低实验鼠血清及肝组织α-SMA及α-SMA mRNA、TGF-β1 mRNA的表达, TGF-β1具有逆转肝纤维化的作用.
本实验甲珠治疗各组TGF-β1、α-SMA在肝组织中表达明显减少, 可能与甲珠抑制肝星型细胞活化有关, 从而阻止了细胞外基质产生, 延缓或逆转肝纤维化的发生, 为临床应用甲珠抗肝纤维化提供了理论依据.
本文设计合理, 方法先进, 结论可靠, 有较深的理论价值和实用价值, 值得推广.
编辑: 李军亮 电编: 李军亮
| 1. | Pan NS, Li ST, Wang Y, Li MF, Han Z. [Therapeutic effect of "anti-hepatic-fibrosis 268" on hepatic fibrosis in rats]. Sichuan Daxue Xuebao Yixueban. 2004;35:528-531. [PubMed] |
| 2. | Yao L, Yao ZM, Weng H, Zhao GP, Zhou YJ, Yu T. Effect of rat serum containing Biejiajian oral liquid on proliferation of rat hepatic stellate cells. World J Gastroenterol. 2004;10:1911-1913. [PubMed] [DOI] |
| 3. | Dang SS, Jia XL, Cheng YA, Chen YR, Liu EQ, Li ZF. Inhibitory effect of Huangqi Zhechong decoction on liver fibrosis in rat. World J Gastroenterol. 2004;10:2295-2298. [PubMed] |
| 4. | Guo SG, Zhang W, Jiang T, Dai M, Zhang LF, Meng YC, Zhao LY, Niu JZ. Influence of serum collected from rat perfused with compound Biejiaruangan drug on hepatic stellate cells. World J Gastroenterol. 2004;10:1487-1494. [PubMed] [DOI] |
| 5. | He YT, Liu DW, Ding LY, Li Q, Xiao YH. Therapeutic effects and molecular mechanisms of anti-fibrosis herbs and selenium on rats with hepatic fibrosis. World J Gastroenterol. 2004;10:703-706. [PubMed] [DOI] |
| 7. | Sakata R, Ueno T, Nakamura T, Sakamoto M, Torimura T, Sata M. Green tea polyphenol epigallocatechin-3-gallate inhibits platelet-derived growth factor-induced proliferation of human hepatic stellate cell line LI90. J Hepatol. 2004;40:52-59. [PubMed] [DOI] |
| 8. | Isono M, Soda M, Inoue A, Akiyoshi H, Sato K. Reverse transformation of hepatic myofibroblast-like cells by TGFbeta1/LAP. Biochem Biophys Res Commun. 2003;311:959-965. [PubMed] [DOI] |
| 9. | Ballardini G, Groff P, Badiali de Giorgi L, Schuppan D, Bianchi FB. Ito cell heterogeneity: desmin-negative Ito cells in normal rat liver. Hepatology. 1994;19:440-446. [PubMed] [DOI] |
| 10. | Reynaert H, Rombouts K, Jia Y, Urbain D, Chatterjee N, Uyama N, Geerts A. Somatostatin at nanomolar concentration reduces collagen I and III synthesis by, but not proliferation of activated rat hepatic stellate cells. Br J Pharmacol. 2005;146:77-88. [PubMed] [DOI] |
| 11. | Ding X, Saxena NK, Lin S, Xu A, Srinivasan S, Anania FA. The roles of leptin and adiponectin: a novel paradigm in adipocytokine regulation of liver fibrosis and stellate cell biology. Am J Pathol. 2005;166:1655-1669. [PubMed] [DOI] |
| 12. | Chen YW, Wu JX, Chen YW, Li DG, Lu HM. Tetrandrine inhibits activation of rat hepatic stellate cells in vitro via transforming growth factor-beta signaling. World J Gastroenterol. 2005;11:2922-2926. [PubMed] [DOI] |
| 13. | Miyazaki T, Karube M, Matsuzaki Y, Ikegami T, Doy M, Tanaka N, Bouscarel B. Taurine inhibits oxidative damage and prevents fibrosis in carbon tetrachloride-induced hepatic fibrosis. J Hepatol. 2005;43:117-125. [PubMed] [DOI] |
| 14. | Hsu YC, Lin YL, Chiu YT, Shiao MS, Lee CY, Huang YT. Antifibrotic effects of Salvia miltiorrhiza on dimethylnitrosamine-intoxicated rats. J Biomed Sci. 2005;12:185-195. [PubMed] [DOI] |
| 15. | Chang XM, Chang Y, Jia A. Effects of interferon-alpha on expression of hepatic stellate cell and transforming growth factor-beta1 and alpha-smooth muscle actin in rats with hepatic fibrosis. World J Gastroenterol. 2005;11:2634-2636. [PubMed] [DOI] |
| 16. | Yao XX, Jiang SL, Tang YW, Yao DM, Yao X. Efficacy of Chinese medicine Yi-gan-kang granule in prophylaxis and treatment of liver fibrosis in rats. World J Gastroenterol. 2005;11:2583-2590. [PubMed] [DOI] |
| 17. | Li T, Leng XS, Qin ZZ, Song SH, Zhao L, Xiong LF, Peng JR. [Regulation of hepatic stellate cell activation by interleukin-10/platelet derived growth factor/mitogen-activated protein kinase pathway]. Zhonghua Ganzangbing Zazhi. 2005;13:35-37. [PubMed] |
| 18. | Yoshiji H, Noguchi R, Kuriyama S, Ikenaka Y, Yoshii J, Yanase K, Namisaki T, Kitade M, Masaki T, Fukui H. Imatinib mesylate (STI-571) attenuates liver fibrosis development in rats. Am J Physiol Gastrointest Liver Physiol. 2005;288:G907-G913. [PubMed] [DOI] |
| 19. | Fiorucci S, Antonelli E, Rizzo G, Renga B, Mencarelli A, Riccardi L, Orlandi S, Pellicciari R, Morelli A. The nuclear receptor SHP mediates inhibition of hepatic stellate cells by FXR and protects against liver fibrosis. Gastroenterology. 2004;127:1497-1512. [PubMed] [DOI] |
| 20. | Wang X, Tang X, Gong X, Albanis E, Friedman SL, Mao Z. Regulation of hepatic stellate cell activation and growth by transcription factor myocyte enhancer factor 2. Gastroenterology. 2004;127:1174-1188. [PubMed] [DOI] |
| 21. | Parsons CJ, Bradford BU, Pan CQ, Cheung E, Schauer M, Knorr A, Krebs B, Kraft S, Zahn S, Brocks B. Antifibrotic effects of a tissue inhibitor of metalloproteinase-1 antibody on established liver fibrosis in rats. Hepatology. 2004;40:1106-1115. [PubMed] [DOI] |
| 22. | Jiang HQ, Zhang XL, Liu L, Yang CC. Relationship between focal adhesion kinase and hepatic stellate cell proliferation during rat hepatic fibrogenesis. World J Gastroenterol. 2004;10:3001-3005. [PubMed] [DOI] |
| 23. | Liu QH, Li DG, Huang X, Zong CH, Xu QF, Lu HM. Suppressive effects of 17beta-estradiol on hepatic fibrosis in CCl4-induced rat model. World J Gastroenterol. 2004;10:1315-1320. [PubMed] |
| 24. | Border WA, Noble NA. Transforming growth factor beta in tissue fibrosis. N Engl J Med. 1994;331:1286-1292. [PubMed] [DOI] |
| 25. | Pinzani M. Novel insights into the biology and physiology of the Ito cell. Pharmacol Ther. 1995;66:387-412. [PubMed] [DOI] |
| 26. | Zavadil J, Böttinger EP. TGF-beta and epithelial-to-mesenchymal transitions. Oncogene. 2005;24:5764-5774. [PubMed] [DOI] |
| 27. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor beta response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1094-1106. [PubMed] [DOI] |
| 28. | Sentíes-Gómez MD, Gálvez-Gastélum FJ, Meza-García E, Armendáriz-Borunda J. [Hepatic fibrosis: role of matrix metalloproteases and TGFbeta]. Gac Med Mex. 2005;141:315-322. [PubMed] |
| 29. | Knittel T, Mehde M, Kobold D, Saile B, Dinter C, Ramadori G. Expression patterns of matrix metalloproteinases and their inhibitors in parenchymal and non-parenchymal cells of rat liver: regulation by TNF-alpha and TGF-beta1. J Hepatol. 1999;30:48-60. [PubMed] [DOI] |
| 30. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 31. | Breitkopf K, Godoy P, Ciuclan L, Singer MV, Dooley S. TGF-beta/Smad signaling in the injured liver. Z Gastroenterol. 2006;44:57-66. [PubMed] [DOI] |
| 32. | Franklin CC, Rosenfeld-Franklin ME, White C, Kavanagh TJ, Fausto N. TGFbeta1-induced suppression of glutathione antioxidant defenses in hepatocytes: caspase-dependent post-translational and caspase-independent transcriptional regulatory mechanisms. FASEB J. 2003;17:1535-1537. [PubMed] |
| 33. | Zimmermann A. Regulation of liver regeneration. Nephrol Dial Transplant. 2004;19 Suppl 4:iv6-iv10. [PubMed] [DOI] |
| 34. | Nakamura T, Sakata R, Ueno T, Sata M, Ueno H. Inhibition of transforming growth factor beta prevents progression of liver fibrosis and enhances hepatocyte regeneration in dimethylnitrosamine-treated rats. Hepatology. 2000;32:247-255. [PubMed] [DOI] |