修回日期: 2007-11-21
接受日期: 2008-01-15
在线出版日期: 2008-01-28
目的: 探讨纤溶酶原激活物抑制剂1(PAI-1)mRNA在胆汁淤积性肝纤维形成中的动态变化及其作用.
方法: 应用胆管结扎法复制胆汁淤积性肝纤维化动物模型, 分为假手术组, 模型组1 wk、2 wk、3 wk、4 wk, 观察模型大鼠肝组织病理、纤维化程度、RT-PCR检测PAI-1 mRNA的水平、ELISA法检测MMP-2和MMP-9含量的动态变化.
结果: 随胆管阻塞时间延长, 胆管阻塞性肝纤维化大鼠纤维化程度逐渐增加, 模型组1 wk、2 wk、3 wk、4 wk组PAI-1 mRNA表达与假手术组相比, 逐渐增强, 有显著性差异(1.53 ± 0.01, 1.84 ± 0.03, 2.06 ± 0.04, 3.62 ± 0.04 vs 0.72 ± 0.02, P<0.01), 而MMP-2和MMP-9表达先升高后下降.
结论: PAI-1mRNA表达存在动态变化, 其表达升高与胆汁淤积性肝纤维化形成和发展有关.
引文著录: 安德明, 季光, 郑培永. PAI-1在大鼠胆汁淤积性肝纤维化形成中的动态变化. 世界华人消化杂志 2008; 16(3): 246-252
Revised: November 21, 2007
Accepted: January 15, 2008
Published online: January 28, 2008
AIM: To study the dynamic changes of plasminogen activator inhibitor 1 (PAI -1) mRNA in the process of cholestatic liver fibrosis in rats.
METHODS: Rat models of cholestatic liver fibrosis were induced by bile duct ligation. Rats were divided control group, 1 wk, 2 wk, 3 wk and 4 wk groups. Liver pathology and fibrosis degree were observed. Expression of PAI-1 mRNA, MMP-2 and MMP-9 was detected weekly by ELISA.
RESULTS: THistological examination showed that the degree of rat liver fibrosis and the expression of PAI-1 mRNA were gradually increased with the prolongation of biliary obstruction. The expression of PAI-1/β-actin mRNA in 1 wk, 2 wk, 3 wk and 4 wk model groups was significantly higher than that in the control group (1.53 ± 0.01, 1.84 ± 0.03, 2.06 ± 0.04, 3.62 ± 0.04 vs 0.72 ± 0.02, P < 0.01) and the expression of MMP-2 and MMP-9 was elevated in the first stage and then declined.
CONCLUSION: Dynamic changes of PAI-1 mRNA expression are closely correlated with the formation and development of cholestatic liver fibrosis.
- Citation: An DM, Ji G, Zheng PY. Dynamic changes of plasminogen activator inhibitor-1 in the process of cholestatic liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(3): 246-252
- URL: https://www.wjgnet.com/1009-3079/full/v16/i3/246.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i3.246
肝纤维化是肝脏对各种因素所致的慢性损伤的一种修复反应, 是大多数慢性肝病所共有的病理过程, 也是各种慢性肝病向肝硬化过度的中间环节, 其特征是细胞外基质(ECM)在肝内过度沉积[1-10]. 纤溶系统是调节基质金属蛋白酶(matrix metalloprotease, MMPs)活性和ECM降解的关键因素, 在肝脏ECM调控和肝细胞再生等过程中起着重要作用, 与肝纤维化的发生和发展密切相关[11-15]. Ⅰ型纤溶酶原激活物抑制剂(plasminogen activator inhibitor-1, PAI-1)是纤溶系统的主要抑制物, 是尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator, uPA)和组织型纤溶酶原激活剂(tissue-type plasminogen activator, tPA)专一生理抑制剂, 可以迅速、有效地抑制uPA和tPA的活性[16-21]. 观察PAI-1 mRNA在胆汁淤积性肝纤维形成中的动态变化, 有助于阐明其在胆汁淤积性肝纤维化形成中的作用.
SPF级SD♂大鼠63只(体质量260±20 g), 购自上海斯莱克实验动物有限责任公司, 上海中医药大学附属龙华医院实验动物中心饲养. 盐酸氯胺酮注射液(上海第一生化药业公司); 注射用青霉素钠(华北制药股份有限公司); HE染液和Masson染液(上海虹桥乐翔医用试剂有限公司); MMP-2和MMP-9 ELISA试剂盒(上海森雄科技实业有限公司); TRizol Reagent, AMV RT/PCRKit 和DNA Marker(上海申能博彩生物科技有限公司); DEPC和琼脂糖(Sigma); 氯仿、异丙醇(上海试剂一厂); 引物由上海申能博彩生物科技有限公司合成, 大鼠PAI-1上游引物: GTGGTTCGGCACAATCCAACAGAG, 下游引物: GCAATGGAGGACGATACAAGAGGT, β-actin上游: TGTGATGGTGGGTATGGGTCAGAAG; β-actin下游: TCACGGTTGGCCTTAGGGTTCAGAG; DY89-1型电动玻璃匀浆机为宁波新芝科器研究所产品; 低温离心机为Eppendorf公司; PCR仪(BIO-RAD); RNA/DNA calculator(Pharmacia); 凝胶成像系统(上海四星生物技术有限公司); 电热恒温水槽(上海精宏实验设备有限公司); UV-2102C型紫外可见分光光度计(尤尼克公司).
1.2.1 造模及给药: 参照文献[22]采用胆管结扎复制胆汁淤积性肝纤维化模型. 术前禁食不禁水12 h, im盐酸氯胺酮100 mg/kg麻醉, 常规腹部皮肤消毒, 沿腹正中线切开皮肤, 暴露胆总管, 于远近端结扎胆总管, 中间离断, 关腹; 假手术组仅开腹暴露并游离胆总管不结扎, 关腹. 于造模1 wk后, 模型组随机分为1 wk、2 wk、3 wk(各6只), 4 wk(12只); 假手术组分为1 wk、2 wk、3 wk(各6只), 4 wk(10只). 以盐酸氯胺酮ip麻醉(2 mL/kg), 腹主动脉采血, 离心分离血清, -80 ℃保存备用. 摘取肝脏称重后, 于肝右叶切取1.0 cm×1.0 cm大小肝组织2块, 40 g/L中性甲醛溶液固定, 石蜡包埋备组织病理检查, 常规HE, Masson染色; 余下肝组织于液氮中速冻, -80 ℃保存备用. 参考文献[23]制定纤维化程度分级标准: 汇管区纤维组织无增生为"-"; 增生后面积占肝小叶1/3以下为"+"; 占肝小叶1/3-2/3为"++"; 占肝小叶2/3以上为"+++". 每个"+"记1分, 每个标本记总分.
1.2.2 RT-PCR: 标本经-80 ℃保存的大鼠肝组织, 匀浆后用TRizol试剂抽提总RNA, 采用分光光度法测定其含量及纯度, 吸光度在1.8-2.0之间. PCR扩增, 49 μL体系: 1st strand cDNA 5 μL, 10× PCR Buffer 5 μL, dNTP 1 μL, 目的基因正负链各2 μL, β-actin正负链各2 μL, H2O 29 μL, Taq酶 1 μL; PCR循环条件: 95 ℃预变性5 min, 95 ℃ 30 s, 60 ℃ 40 s, 72 ℃ 1 min, 30次循环, 72 ℃ 10 min. PCR产物加样于20个/L琼脂糖凝胶, 电泳, 紫外灯下观察, 凝胶分析系统拍照, 计算机图像扫描和吸光度值分析, 从而得到PAI-1/β-actin mRNA的相对表达量.
1.2.3 ELISA: 取一部分肝组织迅速置于液氮, 之后转入-80 ℃保存, 再用生理盐水制备100 g/L肝匀浆. 匀浆液置于试管中, 4 ℃, 2000 r/min, 离心10 min, 仔细收集上清, -20 ℃保存, 备用. 然后严格按试剂盒说明书操作.
统计学处理 各组计量资料以mean±SD表示, 计量资料采用F检验, 等级资料采用秩和检验, 应用SPSS12.0软件进行分析, P<0.05为有统计学意义.
假手术组大鼠毛发有光泽, 体质量增加, 体态活泼, 食量及二便正常, 模型组大鼠体质量增长缓慢, 2-3 d后大鼠出现小便发黄, 术后7 d, 出现尾部黄染、耳黄、毛发黄染等黄疸表现, 胆总管明显扩张, 梗阻时间越长, 扩张越明显, 肝脏肿大, 呈黄绿色, 随时间延长黄染加重, 第3-4周肝脏质地逐渐变硬, 4 wk表面呈桔皮样. 造模过程中, 大鼠死亡3只, 大鼠在1 wk内死亡2只, 死亡较少, 为结扎线脱落形成胆汁性腹水致死, 2-3 wk无死亡, 第4周始大鼠死亡增加, 共死亡4只, 尸体解剖观察可见消化道出血和腹水等.
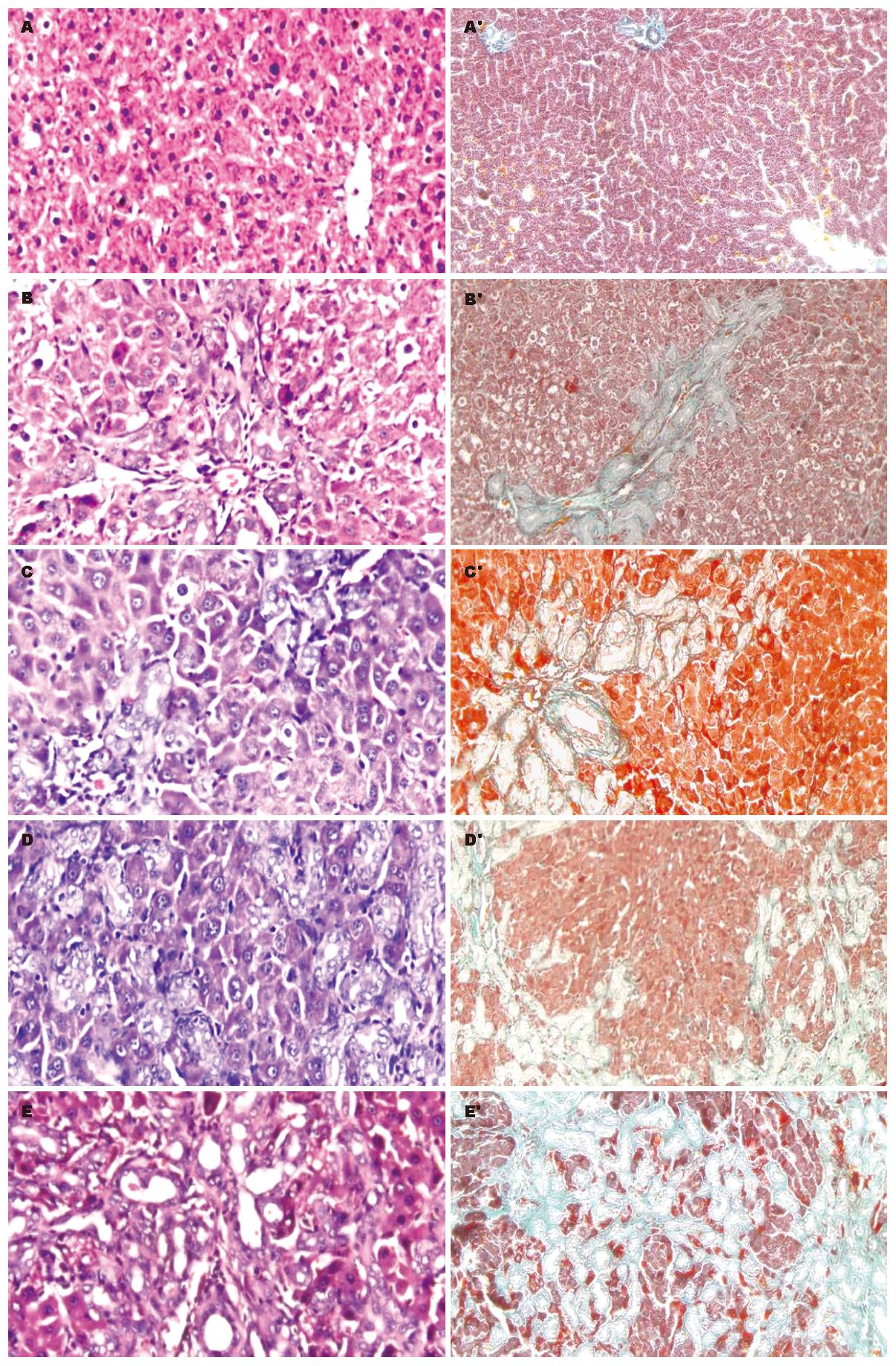
HE染色显示, 假手术组大鼠肝小叶结构清晰, 肝细胞索排列整齐, 呈放射状, 肝窦正常, 胞核结构清晰. 造模第1周可见胆管上皮细胞增生, 可见少量的肝细胞坏死灶; 第2周胆管上皮细胞进一步增殖, 范围较第1周增加, 汇管区面积扩大, 逐渐向小叶内延伸, 增生的胆管上皮细胞周围有纤维组织增生, 炎细胞浸润和肝细胞坏死较少; 第3周增生的胆管上皮细胞分化为小胆管, 与纤维母细胞、纤维组织形成间隔, 改建原有肝小叶; 第4周肝组织结构破坏严重, 细胞呈花环状, 多数有管腔, 大量胶原组织沉积, 纤维增生更加明显, 肝细胞坏死和炎细胞浸润较少, 肝细胞与增生的胆小管相比较明显减少, 肝细胞形态和结构正常(图1A-E). Masson染色、肝纤维化分级表明, 随着胆管阻塞时间的延长, 纤维化程度逐渐加重(图1A'-E', 表1).
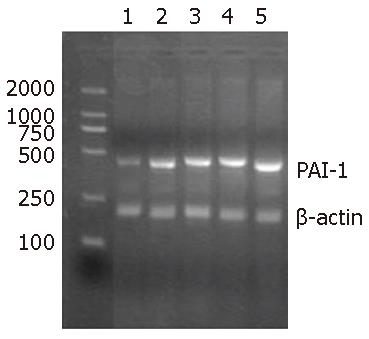
RT-PCR检测结果显示, 假手术组PAI-1 mRNA表达较低(PAI-1/β-actin mRNA为0.72±0.02), 而各时间点模型对照组PAI-1 mRNA表达随胆管阻塞时间延长逐渐增强(PAI-1/β-actin mRNA依次为1.53±0.01, 1.84±0.03, 2.06±0.04, 3.62±0.04), 与假手术组比较, 各时间点模型对照组PAI-1/β-actin mRNA显著增加(P<0.01), 各时间点模型对照组之间PAI-1/β-actin mRNA有显著差异(P<0.01, 图2).
ELISA法检测显示, MMP-2蛋白含量在胆管阻塞1 wk时显著增加, 且随着胆管阻塞时间的延长逐渐增加, 3 wk时达到峰值, 4 wk时有所下降; 与假手术组比较, 各时间点模型对照组均有显著差异(P<0.05、P<0.01), 而各时间点模型对照组之间比较无显著差异(P>0.05). MMP-9蛋白含量在胆管阻塞1 wk时显著增加, 2 wk达到峰值, 而后有所下降; 与假手术组比较, 各时间点模型对照组有均显著差异(P<0.05、P<0.01), 而各时间点模型对照组之间无显著差异(表2).
纤溶系统是纤溶酶原经特异性激活物作用转化为纤溶酶, 导致体内纤维蛋白不断溶解的反应体系, 主要包括纤溶酶原、纤溶酶、纤溶酶原激活物及其抑制剂[24]. 纤溶酶原激活物(PA)通过PA-纤溶酶-MMPs级联反应途径, 最终可产生活化的纤溶酶和MMPs, 后两者是降解ECM各组分的重要物质. PAI-1和PA是调节纤溶系统的重要成分. 两者的平衡维持着纤溶系统功能的正常, 可防止血栓形成和保证血管内血流通畅. 而在肝脏纤维化的过程中, 这种平衡的失调会促进胶原、糖蛋白、蛋白多糖等ECM的合成增加[25], 并在肝组织内沉积形成纤维组织, 从而促进肝脏纤维化和肝硬化的出现. PAI-1基因缺失可以延缓纤维化进程[26-27], 而小鼠uPA基因敲除可自发性出现肝脏、肺脏及其他脏器ECM沉积, 诱发纤维化形成[28-29]. 高脂饮食诱导的家兔脂肪肝肝脏中PAI-1基因的表达亦明显增强[30]. 对大鼠酒精性肝病研究发现, 在肝损伤早期尚未出现明显组织病理学改变时, 即可诱导PAI-1基因在转录水平的过度表达[31]. 而近年临床研究也证实慢性乙肝患者PAI-1蛋白表达着色积分随肝纤维化加重而显著升高[32].
肝纤维化的调控是多水平调节, 其中最主要的是肝星状细胞(hepatic stellate cell, HSC)活化, 进而合成大量ECM, 因此, HSC的激活是肝纤维化发生发展的中心环节, 他是调控肝脏ECM的最主要的细胞[33-43]. 研究发现, 新分离的大鼠HSC可以表达uPA, uPAR和PAI-1, 在HSC活化的早期阶段(7 d)时, uPA mRNA合成和活性达到高峰, HSC完全活化的后期阶段(14-21 d)时, uPA活性逐渐下降, 而PAI-1活性则逐渐增高[44]. 对CCL4诱导的大鼠肝纤维化的研究表明, 在肝纤维化形成的早期, uPA, uPAR mRNA的表达分别增加2.8和1.8倍, 而tPA、PAI-1 mRNA的水平不变; 随着肝纤维化的发展, uPA、uPAR、tPA、PAI-1的mRNA表达都增加, 但PAI-1的表达更加明显, Western blot分析与此一致[45]. 基于上述研究, 有学者认为, uPA及其抑制剂在纤维化的不同阶段起着不同作用. 在早期, uPA可能随HSC活化表达上调, 活性增加, 激活窦周间隙纤溶酶及MMPs, 后两者降解肝脏组织中正常的ECM, 由于缺乏正常的纤维组织的支撑和营养作用, 肝细胞功能受到损害. 此后, HSC不断TGF-β1, 引起PAI-1表达增加, 通过与uPA结合抑制其纤溶激活作用, 导致纤溶酶和MMPs系统活性下调, 细胞外基质沉积明显增加, 肝纤维化程度不断加重. 在肺纤维化的研究中也发现, uPA可激活TGF-β1, 促进肺纤维化, 同时TGF-β1能诱导PAI-1表达, 而PAI-1在肺损伤和胸膜损伤的修复中同样起关键作用[46]. 然而, 也有学者认为, MMP-2和MMP-9活性升高持续整个肝纤维形成期, 可能是机体对纤维间隔和窦周胶原过多沉积的自身调节反应[47]. 国外有学者对胆汁淤积性肝纤维化的研究中发现, 野生鼠胆管阻塞3 d PAI-1 mRNA即显著增加, 而野生和PAI-1基因敲除鼠uPA、MMP-2和MMP-9活性均并未上调, 而α-SMA、Ⅰ胶原mRNA表达均升高; 2 wk野生鼠三者活性都增加, 而且与野生鼠比较, PAI-1基因敲除鼠三者活性增加更加明显, 肝纤维化明显减轻; 同时发现基因敲除鼠早期肝损伤明显减轻, 只是这种保肝作用短暂. 进一步研究表明PAI-1基因缺失延缓肝纤维化进程是由于促进了细胞外基质降解[48].
本研究表明, 在胆管阻塞1 wk, PAI-1 mRNA表达显著升高, PAI-1基因在转录水平的过度表达随着胆管结扎时间延长, 逐渐显著增强; MMP-2和MMP-9蛋白含量在第1周即显著增加, 分别于第3周和第2周达到峰值, 此后有所下降, 但在各时间点之间无统计学差异. 而病理观察表明, 在1-3 wk为胆管细胞增生期, 3 wk后主要为胶原纤维增生期, 随着胆管结扎时间的延长, 纤维化程度逐渐加重, 由此我们推测, 在胆汁淤积性肝纤维化形成早期, uPA或者tPA纤溶活性可能显著增强, 导致MMP-2和MMP-9活性增加. 此后, 可能PAI-1 mRNA的增加的强度要高于PA蛋白的增加, 过多表达的PAI-1通过结合PA抑制其纤溶激活作用, 抑制纤溶酶原的活化进一步抑制MMP-2和MMP-9的活化, 细胞外基质合成继续增加、降解相对不足, 肝纤维程度不断加重. 有研究证实, 将uPA基因导入体外培养的大鼠HSC可以提高上清液中MMP-2的浓度, 胞质内的Ⅰ, Ⅲ型胶原含量明显减少[49]. 外源性uPA基因治疗CCl4诱导的肝纤维化发现, uPA可以提高MMP-2的活性, 促进ECM降解, 延缓肝纤维化进程, 但是并未改善肝功能[50].
综上所述, 在大鼠胆汁淤积性肝纤维形成过程中, PAI-1 mRNA过度表达可能导致PA/PAI-1平衡失衡, 通过PA-纤溶酶-MMPs级联途径影响ECM的合成与降解, 下调ECM降解, 使得ECM合成增加, 沉积增加, 加速肝纤维化的发展和肝硬化的发生. 关于PA在胆汁淤积性肝纤维化形成中的动态变化以及作用机制有待进一步研究.
肝纤维化是大多数慢性肝病所共有的病理过程, 也是各种慢性肝病向肝硬化过度的中间环节, 肝纤维化确切的发病机制尚未完全阐明, 胆管阻塞性肝纤维化动物模型与CCl4、二甲基亚硝胺以及异源血清诱导的肝纤维化模型相比, 具有炎症反应轻、肝细胞坏死少、纤维组织增生明显等特点, 在肝纤维化的发病机制、筛选非创伤性肝纤维血清学诊断指标、新药开发等研究方面具有独特的应用价值, 已广泛应用于肝纤维化研究.
范建高, 主任医师, 上海市第一人民医院消化科.
PAI-1与肝纤维化关系研究的热点主要集中在PAI-1通过调控纤溶系统对细胞外基质调控系统的影响, 尤其是对基质金属蛋白酶系统的调控、与肝纤维化相关细胞因子之间的关系以及在肝星状细胞增殖、迁移中的作用等方面.
最近研究表明, PAI-1在肝纤维化发病过程中起着重要作用, 而且与转化生长因子-β1(TGF-β1)等细胞因子相关. Bergheim et al通过对PAI-1基因敲除小鼠胆管阻塞性肝纤维化模型研究发现与野生小鼠比较PAI-1基因缺失在延缓肝纤维化进程中起着关键作用.
本文动态观察胆汁淤积性肝纤维化形成过程中肝组织病理学、PAI-1、MMP-2、MMP-9变化规律, 发现PAI-1 mRNA表达存在动态变化, 其表达升高与胆汁淤积性肝纤维化形成和发展有关.
本文研究表明, 在胆汁淤积性肝纤维化形成过程中, PAI-1mRNA过度表达可能导致PA/PAI-1平衡失衡, 通过PA-纤溶酶-MMPs级联途径影响ECM的合成与降解, 下调ECM降解, 使得ECM合成增加, 沉积增加, 加速肝纤维化的发展和肝硬化的发生, 提示PAI-1有可能作为胆汁淤积性肝纤维化治疗的靶点之一.
本文设计比较合理, 结果有一定的意义.
编辑: 李军亮 电编: 李军亮
| 1. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 2. | Prosser CC, Yen RD, Wu J. Molecular therapy for hepatic injury and fibrosis: where are we? World J Gastroenterol. 2006;12:509-515. [PubMed] [DOI] |
| 5. | Valkova M. Hepatic fibrogenesis. Bratisl Lek Listy. 2002;103:76-85. |
| 6. | Moreira RK. Hepatic stellate cells and liver fibrosis. Arch Pathol Lab Med. 2007;131:1728-1734. [PubMed] |
| 7. | Guo J, Friedman SL. Hepatic fibrogenesis. Semin Liver Dis. 2007;27:413-426. [PubMed] [DOI] |
| 8. | Huwart L, Sempoux C, Salameh N, Jamart J, Annet L, Sinkus R, Peeters F, ter Beek LC, Horsmans Y, Van Beers BE. Liver fibrosis: noninvasive assessment with MR elastography versus aspartate aminotransferase-to-platelet ratio index. Radiology. 2007;245:458-466. [PubMed] [DOI] |
| 9. | Lamireau T, Desmoulière A, Bioulac-Sage P, Rosenbaum J. Mechanisms of hepatic fibrogenesis. Arch Pediatr. 2002;9:392-405. [DOI] |
| 10. | Ikejima K, Takei Y, Honda H, Hirose M, Yoshikawa M, Zhang YJ, Lang T, Fukuda T, Yamashina S, Kitamura T. Leptin receptor-mediated signaling regulates hepatic fibrogenesis and remodeling of extracellular matrix in the rat. Gastroenterology. 2002;122:1399-1410. [DOI] |
| 11. | Bai K, Guo CJ. [The plasma levels of urokinase plasminogen activator and plasminogen activator inhibitor-1 and the protein expressions of alpha-SMA and MMP-1 and TIMP-1 in patients with different grades of liver fibrosis]. Zhonghua Gan Zang Bing Za Zhi. 2006;14:459-461. [PubMed] |
| 12. | Nagaoka MR, Kouyoumdjian M, Borges DR. Hepatic clearance of tissue-type plasminogen activator and plasma kallikrein in experimental liver fibrosis. Liver Int. 2003;23:476-483. [DOI] |
| 13. | Gangadharan B, Antrobus R, Dwek RA, Zitzmann N. Novel serum biomarker candidates for liver fibrosis in hepatitis C patients. Clin Chem. 2007;53:1792-1799. [PubMed] [DOI] |
| 14. | Wu XR, Lv MH, Wang Q, Shi SS, Guo WD. The plasma levels of transforming growth factor beta1 and the protein expressions of alpha-SMA, urokinase plasminogen activator and plasminogen activator inhibitor-1 in liver of patients with different grades of hepatic fibrosis. Zhonghua Ganzangbing Zazhi. 2004;12:400-402. |
| 15. | Inuzuka S, Ueno T, Torimura T, Tamaki S, Sugawara H, Sakata R, Kusaba N, Sata M, Tanikawa K. The significance of colocalization of plasminogen activator inhibitor-1 and vitronectin in hepatic fibrosis. Scand J Gastroenterol. 1997;32:1052-1060. [DOI] |
| 16. | Pyke C, Kristensen P, Ralfkiaer E, Grøndahl-Hansen J, Eriksen J, Blasi F, Danø K. Urokinase-type plasminogen activator is expressed in stromal cells and its receptor in cancer cells at invasive foci in human colon adenocarcinomas. Am J Pathol. 1991;138:1059-1067. [PubMed] |
| 17. | Idell S. Coagulation, fibrinolysis, and fibrin deposition in acute lung injury. Crit Care Med. 2003;31:S213-S220. [PubMed] [DOI] |
| 18. | Schwartz BS, Espa-a F. Two distinct urokinase-serpin interactions regulate the initiation of cell surface-associated plasminogen activation. J Biol Chem. 1999;274:15278-15283. [DOI] |
| 19. | Binder BR, Christ G, Gruber F, Grubic N, Hufnagl P, Krebs M, Mihaly J, Prager GW. Plasminogen activator inhibitor 1: physiological and pathophysiological roles. News Physiol Sci. 2002;17:56-61. [PubMed] |
| 20. | Le Magueresse-Battistoni B, Pernod G, Sigillo F, Kolodié L, Benahmed M. Plasminogen activator inhibitor-1 is expressed in cultured rat Sertoli cells. Biol Reprod. 1998;59:591-598. [PubMed] [DOI] |
| 21. | Pinsky DJ, Liao H, Lawson CA, Yan SF, Chen J, Carmeliet P, Loskutoff DJ, Stern DM. Coordinated induction of plasminogen activator inhibitor-1 (PAI-1) and inhibition of plasminogen activator gene expression by hypoxia promotes pulmonary vascular fibrin deposition. J Clin Invest. 1998;102:919-928. [PubMed] [DOI] |
| 24. | Nicholl SM, Roztocil E, Davies MG. Plasminogen activator system and vascular disease. Curr Vasc Pharmacol. 2006;4:101-116. [DOI] |
| 25. | Stoop AA, Lupu F, Pannekoek H. Colocalization of thrombin, PAI-1, and vitronectin in the atherosclerotic vessel wall: A potential regulatory mechanism of thrombin activity by PAI-1/vitronectin complexes. Arterioscler Thromb Vasc Biol. 2000;20:1143-1149. [DOI] |
| 26. | Nicholas SB, Aguiniga E, Ren Y, Kim J, Wong J, Govindarajan N, Noda M, Wang W, Kawano Y, Collins A. Plasminogen activator inhibitor-1 deficiency retards diabetic nephropathy. Kidney Int. 2005;67:1297-1307. [PubMed] [DOI] |
| 27. | Chuang-Tsai S, Sisson TH, Hattori N, Tsai CG, Subbotina NM, Hanson KE, Simon RH. Reduction in fibrotic tissue formation in mice genetically deficient in plasminogen activator inhibitor-1. Am J Pathol. 2003;163:445-452. [DOI] |
| 28. | Carmeliet P, Schoonjans L, Kieckens L, Ream B, Degen J, Bronson R, De Vos R, van den Oord JJ, Collen D, Mulligan RC. Physiological consequences of loss of plasminogen activator gene function in mice. Nature. 1994;368:419-424. [PubMed] [DOI] |
| 29. | Swaisgood CM, French EL, Noga C, Simon RH, Ploplis VA. The development of bleomycin-induced pulmonary fibrosis in mice deficient for components of the fibrinolytic system. Am J Pathol. 2000;157:177-187. [DOI] |
| 33. | Friedman SL. Mechanisms of disease: Mechanisms of hepatic fibrosis and therapeutic implications. Nat Clin Pract Gastroenterol Hepatol. 2004;1:98-105. [PubMed] [DOI] |
| 34. | Uemura M, Swenson ES, Gaça MD, Giordano FJ, Reiss M, Wells RG. Smad2 and Smad3 play different roles in rat hepatic stellate cell function and alpha-smooth muscle actin organization. Mol Biol Cell. 2005;16:4214-4224. [PubMed] [DOI] |
| 35. | Xu L, Hui AY, Albanis E, Arthur MJ, O'Byrne SM, Blaner WS, Mukherjee P, Friedman SL, Eng FJ. Human hepatic stellate cell lines, LX-1 and LX-2: new tools for analysis of hepatic fibrosis. Gut. 2005;54:142-151. [PubMed] [DOI] |
| 36. | Gäbele E, Reif S, Tsukada S, Bataller R, Yata Y, Morris T, Schrum LW, Brenner DA, Rippe RA. The role of p70S6K in hepatic stellate cell collagen gene expression and cell proliferation. J Biol Chem. 2005;280:13374-13382. [PubMed] [DOI] |
| 37. | Benyon RC, Arthur MJ. Extracellular matrix degradation and the role of hepatic stellate cells. Semin Liver Dis. 2001;21:373-384. [PubMed] [DOI] |
| 38. | Gressner AM. Transdifferentiation of hepatic stellate cells (Ito cells) to myofibroblasts: a key event in hepatic fibrogenesis. Kidney Int Suppl. 1996;54:S39-S45. [PubMed] |
| 39. | Li D, Friedman SL. Liver fibrogenesis and the role of hepatic stellate cells: new insights and prospects for therapy. J Gastroenterol Hepatol. 1999;14:618-633. [DOI] |
| 40. | Pohl JF, Melin-Aldana H, Sabla G, Degen JL, Bezerra JA. Plasminogen deficiency leads to impaired lobular reorganization and matrix accumulation after chronic liver injury. Am J Pathol. 2001;159:2179-2186. [DOI] |
| 41. | Vergnes L, Phan J, Strauss M, Tafuri S, Reue K. Cholesterol and cholate components of an atherogenic diet induce distinct stages of hepatic inflammatory gene expression. J Biol Chem. 2003;278:42774-42784. [PubMed] [DOI] |
| 42. | Du SL, Pan H, Lu WY, Wang J, Wu J, Wang JY. Cyclic Arg-Gly-Asp peptide-labeled liposomes for targeting drug therapy of hepatic fibrosis in rats. J Pharmacol Exp Ther. 2007;322:560-568. [PubMed] [DOI] |
| 43. | Kisseleva T, Brenner DA. Role of hepatic stellate cells in fibrogenesis and the reversal of fibrosis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S73-S78. [PubMed] [DOI] |
| 44. | Leyland H, Gentry J, Arthur MJ, Benyon RC. The plasminogen-activating system in hepatic stellate cells. Hepatology. 1996;24:1172-1178. [PubMed] [DOI] |
| 45. | Zhang LP, Takahara T, Yata Y, Furui K, Jin B, Kawada N, Watanabe A. Increased expression of plasminogen activator and plasminogen activator inhibitor during liver fibrogenesis of rats: role of stellate cells. J Hepatol. 1999;31:703-711. [DOI] |
| 46. | Lee CG, Homer RJ, Zhu Z, Lanone S, Wang X, Koteliansky V, Shipley JM, Gotwals P, Noble P, Chen Q. Interleukin-13 induces tissue fibrosis by selectively stimulating and activating transforming growth factor beta(1). J Exp Med. 2001;194:809-821. [DOI] |
| 47. | 王 宪波, 刘 平, 唐 志鹏, 陆 雄, 刘 成海, 胡 义扬, 徐 列明, 顾 宏图, 刘 成. 大鼠肝纤维化形成中基质金属蛋白酶2、9活性变化的病理意义. 中华肝脏病杂志. 2004;12:267-268. |
| 48. | Bergheim I, Guo L, Davis MA, Duveau I, Arteel GE. Critical role of plasminogen activator inhibitor-1 in cholestatic liver injury and fibrosis. J Pharmacol Exp Ther. 2006;316:592-600. [PubMed] [DOI] |