修回日期: 2008-09-09
接受日期: 2008-09-17
在线出版日期: 2008-10-18
目的: 研究重症急性胰腺炎(SAP)大鼠细胞凋亡、Caspase-3表达及其与疾病严重程度的关系.
方法: 40只SD大鼠随机分成对照组(SAP组, 胆管逆行性注射牛磺胆酸钠制备SAP模型, n = 20), 实验组(干预组, SAP模型制作成功后, 注射重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白, n = 20). 测定两组血清淀粉酶和TNF-α含量, 采用免疫组化法分析Caspase-3的表达, 运用TUNEL技术检测胰腺细胞的凋亡, 并对胰腺组织进行病理学评分.
结果: 与SAP组比较, 干预组的血清淀粉酶、TNF-α、胰腺组织病理学评分较低(6868.80±595.50 U/L vs 5434.20±481.52 U/L, 258.46±38.57 ng/L vs 182.00±19.67 ng/L, 15.54±2.30 vs 11.06±1.09, 均P<0.05), Caspase-3阳性率和和胰腺细胞的凋亡指数显著升高(20.06±2.17 vs 28.52±3.74, 10.42±1.27 vs 16.23±2.43, 均P<0.05).
结论: SAP时胰腺细胞发生凋亡时伴随Caspase-3的高表达, 而炎症反应和胰腺组织病理学评分得到改善.
引文著录: 纪涛, 汤志刚, 黄强, 许戈良, 陈炯, 李建生. TNF-α抑制剂对重症急性胰腺炎细胞凋亡及Caspase-3表达的影响. 世界华人消化杂志 2008; 16(29): 3324-3327
Revised: September 9, 2008
Accepted: September 17, 2008
Published online: October 18, 2008
AIM: To investigate the relationship between the pancreatitis cell apoptosis , Caspase-3 expression and disease severity in severe acute pancreatitis (SAP) rats.
METHODS: Forty SD rats were randomly divided into SAP group treated with retrograde injection of sodium taurocholate (n = 20), and experimental group (intervention group, SAP animal model was developed, the recombinant human necrosis factor-alpha receptor II: IgG Fc fusion protein was injected, n = 20). Serum amylase and TNF-α were detected. And Caspase-3 expression was measured using immunohistochemitry. And the apoptosis of pancreatic cells were detected using TUNEL and the pathological score of pancreatic tissue was estimated.
RESULTS: Serum amylase, TNF-α and pathological scores of pancreatic tissues were lower (6868.80 ± 595.50 U/L vs 5434.20 ± 481.52 U/L, 258.46 ± 38.57 ng/L vs 182.00±19.67 ng/L, 15.54 ± 2.30 vs 11.06 ± 1.09, all P < 0.05), and the positive rate of Caspase-3 and the apoptotic index of pancreatic cells increased significantly in the intervention group than in the SAP group (20.06 ± 2.17 vs 28.52 ± 3.74, 10.42 ± 1.27 vs 16.23 ± 2.43, both P < 0.05).
CONCLUSION: Pancreatic cell apoptosis is associated with increased expression of the Caspase-3, improved the inflammatory response and lowered pancreatic tissue pathological score in rats with severe acute pancreatitis.
- Citation: Ji T, Tang ZG, Huang Q, Xu GL, Chen J, Li JS. Effects of tumor necrosis factor-α inhibitor on cell apoptosis and expression of Caspase-3 in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2008; 16(29): 3324-3327
- URL: https://www.wjgnet.com/1009-3079/full/v16/i29/3324.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i29.3324
重症急性胰腺炎(severe acute pancreatitis, SAP)是一种病程凶险、病死率较高的疾病, 易并发多器官功能障碍, 其发病机制目前尚不清楚. 有研究证实, 胰腺细胞的凋亡情况与SAP的预后关系密切[1-8], 而Caspase-3是诱导细胞凋亡的重要蛋白之一. 本研究旨在观察肿瘤坏死因子-α(TNF-α)抑制剂对SAP细胞凋亡及Caspase-3表达的影响及其与疾病严重程度的关系.
清洁级健康成年SD大鼠40只, 体质量250±25 g, 雌雄不拘, 由安徽医科大学实验动物中心提供. 牛磺胆酸钠(Sigma公司), Caspase-3试剂盒(武汉博士德生物工程有限公司), TNF-α EILISA试剂盒(晶美公司), TUNEL试剂盒(凯基生物科技发展有限公司), BeckmanCX9全自动生化分析仪, 重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(上海中信国健药业有限公司).
1.2.1 分组及SAP模型制备: 实验大鼠随机分为2组: SAP组(n = 20), 干预组(n = 20). 各组大鼠术前禁食24 h, 禁水6 h. 20 g/L硫喷妥钠麻醉(50 mg/kg体质量)后, 上腹部正中切口进腹, 找到大鼠十二指肠和胆胰管后, 用无创血管夹夹闭胆胰管肝端, 经十二指肠浆膜层行胆胰管逆行穿刺, 微量注射器行胆胰管内注射50 g/L牛磺胆酸钠(1 mL/kg体质量), 速度0.2 mL/min, 推药后夹闭胆胰管入十二指肠处, 确认大鼠胃、十二指肠间的胰腺组织出现异常, 颜色变为砖红色或出现出血点后拔出针头, 去除血管夹后关腹. 干预组于在模型制作成功后sc重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(0.25 mg/kg), 12 h后处死动物.
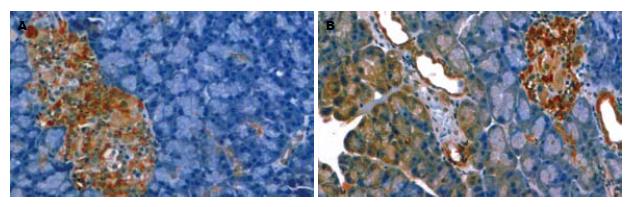
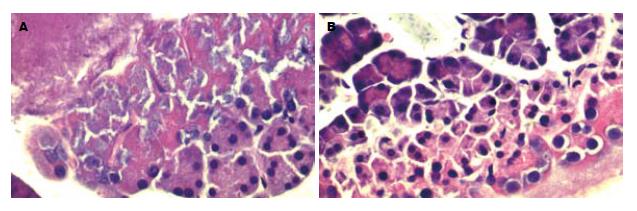
1.2.2 观察指标和方法: (1)血清淀粉酶和TNF-α测定: 采血针器抽取下腔静脉血3 mL经3000 r/min离心10 min, 制备血清于-30℃保存. 经CX9全自动生化分析仪检测血淀粉酶; 血清TNF-α测定采用双抗夹心酶联免疫吸附(ELISA)法检测, 严格按照试剂盒说明书操作. (2)TUNEL法检测胰腺细胞凋亡: 石蜡组织切片常规脱蜡水化, 10 g/L蛋白酶K室温消化10 min, 40 g/L甲醛溶液固定5 min, Epuilibration Buffer缓冲液室温平衡10 min, 加rTdT酶反应液于37℃湿盒中反应60 min, 2×SSC中浸洗终止反应, 3 mL/L的H2O2浸洗5 min阻止内源性过氧化物, l:500稀释的Streptavidin-HRP室温反应30 min, 加入新鲜配置的DAB显色10 min, 去离子水漂洗后苏木精复染, 封片镜检. 有棕黄色颗粒者为阳性细胞, 即凋亡的胰腺腺泡细胞. 每张切片染色阳性区域随机选取5个不同的高倍视野(×40), 计算200个胰腺细胞中阳性细胞所占的百分比, 即为凋亡指数(apoptosis index, AI). (3)免疫组化检测Caspase-3蛋白的表达: 采用SP两步法染色, 操作过程按照试剂盒说明书进行, DAB显色, 苏木素复染, 封片, 光镜下观察. 含有棕黄色或棕黄色颗粒的细胞为阳性细胞. 每张切片随机选取5个不同的高倍视野(×40), 计数100个胰腺细胞, 计算阳性细胞所占的百分比即为Caspase-3的阳性率. (4)病理观察: 胰腺组织固定于40 g/L多聚甲醛溶液中(含0.1% DEPC), 常规脱水, 石蜡包埋、切片做苏木素-伊红染色, 由两位病理医师采用盲法按照Gross[9]评分标准进行评分.
统计学处理 采用SPSS10.0统计分析软件进行处理, 所得数值以数据以mean±SD表示, 组间比较采用方差分析和t检验,P<0.05为具有统计学意义.
与SAP组比较, 干预组的血清淀粉酶、TNF-α、胰腺组织的病理学评分较低(P<0.05), Caspase-3阳性率和和胰腺细胞的凋亡指数显著升高(P<0.05, 表1, 图1).
急性胰腺炎除了伴有胰腺本身的损伤外, 其另一重要的致命因素来自各种炎症介质的释放导致全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍(multiple organ dysfuction syndrome, MODS), 最终导致患者死亡[10]. 自凋亡的概念被提出后, 人们对其进行了广泛深入的研究, 发现凋亡参与了急性胰腺炎发生发展的全过程, 同时发现胰腺细胞的凋亡对病程进展是一种有益的反应[11-14]. 研究发现, 轻度急性胰腺炎胰腺腺泡细胞凋亡较多而坏死很少, 急性坏死性胰腺炎腺泡细胞出现大量坏死, 因而凋亡在急性胰腺炎发病中的意义与作用受到人们的重视, 众多实验研究均支持这一观点, 即病理条件下受损的腺泡细胞发生凋亡可以减少因坏死释放的活性胰酶, 减轻炎症介质的瀑布样级联释放, 这可能是急性胰腺炎时机体的自我保护机制之一[15]. 本研究主要探讨TNF-α抑制剂对SAP细胞凋亡及Caspase-3表达的影响及其与疾病严重程度的关系.
在SAP中, TNF-α在机体的炎症反应中处于始动地位, 对细胞因子的级联释放具有重要意义, 起到"扳机"样作用, 是评估SAP预后的主要指标[16-18]. 本研究通过抑制TNF-α, 发现干预组血清淀粉酶和TNF-α水平均低于SAP组, 胰腺间质水肿、炎症浸润、坏死程度均较SAP组小, 可见抑制TNF-α能在一定程度上抑制SAP的炎症反应, 同时TNF-α抑制剂诱导Caspase-3蛋白的表达, 而Caspase-3蛋白酶是胰腺B细胞凋亡途径的关键信号酶[19], 抑制Caspase-3能减少细胞凋亡发生, 其激活能够诱导凋亡并能够导致其他Caspase级联释放. Nam et al[20]发现青蒿素能够通过上调Caspase-3蛋白表达诱导细胞凋亡, 上调Caspase-3蛋白表达除了促进肿瘤细胞凋亡外, 对SAP胰腺细胞凋亡也具有促进作用, 且能明显改善炎症反应和组织病理学评分[21]. 本研究证实抑制TNF-α能够上调Caspase-3蛋白表达, 诱导细胞凋亡, 降低胰腺炎病理学评分, 改善急性胰腺炎预后.
重症急性胰腺炎(SAP)是消化外科急腹症死亡率最高的疾病之一, 其中炎症介质的级联释放在该疾病进展中的作用成为当前研究的热点. TNF-α在机体的炎症反应中处于始动地位, 其抑制剂能诱导凋亡蛋白的表达, 凋亡细胞的增加能在一定程度上抑制炎症反应, 有关炎症介质与细胞凋亡的关系, 目前仍然处于起步阶段, TNF-α水平对胰腺细胞凋亡影响实验结果也不尽相同.
吕云福, 教授, 海南省人民医院外一科
近年的研究热点主要集中在通过平衡促炎症介质和抑炎症介质的平衡对SAP进行干预, 血液滤过炎症介质治疗SAP目前已经在临床上开展, 但是其种种弊端限制了在临床上的应用, 研究者希望能通过药物使用来达到这种效果.
近年来研究发现, TNF-α抑制剂能诱导细胞程序性死亡, 而凋亡蛋白酶Caspase-3是胰腺B细胞凋亡途径的关键信号酶, 因此能有效的评价胰腺细胞的凋亡和对炎症反应的抑制情况.
TNF-α抑制剂能够诱导胰腺细胞的凋亡和抑制炎症反应, 这为进一步研究其作用机制, 研发新的抑制促炎症介质药物及该药物在炎症性疾病的临床应用奠定了实验基础.
本研究对照合理, 统计方法恰当, 具有一定学术价值, 但新颖性一般.
编辑: 李军亮 电编:郭海丽
| 1. | Knobbe CB, Trampe-Kieslich A, Reifenberger G. Genetic alteration and expression of the phosphoinositol-3-kinase/Akt pathway genes PIK3CA and PIKE in human glioblastomas. Neuropathol Appl Neurobiol. 2005;31:486-490. [PubMed] [DOI] |
| 2. | Gerasimenko JV, Gerasimenko OV, Palejwala A, Tepikin AV, Petersen OH, Watson AJ. Menadione-induced apoptosis: roles of cytosolic Ca(2+) elevations and the mitochondrial permeability transition pore. J Cell Sci. 2002;115:485-497. [PubMed] |
| 3. | Hahm KB, Kim JH, You BM, Kim YS, Cho SW, Yim H, Ahn BO, Kim WB. Induction of apoptosis with an extract of Artemisia asiatica attenuates the severity of cerulein-induced pancreatitis in rats. Pancreas. 1998;17:153-157. [PubMed] [DOI] |
| 4. | Cosen-Binker LI, Binker MG, Cosen R, Negri G, Tiscornia O. Relaxin prevents the development of severe acute pancreatitis. World J Gastroenterol. 2006;12:1558-1568. [PubMed] |
| 5. | Lupia E, Goffi A, De Giuli P, Azzolino O, Bosco O, Patrucco E, Vivaldo MC, Ricca M, Wymann MP, Hirsch E. Ablation of phosphoinositide 3-kinase-gamma reduces the severity of acute pancreatitis. Am J Pathol. 2004;165:2003-2011. [PubMed] |
| 6. | Bhatia M. Apoptosis versus necrosis in acute pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2004;286:G189-G196. [PubMed] [DOI] |
| 7. | Bhatia M. Apoptosis of pancreatic acinar cells in acute pancreatitis: is it good or bad? J Cell Mol Med. 2004;8:402-409. [PubMed] [DOI] |
| 8. | Bhatia M, Wong FL, Cao Y, Lau HY, Huang J, Puneet P, Chevali L. Pathophysiology of acute pancreatitis. Pancreatology. 2005;5:132-144. [PubMed] [DOI] |
| 9. | Gross V, Andreesen R, Leser HG, Ceska M, Liehl E, Lausen M, Farthmann EH, Scholmerich J. Interleukin-8 and neutrophil activation in acute pancreatitis. Eur J Clin Invest. 1992;22:200-203. [PubMed] [DOI] |
| 10. | Cuzzocrea S, Nocentini G, Di Paola R, Agostini M, Mazzon E, Ronchetti S, Crisafulli C, Esposito E, Caputi AP, Riccardi C. Proinflammatory role of glucocorticoid-induced TNF receptor-related gene in acute lung inflammation. J Immunol. 2006;177:631-641. [PubMed] |
| 11. | Yasuda T, Takeyama Y, Ueda T, Shinzeki M, Sawa H, Nakajima T, Kuroda Y. Breakdown of intestinal mucosa via accelerated apoptosis increases intestinal permeability in experimental severe acute pancreatitis. J Surg Res. 2006;135:18-26. [PubMed] [DOI] |
| 12. | Bhatia M, Wallig MA, Hofbauer B, Lee HS, Frossard JL, Steer ML, Saluja AK. Induction of apoptosis in pancreatic acinar cells reduces the severity of acute pancreatitis. Biochem Biophys Res Commun. 1998;246:476-483. [PubMed] [DOI] |
| 13. | Saluja A, Hofbauer B, Yamaguchi Y, Yamanaka K, Steer M. Induction of apoptosis reduces the severity of caerulein-induced pancreatitis in mice. Biochem Biophys Res Commun. 1996;220:875-878. [PubMed] [DOI] |
| 14. | Kaiser AM, Saluja AK, Lu L, Yamanaka K, Yamaguchi Y, Steer ML. Effects of cycloheximide on pancreatic endonuclease activity, apoptosis, and severity of acute pancreatitis. Am J Physiol. 1996;271:C982-C993. [PubMed] |
| 15. | Takeyama Y. Significance of apoptotic cell death in systemic complications with severe acute pancreatitis. J Gastroenterol. 2005;40:1-10. [PubMed] [DOI] |
| 16. | Gulcubuk A, Altunatmaz K, Sonmez K, Haktanir-Yatkin D, Uzun H, Gurel A, Aydin S. Effects of curcumin on tumour necrosis factor-alpha and interleukin-6 in the late phase of experimental acute pancreatitis. J Vet Med A Physiol Pathol Clin Med. 2006;53:49-54. [PubMed] [DOI] |
| 17. | Andoh A, Hata K, Shimada M, Fujino S, Tasaki K, Bamba S, Araki Y, Fujiyama Y, Bamba T. Inhibitory effects of somatostatin on tumor necrosis factor-alpha-induced interleukin-6 secretion in human pancreatic periacinar myofibroblasts. Int J Mol Med. 2002;10:89-93. [PubMed] |
| 18. | Kusske AM, Rongione AJ, Reber HA. Cytokines and acute pancreatitis. Gastroenterology. 1996;110:639-642. [PubMed] [DOI] |
| 19. | Reddy S, Bradley J, Ginn S, Pathipati P, Ross JM. Immunohistochemical study of Caspase-3-expressing cells within the pancreas of non-obese diabetic mice during cyclophosphamide-accelerated diabetes. Histochem Cell Biol. 2003;119:451-461. [PubMed] [DOI] |
| 20. | Nam W, Tak J, Ryu JK, Jung M, Yook JI, Kim HJ, Cha IH. Effects of artemisinin and its derivatives on growth inhibition and apoptosis of oral cancer cells. Head Neck. 2007;29:335-340. [PubMed] [DOI] |
| 21. | Zhao M, Xue DB, Zheng B, Zhang WH, Pan SH, Sun B. Induction of apoptosis by artemisinin relieving the severity of inflammation in caerulein-induced acute pancreatitis. World J Gastroenterol. 2007;13:5612-5617. [PubMed] [DOI] |