修回日期: 2008-08-23
接受日期: 2008-08-26
在线出版日期: 2008-10-18
目的: 探讨热休克蛋白90(HSP90)功能特异性抑制剂17-DMAG对胃癌细胞SGC-7901增殖及凋亡的影响.
方法: 体外培养人胃癌细胞SGC-7901, 以不同浓度的17-DMAG处理后采用MTT法检测SGC-7901细胞的生长抑制情况, 流式细胞仪碘化丙啶(PI)染色分析细胞周期分布, 流式细胞仪及Annexin V-FITC试剂盒监测17-DMAG对胃癌细胞SGC-7901凋亡的影响.
结果: 不同浓度的17-DMAG对人胃癌细胞SGC-7901有明显的生长抑制作用, 各组之间比较(P<0.01),且呈时效量效依赖关系(F = 241.313, 246.856, 均P<0.001). 17-DMAG作用24 h后胃癌细胞株SGC-7901呈现G2/M期阻滞, 试验组与对照组比较(F = 231.991, P<0.001), 呈浓度依赖关系. 17-DMAG处理胃癌细胞SGC-7901 24 h早期凋亡细胞增加, 48 h晚期凋亡细胞增加.
结论: 17-DMAG可明显抑制胃癌细胞SGC-7901的增殖, 使胃癌细胞SGC-7901阻滞于G2/M期, 诱导胃癌细胞SGC-7901凋亡.
引文著录: 高志军, 赵春临, 乔军波, 张谢夫. HSP90抑制剂17-DMAG对胃癌细胞株SGC-7901增殖及凋亡的影响. 世界华人消化杂志 2008; 16(29): 3269-3273
Revised: August 23, 2008
Accepted: August 26, 2008
Published online: October 18, 2008
AIM: To explore the effect of 17-DMAG, an inhibitor specific for heat shock protein 90, on the growth and apoptosis of gastric cancer cell lines SGC-7901.
METHODS: Human gastric cancer cell lines SGC-7901 were cultivated using routine method, then treated with different concentrations of 17-DMAG. Cell proliferation was detected using MTT assay, and cell cycle and apoptosis were determined using flow cytometry.
RESULTS: 17-DMAG inhibited the proliferation of SGC-7901 cells in time-dependent and dose-dependent manners (F = 241.313, 246.856, both P < 0.001). After treatment with 17-DMAG, SGC-7901 cell cycle was arrested at G2/M phase, and there was significant difference between treatment group and control group (F = 231.991, P < 0.001). An increase in early apoptosis occurred at 24 hours' treatment and in late apoptosis at 48 hours' treatment.
CONCLUSION: 17-DMAG inhibits gastric cancer SGC-7901 cell proliferation and thus induces apoptosis and accumulation in G2/M phase in vitro.
- Citation: Gao ZJ, Zhao CL, Qiao JB, Zhang XF. Effect of heat shock protein 90 inhibitor 17-DMAG on proliferation and apoptosis of human gastric cancer cell lines SGC-7901. Shijie Huaren Xiaohua Zazhi 2008; 16(29): 3269-3273
- URL: https://www.wjgnet.com/1009-3079/full/v16/i29/3269.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i29.3269
热休克蛋白90(heat shock protein 90, HSP90)是一种分子伴侣, 在保护蛋白质的正确空间结构、防止其意外降解和保护蛋白质功能方面有重要意义. HSP90的主要作用是结合已获得3级结构的蛋白质, 参与这些蛋白质的激活与成熟过程. 肿瘤的发生是由于癌基因与抑癌基因之间失衡, 引起细胞的恶性转化, 肿瘤细胞内信号转导网络失衡, 导致癌蛋白的过度表达. HSP90在多种肿瘤组织中表达增高[1], 与细胞内信号转导通路中的信号蛋白相互作用, 维持这些蛋白的正常结构与功能, 在肿瘤的发生发展中起重要作用, 目前已成为抗肿瘤研究的热门靶点[2-3]. 格尔德霉素(geldanamycin, GA)是最早被发现的HSP90的特异性功能抑制剂, GA和其半合成衍生物17-AAG以及17-DMAG, 这些小分子化合物与ATP竞争结合HSP90氮端的结合位点从而改变HSP90的构象, 使其不能与客户蛋白(client proteins)及其他小分子蛋白形成复合体, 抑制其分子伴侣功能, 最终导致客户蛋白降解, 继而阻止肿瘤赖以生存的信号网络, 导致肿瘤细胞周期停滞, 诱导肿瘤细胞凋亡[4]. 本实验通过观察HSP90抑制剂17-DMAG对胃癌细胞株SGC-7901增殖的影响, 并通过检测细胞周期及细胞凋亡的改变, 从而为胃癌的分子治疗提供新的途径.
人胃癌细胞株SGC-7901由郑州大学药学院付蕾教授惠赠, HSP90抑制剂17-DMAG购自美国Sigma-Aldrich公司, 用DMSO溶解后配成3.2 mmol/L的储存液, 保存于-20℃. 四甲基偶氮唑盐(MTT)、碘化丙啶(PI)为Sigma公司产品. Annexin V-FITC试剂盒购自BD公司.
1.2.1 细胞培养: SGC-7901细胞培养于含100 mL/L胎牛血清的RPMI 1640培养液, 在37℃、50 mL/L CO2孵育箱中培养. 取对数生长期细胞进行实验, 接种细胞密度为2.5×107/L.
1.2.2 MTT法测定细胞增殖: 收集对数生长期细胞, 调整密度以2.5×107/L, 每孔200 μL接种于96孔培养板, 培养48 h, 实验组加入3.2 mmol/L 17-DMAG储存液使其终浓度为0.4、0.8、1.6、3.2、6.4 μmol/L, 以等量含有相同浓度DMSO的RPMI 1640培养液作为阴性对照, 每组设5个复孔. 分别培养24、48和72 h后每孔加入5 g/L的MTT溶液20 μL, 再培养4 h, 弃去上清液, 每孔加入150 μL DMSO溶解沉淀, 微型振荡仪振荡10 min混匀, 用酶标仪测定波长490 nm的吸光度值, 细胞生长抑制率 = (1-实验组A值/对照组平均A值)×100%. 实验重复3次.
1.2.3 流式细胞仪检测细胞周期: 实验组细胞以2.5 μmol/L和5 μmol/L 17-DMAG作用24 h, 以相同浓度的DMSO作为阴性对照组. 收集细胞, 以-20℃预冷的700 mL/L乙醇固定过夜, PBS洗涤2次后加入碘化丙啶(PI)染液, 4℃避光染色20 min后,流式细胞仪检测细胞周期.
1.2.4 流式细胞仪及Annexin V-FITC试剂盒分析细胞凋亡: 细胞传代进入对数生长期, 达到80%左右, 随机分组, 实验组加入3 μmol/L 17-DMAG, 对照组加入相同浓度的DMSO分别于24、48 h收集细胞, 按照Annexin V-FITC试剂盒说明书操作, 检测凋亡细胞.
统计学处理 采用SPSS13.0统计学软件进行统计分析, 试验数据以mean±SD表示, 分析采用方差分析, 组间比较用SLD法,P<0.05认为差异有统计学意义.
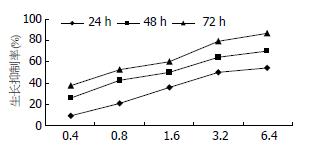
17-DMAG抑制胃癌细胞SGC-7901的生长, 分别以0.4、0.8、1.6、3.2、6.4 μmol/L 17-DMAG处理SGC-7901细胞24、48、72 h后, 细胞生长均呈不同程度的抑制, 并呈浓度依赖与时间依赖性(F = 241.313, P<0.001; F = 246.856, P<0.001). 不同浓度和不同时间抑制率之间差异显著(24 h: 8.8±4.3, 20.9±8.6, 35.5±3.3, 50.1±3.9, 53.9±7.4, P<0.01; 48 h: 25.9±9.2, 42.2±4.1, 49.9±5.6, 64.3±2.4, 70.4±2.8 P<0.01; 72 h: 37.8±4.9, 52.6±6.6, 60.2±7.5, 79.3±3.6, 86.3±2.2, P<0.01, 表1, 图1).
| 17-DMAG(mmol/L) | 24 h | 48 h | 72 h |
| 0.4 | 8.8±4.3 | 25.9±9.2 | 37.8±4.9 |
| 0.8 | 20.9±8.6 | 42.2±4.1 | 52.6±6.6 |
| 1.6 | 35.5±3.3 | 49.9±5.6 | 60.2±7.5 |
| 3.2 | 50.1±3.9 | 64.3±2.4 | 79.3±3.6 |
| 6.4 | 53.9±7.4 | 70.4±2.8 | 86.3±2.2 |
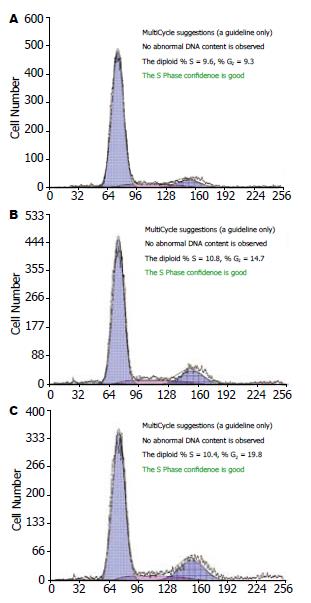
流式细胞仪分析表明, 17-DMAG作用24 h后胃癌细胞SGC-7901出现G2/M期阻滞, 随浓度的增大其阻滞作用增强. 对照组G2/M期细胞为9.2%±0.85%, 2.5 μmol/L实验组G2/M期细胞增加到14.5%±0.62%, 5 μmol/L实验组G2/M期细胞增加到19.9%±1.95%. 实验组与对照组比较, 差异显著(F = 231.991, P<0.001, 图2, 表2).
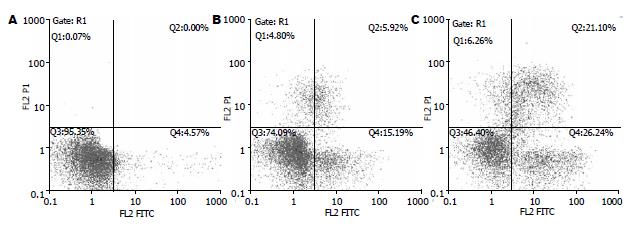
Annexin V-FITC染色, 流式细胞仪分析表明3 μmol/L 17-DMAG作用24 h后, Annexin V+/PI-细胞由4.57%增加至15.17%. 3 μmol/L 17-DMAG处理48 h后Annexin V+/PI-细胞增加至26.24%; 晚期凋亡Annexin V+/PI+增加至21.10%. 实验组与对照组差别显著(图3).
基因的不稳定性导致肿瘤的发生, 尽管细胞的恶性转化仅需要某些特定的基因的改变, 肿瘤细胞的遗传可塑性使他们能够对具体的针对细胞信号转导途径中某一环节的分子靶向药物失去反应, 甚至产生耐药. 大多数实体瘤患者, 当其被诊断为肿瘤患者时, 其体内的基因已有多种改变, 足以对抗单一的分子靶向治疗药物. 1999年Kaelin首先提出了多点攻击(multi-hit modality)理论. 该理论的核心是利用某一靶位实现对信号通路的多点阻断, 从而摧毁肿瘤细胞赖以生存的整个信号通路网络. 因此寻找有效的靶位是这一理论应用于肿瘤治疗的关键[5]. 肿瘤细胞经常面临生存环境的剧烈变化, 如缺氧、酸中毒、医源性化疗和放疗等, 在这种环境下仍然有肿瘤细胞生存. 剧烈的环境变化导致细胞蛋白的损伤, 考虑到分子伴侣保护受损的细胞蛋白, 而且近年研究发现, 细胞信号转导通路中的许多蛋白是HSP90的客户蛋白. HSP90在肿瘤的发生进展及转移过程中发挥了重要作用. 因此通过抑制HSP90这一靶点, 进而抑制肿瘤细胞信号转导通路中的多种蛋白, 实现多点攻击, 干扰肿瘤细胞周期、诱导细胞凋亡、抑制肿瘤浸润、新生血管形成和肿瘤转移, 从多方面达到抑制肿瘤生长, 最终治愈肿瘤的目的[6].
HSP90是最丰富的伴侣蛋白之一, 与多种细胞增殖相关蛋白结合. HSP90在肿瘤细胞中的表达率是正常细胞的2-10倍[7], 在肿瘤细胞的生长和存活中起重要作用. Paduano et al报道肿瘤来源的HSP90与17AAG的亲和力是正常组织亲和力的100倍, 因而HSP90抑制剂能特异性地杀伤肿瘤细胞[8]. 近几年, 国外研究证实HSP90抑制剂17-AAG和17-DMAG有效诱导肿瘤细胞死亡已在乳腺癌、卵巢癌和前列腺癌等细胞系中得到证实, 并进入Ⅰ期临床实验[9].
胃癌是我国高发肿瘤, 其发病率在消化道肿瘤中居于第1位. 化疗效果一直不尽如人意, 毒副作用严重, 不敏感或很快产生耐受, 寻找更加有效的治疗药物和辅助治疗手段, 乃当务之急. 为了探讨HSP90抑制剂17-DMAG对胃癌细胞的作用, 我们采用细胞培养技术, 应用MTT法检测17-DMAG对SGC-7901细胞的生长抑制作用, 结果表明17-DMAG能明显抑制SGC-7901细胞的生长, 且呈显著的浓度-作用时间依赖性. 17-DMAG抑制细胞生长, 诱导肿瘤细胞凋亡, 是通过抑制HSP90的功能, 干扰信号转导蛋白HER2、Raf、Ras、Akt、STAT等, 而且通过干扰肿瘤细胞内端粒酶(tolemerase)的稳定, 达到对肿瘤细胞的生长抑制作用[2-3]. 流式细胞仪检测细胞周期发现, 17-DMAG阻滞SGC-7901细胞于G2/M期, 且浓度越高其阻滞作用愈强. 我们推测17-DMAG作为HSP90抑制剂可能通过抑制HSP90的分子伴侣功能, 干扰多种细胞周期蛋白的功能(如CyclinA、CyclinB和CDK1), 使胃癌细胞SGC-7901停滞于G2/M期. 在预试验中我们发现17-DMAG阻滞SGC-7901细胞于G2/M期, G2/M期凋亡的二倍体亚峰与S期或G0/G1重合, 故本实验中我们应用phoenixflow流式细胞仪分析软件分析时没有分析凋亡的二倍体亚峰, 我们应用流式细胞仪Annexin V-FITC染色单独监测胃癌细胞SGC-7901的早期凋亡和晚期凋亡, 试验结果更为可靠. 本实验中, 17-DMAG作用SGC-7901细胞24 h, 早期凋亡细胞明显增加, 作用48 h不仅晚期凋亡细胞增加, 而且早期凋亡细胞亦有增加. 细胞凋亡是一个严密完整的程序化死亡过程, 受凋亡抑制蛋白(inhibitors of apoptosis proteins, IAPs)调节. 我们推测17-DMAG通过抑制HSP90功能, 使客户蛋白survivin、livin表达下调, 诱导肿瘤细胞凋亡, 同时其通过抑制STAT信号转导及突变P53诱导胃癌凋亡[3,10], 这也是我们下一步研究的方向. 当增大药物浓度至6 μmol/L作用48 h发现大部分SGC-7901细胞漂浮死亡, 细胞结构消失, 以3 μmol/L 17-DMAG作用72 h发现, 亦发现大量SGC-7901细胞死亡, 提示细胞凋亡是17-DMAG抑制肿瘤生长的一个重要方式, 不是唯一途径. 国外文献报道17-DMAG通过有丝分裂灾难(mitotic catastrophe)引起肿瘤细胞死亡. Schwock et al[11]在研究HSP90抑制剂对宫颈癌细胞的凋亡作用时, 发现17-DMAG可以引起宫颈癌细胞反常有丝分裂, 导致部分肿瘤细胞死亡.
总之, 17-DMAG通过阻滞胃癌细胞SGC-7901细胞周期, 诱导细胞凋亡, 抑制胃癌细胞生长, 有望为胃癌的分子靶向治疗提供新的途径.
编辑: 李军亮 电编:郭海丽
| 1. | Chatterjee M, Jain S, Stuhmer T, Andrulis M, Ungethum U, Kuban RJ, Lorentz H, Bommert K, Topp M, Kramer D. STAT3 and MAPK signaling maintain overexpression of heat shock proteins 90alpha and beta in multiple myeloma cells, which critically contribute to tumor-cell survival. Blood. 2007;109:720-728. [PubMed] [DOI] |
| 2. | Sidera K, Patsavoudi E. Extracellular HSP90: conquering the cell surface. Cell Cycle. 2008;7:1564-1568. [PubMed] |
| 3. | Powers MV, Workman P. Targeting of multiple signalling pathways by heat shock protein 90 molecular chaperone inhibitors. Endocr Relat Cancer. 2006;13 Suppl 1:S125-S135. [PubMed] [DOI] |
| 4. | Robles AI, Wright MH, Gandhi B, Feis SS, Hanigan CL, Wiestner A, Varticovski L. Schedule-dependent synergy between the heat shock protein 90 inhibitor 17-(dimethylaminoethylamino)-17-demethoxygeldanamycin and doxorubicin restores apoptosis to p53-mutant lymphoma cell lines. Clin Cancer Res. 2006;12:6547-6556. [PubMed] [DOI] |
| 5. | Sharp SY, Prodromou C, Boxall K, Powers MV, Holmes JL, Box G, Matthews TP, Cheung KM, Kalusa A, James K. Inhibition of the heat shock protein 90 molecular chaperone in vitro and in vivo by novel, synthetic, potent resorcinylic pyrazole/isoxazole amide analogues. Mol Cancer Ther. 2007;6:1198-1211. [PubMed] [DOI] |
| 6. | Lang SA, Klein D, Moser C, Gaumann A, Glockzin G, Dahlke MH, Dietmaier W, Bolder U, Schlitt HJ, Geissler EK. Inhibition of heat shock protein 90 impairs epidermal growth factor-mediated signaling in gastric cancer cells and reduces tumor growth and vascularization in vivo. Mol Cancer Ther. 2007;6:1123-1132. [PubMed] [DOI] |
| 7. | Kamal A, Thao L, Sensintaffar J, Zhang L, Boehm MF, Fritz LC, Burrows FJ. A high-affinity conformation of Hsp90 confers tumour selectivity on Hsp90 inhibitors. Nature. 2003;425:407-410. [PubMed] [DOI] |
| 8. | Paduano F, Villa R, Pennati M, Folini M, Binda M, Daidone MG, Zaffaroni N. Silencing of survivin gene by small interfering RNAs produces supra-additive growth suppression in combination with 17-allylamino-17-demethoxygeldanamycin in human prostate cancer cells. Mol Cancer Ther. 2006;5:179-186. [PubMed] [DOI] |
| 9. | Tsutsumi S, Neckers L. Extracellular heat shock protein 90: a role for a molecular chaperone in cell motility and cancer metastasis. Cancer Sci. 2007;98:1536-1539. [PubMed] [DOI] |
| 11. | Schwock J, Pham NA, Cao MP, Hedley DW. Efficacy of Hsp90 inhibition for induction of apoptosis and inhibition of growth in cervical carcinoma cells in vitro and in vivo. Cancer Chemother Pharmacol. 2008;61:669-681. [PubMed] [DOI] |