修回日期: 2008-09-03
接受日期: 2008-09-17
在线出版日期: 2008-10-18
目的: 分析益气活血法干预慢性萎缩性胃炎(chronic atrophic gastritis, CAG)癌前病变的差异表达基因, 从基因水平探讨益气活血法防治大鼠CAG癌前病变的药理机制
方法: 应用大鼠12K基因表达谱cDNA芯片, 检测益气活血法干预后CAG癌前病变大鼠基因的差异表达变化, 筛选出差异表达基因, 建立益气活血法干预后CAG癌前病变大鼠差异基因表达谱并进行生物信息学分析. 并运用Real-time荧光定量PCR鉴定HSP70基因表达.
结果: 共筛选出差异表达基因205个, 其中上调基因为101条, 下调基因104条, 共同构成了益气活血法干预大鼠CAG癌前病变的差异表达基因谱. 与凋亡相关的4个基因为heat shock 70 kDa protein 1a, growth arrest and DNA-damage-inducible, complement component 9和albumin. Real-time荧光定量PCR鉴定结果表明益气活血法干预治疗后HSP70基因表达上调, 与芯片检测结果一致.
结论: 益气活血法对大鼠CAG癌前病变的基因表达的影响涉及到多种生物学过程信号传递及基因调控的改变, 从分子生物学角度说明中医益气活法对CAG癌前病变的影响是一个复杂的病理生理过程.
引文著录: 李军祥, 张玉禄, 朱陵群, 赵宁宁. 益气活血法对大鼠萎缩性胃炎癌前病变差异基因表达谱的影响. 世界华人消化杂志 2008; 16(29): 3261-3268
Revised: September 3, 2008
Accepted: September 17, 2008
Published online: October 18, 2008
AIM: To investigate aberrant gene expression of chronic atrophic gastritis (CAG) precancerous lesions in rats receoiving Qi-replenishing and blood-activating treatment and to analyze its pharmaco-mechanism at genetic level.
METHODS: The model of precancerous lesion of CAG rats induced by spring insertion and hot paste was established. One step method for extraction of total RNA of rat stomach tissues after administration of Qi-replenishing and blood-activating medicinals and the stomach tissue of the model group was used. After reverse transcription and fluorescent labeling by Cy3, Cy5, we got two groups of rat stomach cDNA probes and then hybridized with the cDNA gene expression profiles microarray hybridization. The result was scanned by the laser scanner and processed by software for image analysis, standardization, the ratio of value analysis, cluster analysis and gene ontology analysis. Results of gene array were verified by Real-time PCR.
RESULTS: Screening showed 205 differentially expressed genes, of which, there were 101 up-regulated expression genes and 104 down-regulated expression genes. They composed the gene expression profiles for precancerous lesion of precancerous lesions of CAG in rats treated with Qi-replenishing and blood-activating medicinals. There were four genes related to apoptosis including heat shock 70 kDa protein 1a, growth arrest and dna-damage-inducible, complement component 9 and albumin. The Real-time PCR confirmed expression of HSP70 up-regulated in rats treated with Qi-replenishing and blood-activating medicinals, which were consistent with results using microarray technology.
CONCLUSION: These differentially expressed genes involved different biological processes and gene regulations. Further analysis of the differentially expressed genes might help reveal the pharmaco-mechanism of Qi-replenishing and blood-activating medicinals at genetic level.
- Citation: Li JX, Zhang YL, Zhu LQ, Zhao NN. Effect of Qi-replenishing and blood-activating treatment on aberrant gene expression profile in the precancerous lesion of CAG in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(29): 3261-3268
- URL: https://www.wjgnet.com/1009-3079/full/v16/i29/3261.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i29.3261
胃性萎缩性胃炎(chronic atrophic gastritis, CAG)是消化系统常见病、疑难病之一, 在CAG基础上伴发的肠上皮化生(intestinal metaplasia, IM)和异型增生(dispalsia, Dys)是胃癌前期病变[1]. 临床上中医运用益气活血法治疗本病取得了较好的效果. 本研究复制大鼠CAG癌前病变模型, 研究益气活血法对大鼠萎缩性胃炎癌前病变基因表达的影响, 从基因水平探讨益气活血法防治萎缩性胃炎癌前病变的作用机制.
♂Wister大鼠, 体质量180-220 g, 清洁级, 由北京维通利华实验动物技术有限公司提供, 实验动物许可证编号: SCXX(京)2002-0003. 北京中医药大学东直门医院中药药理学实验室Ⅱ级动物实验室, 许可证号: SYXK 11-00-0029. 微量天平(HANGPING JA1003)为上海天平仪器厂产品. Agilent 2100 Bioanalyzer: Agilent: 型号: G2938B; Nano Drop Spectrophotometer: 型号ND-1000; 酶标仪: 型号KC4; MJ PCR仪: 型号PTC-100; UVP杂交炉: 型号HB-1000; Agilent扫描仪: 型号G2655AA; Line-gene荧光定量PCR检测系统为杭州博日科技有限公司产品; 台式高速冷冻离心机TGL-16(湘仪); DYY-7C型电泳仪 与DYCP-31D型水平式电泳槽为北京六一仪器厂产品; 紫外分析仪为北京宾达英创科技有限公司产品; 紫外分光光度计UV-2000为尤尼柯(上海)仪器有限公司产品.
1.2.1 大鼠CAG癌前期病变模型的建立: 大鼠在相同条件下分笼饲养, 每笼4只, 常规喂养标准颗粒饲料, 自由饮用水. 按赵凤志 et al[2]的方法, 将♂Wistar大鼠(体质量230-260 g)禁食不禁水16 h后, 以10 g/L戊巴比妥ip麻醉(5 mL/kg), 称体质量, 固定大鼠四肢, 在无菌条件下开腹, 暴露胃, 在胃前壁距幽门环0.2 cm无或少血管处切一小口, 将一长约2 cm, 直径约0.2-0.3 cm的金属弹簧前1/3插过其幽门环进入十二指肠, 用缝线将弹簧两端及中央固定, 按手术常规逐层缝合胃及腹壁切口. 手术后禁食不禁水24 h, 恢复性饲养1 wk后, 开始每周每只大鼠ig 60-70℃高盐热淀粉糊2次, 每次2 mL, 连续24 wk. 并于造模结束前随机抽取模型组大鼠8只进行胃黏膜病变理形态学检查, 其中7只出现轻-中度不典型增生, 确认造模成功. 造模结束后, 将模型大鼠随机分为益气活血治疗组[予三七粉0.7 g/(kg·d)加黄芪浸膏3.5 g/(kg·d)]和自然恢复组(予双蒸水灌胃), 两组分别每天上午ig 1次, 连续12 wk,于给药第12周末处死实验大鼠, 进行病理切片.
1.2.2 组织取材: ig 12 wk, 采用乙醚麻醉法, 剖腹取胃, 在胃窦部阳性病变部位取材, 益气活血组取材3例, 正常对照组3例, 自然恢复组1例, 取材后标本迅速液氮冻存备用.
1.2.3 大鼠表达谱芯片: 大鼠12K基因表达谱cDNA芯片, 覆盖11 060种基因, 其中Unigene 10 695条, 已知基因5657条, EST4716条.
1.2.4 探针制备: 按照TRIzol试剂说明, 采用异硫氰酸胍一步法抽提所取胃黏膜组织总RNA, 所提总RNA使用Agilent 2100进行样品RNA检测, 确定其完整性. 用Oligotex mRNA Midi Kit(Qiagen公司)纯化mRNA. 每1份探针取4 μg mRNA, 逆转录标记cDNA探针并纯化探针. 模型组来源的mRNA由Cy3-dUTP标记制成探针, 益气活血组来源的mRNA由Cy5-dUTP标记制成探针.
1.2.5 芯片杂交(cDNA芯片杂交): 取出经定量的Cy3和Cy5标记的探针, 取Cy3探针90 pmol, Cy5探针60 pmol, 浓缩至7 μL, 然后转至0.2 mL PCR管内. 将溶解的探针置于PCR仪中94℃变性3 min左右, 取出加入Cot-1 DNA 1 μg , A80 1 μg放回PCR仪中, 70℃保温30 min. 反应结束后, 加入9 μL 4×杂交缓冲液和18 μL甲酰胺, 总体积达到36 μL, 充分混匀. 取杂交液滴加于芯片上, 盖上盖玻片. 将杂交芯片水平放入加有1×PBS的杂交盒, 置42℃杂交箱中避光杂交16-18 h.
1.2.6 芯片洗涤: 杂交结束后, 用镊子取出片子, 浸入经过50℃预热的洗液Ⅰ中, 上下抽动, 使盖玻片从芯片上自然脱离, 然后在50℃洗液Ⅰ中洗涤10 min. 从洗液Ⅰ中取出片子, 浸入50℃预热的洗液Ⅱ中, 洗涤10 min, 然后再转入新的洗液Ⅱ中, 重复2次. 从洗液Ⅱ中取出片子, 室温洗液Ⅲ洗涤5 min, 重复2次. 取出芯片于去离子水中室温洗涤2 min. 用镊子小心将片子取出, 迅速转入50 mL空离心管中, 1500 r/min离心5 min, 干片. 最后将芯片取出放入芯片盒, 避光保存于干燥器中.
1.2.7 荧光扫描、数据处理和统计学分析: 将玻片放入扫描片夹中, Agilent扫描仪扫描芯片, 获得荧光图像, 提取杂交信号, 以管家基因为内参照对Cy3和Cy5的原始提取信号进行均衡和修正. ImaGene3.0软件分析Cy3和Cy5两种荧光信号的强度和比值, 以芯片中密度值5×108以上的数据点为有效数据, 数据导入分析软件Genespring, 用Background subtraction based on negative controls和per spot and per chip Intensity dependent normalization(non-linear or LOWESS normalization)方法标准化, 计算得到ratio值(两种荧光Cy5与Cy3的比值); ratio值大于2或小于0.5的数据点为存在显著性差异表达的基因点, 以此为筛选标准, 筛选出差异表达基因.
1.2.8 生物信息学分析: 利用美国NIH开发的DAVID系统对差异表达基因进行基因功能富集分析[3].
1.2.9 Real-time荧光定量PCR鉴定HSP70基因表达: 引物设计采用Primer premier 5及oligo 6等生物软件, 引物序列如下: NM_031971 Rattus HSP70 192 bp, 上游: 5-gctgatcttgcccttgagac-3; 下游: 5-caagatcaccatcaccaacg-3. RT制备cDNA溶液: Microtube管中配制下列模板RNA/引物混合液, 全量<15 μL, 模板RNA和Oligo(dT)12-18 Primer(50 μmol/L)的使用量分别为3, 2.5 μL; 70℃保温5 min后迅速在冰上急冷2 min以上; 离心数秒钟使模板RNA/引物的变性溶液聚集于Microtube管底部; 在上述Microtube管中配制下列反转录反应液: 5 μL 5×M-MLV Buffer, 1.25 μL dNTP Mixture(各10 mmol/L), 25 U RNase Inhibitor(40 U/μL), 200 U, M-MLV(200 U/μL), up to 25 μL RNase free dH2O, 42℃保温1 h; 70℃保温15 min后冰上冷却, 得到cDNA溶液. Real-time PCR: Real-time PCR反应体系: 25 μL 2XSYBR Mix(with 4 mmol/L Mg2+), 1 μL PCR Forward Primer(10 μmol/L), 1 μL PCR Reverse Primer (10 μmol/L), 0.3 μL Taq DNA Polymerase, 20.7 μL ddH2O, 2 μL cDNA. Real-time PCR反应条件见表1.
| 反应步骤 | t(℃) | t(S) | 循环 | 荧光信号收集 | |
| 预孵育 | 95 | 120 | 1 | 无 | |
| 95 | 20 | ||||
| 扩增 | 58 | 25 | 45 | 在延伸阶段结束时 | |
| 72 | 30 | ||||
| 溶解 | 65 | 0 | 1 | 在温度缓慢升高过程中 | |
| 曲线 | 95 | 20 | |||
益气活血组大鼠体质量为671.25±36.26 g(n = 3), 正常对照组体质量为661.00±37.29 g(n = 3), 二者相比无显著性差异. 自然恢复组大鼠体质量为603 g(n = 1).
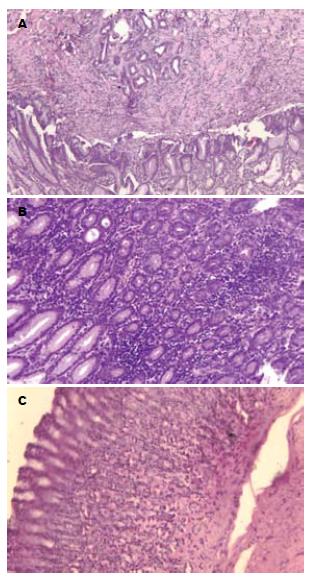
自然恢复组,重度增生: 上皮细胞或呈立方形、不定形, 细胞核明显增大, 大小、形状不一, 排列紊乱. 腺管结构明显紊乱, 形状大小和排列极不规则. 益气活血组,轻度增生: 细胞核稍大, 深染, 呈圆形、卵圆形或柱形, 排列较密集, 位于细胞基底. 腺管轻度增生, 管腔稍不规则, 排列稍紊乱和疏密不匀. 正常组, 细胞核大小均一, 疏密均匀, 腺管管腔规则, 排列整齐(图1).
芯样品RNA电泳检测, 使用Agilent 2100进行样品质检(样品编号同上). 该批样品抽提的RNA量足够; 电泳中, 条带28S>18S, 质检合格, 可以进行芯片实验(表2, 图2).
| 分组 | 样品编号 | 总RNA浓度 | 纯化后RNA浓度 |
| 益气活血组 | 1 | 1.88 | 1.78 |
| 2 | 2.94 | 1.33 | |
| 3 | 2.65 | 1.50 | |
| 空白对照组 | 10 | 3.36 | 1.26 |
| 11 | 3.36 | 1.40 | |
| 12 | 3.26 | 1.63 | |
| 自然恢复组 | 13 | 2.56 | 1.24 |
2.4.1 聚类分析: 利用stanford大学Eisen Lab开发的Cluster软件(http://rana.lbl.gov/)进行分层聚类, 结果表明益气活血组的基因表达谱模式与自然恢复组反差最大, 提示益气活血组的的药物疗效可能较好, 聚类的结果表明热休克蛋白70(heat shock 70 kDa protein, HSP70)及其相邻的几个基因是自然恢复组和益气活血组反差最大的区域(图中蓝圈内所示), 提示这几个基因可能是是益气活血法作用机制较明确的靶标(图3).
2.4.2 差异基因列表: 按照设定的数据筛选标准: Ratio≥2或≤0.5, P<0.05, 益气活血组三张芯片筛选出的差异基因数目见表3. 益气活血组三张芯片同时满足Ratio≥2, P<0.05, 或Ratio≤0.5, P<0.05, 筛选出差异表达基因205个, 其中上调基因为101条, 下调基因104条, 将上调基因按RATIO1值降序排列前30位及下调基因按RATIO值升序排列前30位列出见表4.
| 芯片编号 | 55006 | 55007 | 55008 |
| 上调基因数 | 566 | 346 | 452 |
| 下调基因数 | 706 | 640 | 519 |
| 上调基因 | 下调基因 | ||||||
| GenBank | RATIO1 | RATIO2 | RATIO3 | GenBank | RATIO1 | RATIO2 | RATIO3 |
| NM_012564 | 99.01 | 44.64 | 42.37 | NM_031821 | 0.25 | 0.25 | 0.32 |
| NM_012657 | 44.25 | 38.61 | 41.84 | BI296915 | 0.23 | 0.32 | 0.29 |
| NM_145779 | 34.25 | 21.14 | 25.06 | XM_149281 | 0.23 | 0.23 | 0.39 |
| NM_012898 | 25.00 | 23.92 | 22.47 | NM_133404 | 0.23 | 0.27 | 0.49 |
| NM_134326 | 24.15 | 19.57 | 21.10 | BE095796 | 0.22 | 0.32 | 0.27 |
| NM_012582 | 22.17 | 15.43 | 14.16 | NM_031320 | 0.21 | 0.32 | 0.24 |
| NM_013112 | 19.65 | 8.77 | 15.90 | BC017596 | 0.21 | 0.15 | 0.30 |
| NM_031531 | 19.61 | 8.40 | 11.72 | XM_134666 | 0.21 | 0.29 | 0.12 |
| NM_019156 | 19.46 | 8.20 | 10.13 | NM_012552 | 0.21 | 0.23 | 0.18 |
| NM_012901 | 17.83 | 8.13 | 7.87 | BF396698 | 0.20 | 0.28 | 0.29 |
| NM_053469 | 17.70 | 6.85 | 2.29 | AI144892 | 0.20 | 0.18 | 0.21 |
| NM_019184 | 16.03 | 9.90 | 11.55 | BF544595 | 0.20 | 0.34 | 0.07 |
| BQ191104 | 13.28 | 7.14 | 10.44 | NM_012623 | 0.19 | 0.17 | 0.11 |
| NM_080576 | 13.18 | 6.41 | 6.90 | BE118680 | 0.19 | 0.14 | 0.22 |
| XM_342639 | 12.71 | 8.06 | 8.13 | M92076 | 0.18 | 0.15 | 0.22 |
| NM_017233 | 12.38 | 5.56 | 6.99 | NM_023970 | 0.17 | 0.15 | 0.17 |
| NM_053768 | 12.02 | 7.35 | 13.00 | XM_041991 | 0.17 | 0.31 | 0.28 |
| BQ191104 | 11.86 | 6.29 | 10.28 | BE099720 | 0.14 | 0.33 | 0.22 |
| NM_017055 | 11.81 | 5.18 | 7.19 | NM_012847 | 0.14 | 0.19 | 0.13 |
| NM_031971 | 10.36 | 11.43 | 2.75 | NM_013034 | 0.10 | 0.18 | 0.36 |
| NM_031543 | 10.24 | 8.47 | 8.93 | NM_152936 | 0.08 | 0.06 | 0.36 |
| NM_020071 | 10.08 | 8.26 | 6.54 | NM_016997 | 0.08 | 0.07 | 0.19 |
| NM_017024 | 9.62 | 4.26 | 6.80 | NM_016997 | 0.08 | 0.06 | 0.13 |
| NM_175837 | 8.55 | 2.93 | 5.92 | NM_012635 | 0.05 | 0.06 | 0.13 |
| NM_030832 | 8.40 | 4.29 | 7.46 | NM_012553 | 0.04 | 0.06 | 0.09 |
| NM_053288 | 8.26 | 5.18 | 4.03 | NM_139086 | 0.02 | 0.02 | 0.06 |
| NM_053617 | 8.26 | 4.88 | 7.04 | NM_173127 | 0.02 | 0.02 | 0.04 |
| NM_030850 | 8.20 | 3.89 | 7.25 | NM_054009 | 0.02 | 0.02 | 0.04 |
| XM_129207 | 8.20 | 3.33 | 2.42 | NM_031502 | 0.02 | 0.02 | 0.03 |
| NM_057146 | 7.81 | 8.70 | 6.85 | NM_013161 | 0.01 | 0.02 | 0.02 |
2.4.3 Gene Ontology(GO)富集分析: 差异表达基因GO分析结果表明, 益气活血法对大鼠CAG癌前病变的基因表达的影响涉及到多种生物学过程信号传递及基因调控的改变, 包括细胞信号和传递类基因、细胞骨架蛋白基因、细胞外基质类基因、细胞周期相关基因、癌基因和抑癌基因、细胞凋亡相关基因以及细胞受体和细胞代谢相关基因等, 从细胞凋亡角度发现4个上调基因可能与益气活血法作用机制密切相关, 其中HSP70基因前期研究结果表明在CAG癌前病变大鼠模型中表达下调, 经活血化瘀法治疗后, HSP70基因表达上调, 因此推测HSP70基因可能是益气活血法治疗大鼠CAG癌前病变较明确的靶基因之一. GO分析结果与凋亡相关的4个基因见表5; 与凋亡相关的4个基因在正常对照组的芯片检测中RATIO值见表6. 表6数据说明, 益气活血组芯片检测结果中表达上调的4个基因在正常对照组芯片检测结果中RATIO值在大部分在0.5-1.5之间, 基因表达无明显上调或下调, 其中18748号芯片NM_057146基因无表达, 说明与正常对照组比较, 益气活血法对4个凋亡相关基因表达有明显影响.
| GeneBank ID | gene title |
| NM_031971 | heat shock 70 kd protein 1a |
| AI599423 | growth arrest and dna-damage-inducible |
| NM_057146 | complement component 9 |
| NM_134326 | albumin |
| GenBank | RATIO1(10744) | RATIO2(10745) | RATIO3(18748) |
| NM_031971 | 0.92 | 1.08 | 0.98 |
| AI599423 | 1.00 | 0.94 | 0.81 |
| NM_057146 | 0.64 | 0.61 | - |
| NM_134326 | 1.13 | 0.96 | 0.89 |
2.4.4 Real-time PCR验证结果: 所有样本在相同条件下对内参基因和目的基因进行Real-time PCR验证, 得到CT值, 应用2-ΔCT公式对目的基因相对表达量进行计算(表7). 结果表明, HSP70基因相对表达量在1号样本(0.76)、2号样本(0.81)和3号样本(0.68)比13号样本(0.46)相对表达量都要高, 分别为13号样本的1.67倍、1.77倍和1.48倍, 说明经过益气活血法干预治疗后HSP70基因表达增加, 与芯片检测结果一致.
| 编号 | actin | 平均值 | HSP70 | 平均值 | ΔCT | 2-ΔCT |
| 1 | 19.04 | 19 | 22.79 | 22.71 | 3.71 | 0.76 |
| 1 | 18.96 | 22.63 | ||||
| 2 | 18.83 | 19.1 | 23.05 | 22.73 | 3.63 | 0.81 |
| 2 | 19.37 | 22.40 | ||||
| 3 | 20.97 | 21.015 | 24.93 | 24.90 | 3.88 | 0.68 |
| 3 | 21.06 | 24.86 | ||||
| 13 | 24.52 | 24.41 | 28.89 | 28.86 | 4.45 | 0.46 |
| 13 | 24.30 | 28.83 |
基因芯片技术具有高质量、高效率、高准确性特点, 一次可同步监测数以千计的基因的变化, 与传统技术相比, 具有无比的优越性[4]. 良好的基因芯片实验设计是充分发挥基因芯片技术优势的前提, 基因芯片技术的生物学重复是减少或消除误差的常用手段[5]. 近年来发展起来的Real-time PCR技术具有特异性强、灵敏度高、重复性好、定量准确、速度快、全封闭反应等优点, 是分子生物学研究中用于鉴定基因的重要工具. 本研究运用基因芯片技术检测益气活血法对大鼠萎缩性胃炎癌前病变基因表达的影响, 从基因水平探讨益气活血法防治萎缩性胃炎癌前病变的作用机制, 并通过Real-time PCR验证基因芯片的结果.
基因芯片结果显示, 益气活血法对CAG癌前病变大鼠胃黏膜基因表达有明显影响, 综合分析三张芯片生物学重复结果, 共筛选出差异表达基因205个, 其中上调基因为101条, 下调基因104条, 共同构成了益气活血法影响大鼠CAG癌前病变的差异表达基因谱. 差异表达基因的功能分析结果表明, 益气活血法对大鼠CAG癌前病变的基因表达的影响涉及到多种生物学过程信号传递及基因调控的改变, 包括细胞信号和传递类基因、细胞骨架蛋白基因、细胞外基质类基因、细胞周期相关基因、癌基因和抑癌基因、细胞凋亡相关基因以及细胞受体和细胞代谢相关基因等, 从基因水平说明中医益气活血法对CAG癌前病变的影响是一个复杂的过程.
本实验造模完成时, 基因芯片结果显示, 模型大鼠HSP70基因表达较正常大鼠下调; 治疗完成时, 基因芯片结果显示, 益气活血组CAG癌前病变大鼠HSP70基因显著上调. 基因聚类分析和富集分析结果提示HSP70基因可能是益气活血法防治大鼠CAG癌前病变的靶基因之一.
HSP70对胃黏膜亦具有保护作用, 并能促进黏膜的损伤修复[6]. 正常胃黏膜上皮完整性的维持有赖于细胞增生和凋亡的动态平衡, 而凋亡调控基因蛋白的异常会影响这一动态平衡[7], 导致胃黏膜细胞凋亡和增殖的异常[8]. HSP70是重要的凋亡凋控因子. Liu et al发现难辨梭状芽孢杆菌毒素A诱导肠黏膜上皮细胞凋亡; 上调肠黏膜细胞内源HSP70水平, 能保护细胞线粒体功能, 抑制凋亡通路的激活[9]. 细胞表面的Fas/Apo-1受体和他们的配体相结合是诱导凋亡的重要原因, HSP-70的表达可能提供一种能够包裹自身和外来抗原的新的免疫物质,从而使细胞避免凋亡[10-11]. 研究发现, 细胞内HSP70水平的增高可通过阻断信号通路, 抑制应激诱导的蛋白激酶38和JNK(junn-terminalkinase)激活, 从而减少细胞凋亡. 线粒体可能是细胞选择死亡(炎症扩大)或凋亡(炎症受限)的关键细胞器, HSP70对线粒体的保护作用可能是HSP70的重要的抗凋亡机制[12]. 在金属弹簧、高盐热糊及反流的胆汁和十二指肠液等致病因素的刺激下, 大鼠胃黏膜从正常胃黏膜细胞→浅表性胃炎→萎缩性胃炎→肠上皮化生→异型性增生, 其凋亡率逐渐升高[13]. 芯片结果表明益气活血法干预治疗后HSP70基因上调, 且与Real-time PCR基因鉴定结果一致, HSP70基因表达上调抑制细胞凋亡及其通路的激活可能是其治疗CAG癌前病变的机制之一.
CAG癌前病变大鼠胃黏膜HSP70基因表达较正常大鼠下调, 分析其原因, 可能有以下几点: (1)与胃黏膜营养供应不良有关: CAG癌前病变胃黏膜血流减少[14]或局部胃黏膜营养供应失调, 蛋白营养不良能削弱HSP70转录调控因子HSF-1活性, 抑制HSP70 mRNA合成[15]; (2)与表达HSP70的细胞减少有关: 长期的黏膜损害导致胃黏膜细胞死亡, 腺体丢失. HSP70表达水平和黏膜损伤程度呈负相关[16-17].
CAG癌前病变属中医"胃痞"范畴, 其病位在胃, 与肝脾关系密切, 病性属虚实相兼, 病程绵长, 病情迁延反复难愈, 胃为多气多血之腑, 气行则血行, 气虚则血瘀, 日久则影响气血运行形成气虚血瘀证, 临床上中医运用益气活血法治疗CAG癌前病变取得了较好的疗效, 能够改善胃黏膜血液循环, 促进胃黏膜病变的修复, 这种药理作用可能是HSP70基因上调产生的效应之一, HSP70基因上调在益气活血法防治大鼠CAG癌前病变作用机制中可能是一个重要的环节, 但HSP70基因上调对信息传导通路和相关基因的调控等方面的机制有待进一步深入研究.
在国家"八五"攻关课题等关于中医药防治萎缩性胃炎癌前病变的研究中, 从临床和实验研究两方面证明活血化瘀法防治萎缩性胃炎癌前病变取得了较好的效果, 但其作用机制尚不清楚, 本课题的重点是从基因水平进一步探讨活血法防治萎缩性胃炎癌前期病变的作用机制.
管冬元, 副教授, 上海中医药大学基础医学院实验中医学教研室
近年来活血化瘀法防治萎缩性胃炎癌前病变的机制探讨是目前该领域的研究热点之一, 已深入到基因水平,但活血化瘀法的作用是多方面的, 多层次的, 从基因信号传导通路方面研究活血化瘀法防治萎缩性胃炎癌前病变的作用机制是下一步的研究重点.
近年来国内学者在防治萎缩性胃炎及其癌前病变的研究中发现HSP70基因的表达异常, 证实HSP70基因表达对胃黏膜有保护作用, 并能促进黏膜的损伤修复.
本文运用基因芯片技术研究活血化瘀法的作用机制, 筛选出差异表达基因, 从基因功能角度分析, HSP70基因是活血化瘀法防治本病的目的基因之一, 为进一步从基因信号传导通路上揭示其作用机制提供了有益的实验基础.
HSP70基因表达异常在萎缩性胃炎癌前病变的发病机制中的作用逐渐受到重视, 从活血化瘀法影响HSP70基因表达的角度深入研究其作用机制, 为临床新药研发积累有益资料.
本文应用基因芯片探讨了益气活血法中药对CAG癌前病变的基因调控情况, 其研究方法新颖, 研究目标明确, 具有一定的学术价值.
编辑: 李军亮 电编:郭海丽
| 2. | 赵 凤志, 鲁 香凤, 戴 欣, 卜 益民, 张 旭晨, 石 雪迎, 方 杰, 董 建华, 田 德禄, 马 庆山. 三种方剂水煎液对实验性慢性胃炎大鼠胃粘膜组织病理学变化及胃液pH、胆酸含量的影响. 中国中药杂志. 1995;20:488-492. |
| 3. | Dennis G Jr, Sherman BT, Hosack DA, Yang J, Gao W, Lane HC, Lempicki RA. DAVID: Database for Annotation, Visualization, and Integrated Discovery. Genome Biol. 2003;4:P3. [PubMed] [DOI] |
| 4. | 徐 俊荣, 崔 大祥, 张 沥, 张 玲霞, 贾 长河, 张 宁霞, 江 梅, 曹 广周. 基因芯片法筛选萎缩性胃炎相关的差异表达基因. 世界华人消化杂志. 2003;11:47-50. [DOI] |
| 6. | Odashima M, Otaka M, Matsuhashi T, Jin M, Horikawa Y, Ohba R, Itoh H, Watanabe S. Mechanical strain stress suppresses expression of HSP70 and wound restoration in gastric mucosal cells. Dig Dis Sci. 2007;52:3087-3091. [PubMed] [DOI] |
| 7. | Xia HH, Talley NJ. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am J Gastroenterol. 2001;96:16-26. [PubMed] [DOI] |
| 8. | Nardone G, Staibano S, Rocco A, Mezza E, D'armiento FP, Insabato L, Coppola A, Salvatore G, Lucariello A, Figura N. Effect of Helicobacter pylori infection and its eradication on cell proliferation, DNA status, and oncogene expression in patients with chronic gastritis. Gut. 1999;44:789-799. [PubMed] |
| 9. | Liu TS, Musch MW, Sugi K, Walsh-Reitz MM, Ropeleski MJ, Hendrickson BA, Pothoulakis C, Lamont JT, Chang EB. Protective role of HSP72 against Clostridium difficile toxin A-induced intestinal epithelial cell dysfunction. Am J Physiol Cell Physiol. 2003;284:C1073-C1082. [PubMed] |
| 10. | Beere HM, Green DR. Stress management - heat shock protein-70 and the regulation of apoptosis. Trends Cell Biol. 2001;11:6-10. [PubMed] [DOI] |
| 11. | Didelot C, Schmitt E, Brunet M, Maingret L, Parcellier A, Garrido C. Heat shock proteins: endogenous modulators of apoptotic cell death. Handb Exp Pharmacol. 2006;171-198. [PubMed] |
| 12. | Yenari MA, Liu J, Zheng Z, Vexler ZS, Lee JE, Giffard RG. Antiapoptotic and anti-inflammatory mechanisms of heat-shock protein protection. Ann N Y Acad Sci. 2005;1053:74-83. [PubMed] [DOI] |
| 13. | 李 子俊, 林 秋雄, 王 启仪, 林 华欢, 骆 新兰, 詹 德娟. 胃癌及癌前病变细胞增殖和凋亡与bc12/bax表达关系的研究. 现代消化及介人诊疗杂志. 2000;5:14-16. |
| 14. | Takaya Y, Tsunoda S, Itoh M, Oshima H. [Studies on analysis of gastric mucosal blood flow by electronic endoscopic image. Especially on atrophic gastritis]. Nippon Ika Daigaku Zasshi. 1994;61:295-305. [PubMed] |
| 15. | Kawai T, Teshima S, Kusumoto K, Kawahara T, Kondo K, Kishi K, Rokutan K. A non-toxic heat shock protein 70 inducer, geranyl-geranyl-acetone, restores the heat shock response in gastric mucosa of protein-malnourished rats. J Lab Clin Med. 2000;136:138-148. [PubMed] [DOI] |
| 16. | Guo JS, Cho CH, Wang JY, Koo MW. Expression and immunolocalization of heat shock proteins in the healing of gastric ulcers in rats. Scand J Gastroenterol. 2002;37:17-22. [PubMed] [DOI] |
| 17. | Rokutan K, Miyoshi M, Teshima S, Kawai T, Kawahara T, Kishi K. Phenylarsine oxide inhibits heat shock protein 70 induction in cultured guinea pig gastric mucosal cells. Am J Physiol Cell Physiol. 2000;279:C1506-C1515. [PubMed] |