修回日期: 2008-09-10
接受日期: 2008-09-17
在线出版日期: 2008-10-08
目的: 通过基因芯片技术进一步研究TGFβ1调控BxPC-3胰腺癌细胞周期的机制.
方法: 采用含有24个细胞周期相关基因位点的cDNA微阵列基因芯片, 观察2.0 μg/L的TGFβ1干预BxPC-3细胞72 h后细胞周期相关基因的表达变化, 以相同培养的未加干预的BxPC-3细胞为空白对照.
结果: 加入2.0 μg/L TGFβ1干预前后, BxPC-3胰腺癌细胞系细胞周期相关基因表达有明显差异. 表达增高基因3条, 表达降低基因17条, 基本不变有3条. 仅有1条基因位点因芯片上出现负点影响分析. TGF-β1干预后, 有多个G1期向S期转换的基因的mRNA表达发生下调, 如GSPT1、ASK、CDK4、SKP2和Cyclin C. 同时有多个转录因子的表达下调, 如E2F3和E2F5. 另外, 与丝氨酸、苏氨酸磷酸化有关的激酶也有下调, 如TRAD.
结论: 组织芯片显示TGFβ1可诱导BxPC-3细胞多种细胞周期相关基因表达变化, 提示TGFβ介导的生长抑制效应中Smad4依赖与非Smad4依赖信号通路存在串话.
引文著录: 钟良, 陈坚, 蒋义斌, 孙大裕. TGFβ1对BxPC-3胰腺癌细胞周期基因表达的影响. 世界华人消化杂志 2008; 16(28): 3225-3229
Revised: September 10, 2008
Accepted: September 17, 2008
Published online: October 8, 2008
AIM: To further investigate the mechanism underlying the cell cycle-associated gene expression regulated by exogeneous TGFβ1 in BxPC-3 pancreatic cancer cells.
METHODS: Alterations of 24 cell cycle-associated genes were determined using a specially designed gene chip in BxPC-3 cells treated with 2 μg/L TGFβ1 for 72 h. Those which were not interfered were taken as controls.
RESULTS: After the intervention of 2.0 μg/L TGFβ1, of the 24 genes, three genes were found unchanged, 3 genes (namely, p27KIP1, DMTF1 and TIEG) were up-regulated, 17 genes were down-regulated and only one was deleted for characterization due to an experimental error. Many a gene was associated with the G1/S cell cycle transition (e.g., GSPT1, ASK, CDK4, SKP2, cyclin C), some of them were transcription factors (e.g., E2F3 and E2F5), and TRAD was a serine/threonine kinase with Dbl- and pleckstrin homology domains.
CONCLUSION: Tissue microarray analysis revealed multiple alterations of the cell cycle-associated genes that were regulated by TGFβ1. This finding indicates the existence of cross-talking between the Smad-dependent and Smad-independent pathways of TGFβ1, which may mediate the growth-inhibitory effect of TGFβ1 in pancreatic carcinoma.
- Citation: Zhong L, Chen J, Jiang YB, Sun DY. Effect of transforming growth factor β1 on cell cycle-associated genes in BxPC-3. Shijie Huaren Xiaohua Zazhi 2008; 16(28): 3225-3229
- URL: https://www.wjgnet.com/1009-3079/full/v16/i28/3225.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i28.3225
本课题组的先期研究已经证实, 外源性TGFβ1(2 μg/L)对BxPC-3胰腺癌细胞株的生长有一定抑制作用, 机制与下调CyclinD1的表达, 诱导细胞周期阻滞在G1后期有关[1]. 但胰腺癌又存在着复杂的信号通路的突变以逃逸TGFβ的生长抑制效应并不断恶性演进[2]. 本研究拟采用含有24个细胞周期相关基因位点的cDNA微阵列基因芯片, 进一步探讨TGFβ1对BxPC-3胰腺癌细胞周期调控的机制.
BG600点样仪(Biorobotics公司)、FLA 3000扫描仪(Fujifilm公司)、BAS-MS 2340磷屏(Fujifilm公司)、crosslinker紫外交联仪(UVP公司)、Robbin 1000杂交炉(Robbin公司). 含有24个细胞周期相关基因的多点cDNA微阵列基因芯片由中国科学院上海细胞生物学研究所提供. 胰腺癌细胞BxPC-3(原发癌)购自中国科学院上海细胞生物研究所. 以同等培养条件下, 不加TGFβ1干预组细胞为对照组, 加2 μg/L的TGFβ1干预72 h的BxPC-3细胞为实验组. 比较两组细胞周期基因表达谱的差异.
1.2.1 多点微列阵的构建: 多点cDNA阵列中所含的24个细胞周期相关基因克隆由中国科学院上海细胞生物学研究所提供. 所有cDNA克隆均在100 μL体系中扩增获得并经凝胶电泳检测质量, cDNA克隆平均长度为1000 bp, 扩增纯化后的克隆用BioRobotics点样仪将其点制在Hybond-N尼龙膜上. 每点的体积约为100 nL, 直径0.4 mm. 每个基因克隆均为双点位. 点制后置入紫外交联仪交联. 加入TGFβ1的细胞为A组, 空白对照细胞为B组, 两组杂交均重复1次. 抽提A、B两组细胞总RNA.
1.2.2 从Total RNA中分离poly+(A)mRNA: 用Qiagen公司的Oligotex mRNA midi Kit, 严格按推荐步骤操作.
1.2.3 预杂交: 实验前将预杂交液于37 ℃温浴至无结晶; 将10 g/L的鱼精DNA(生工)煮沸3 min, 冰上骤冷(变性); 将9 cm×24 cm的本公司的膜浸泡于6×SSC中; 向每根杂交管中加入40 mL预杂交液及600 μL已变性过的10 g/L鱼精DNA; 将浸泡于6×SSC中的膜用镊子取出; 小心卷起放入杂交管中, 尽量赶走气泡; 放入杂交炉中68 ℃预杂交3 h以上.
1.2.4 逆转录RT和探针标记: 取分离得到的mRNA 0.7 μg于0.5 mL EP管中, 加入(0.5 g/L)Random Primer 3 μL, 用 Rnase-free Water定溶至 20 μL; 70 C水浴3 min后冰上骤冷, 依次加入: M-MLV 5×Buffer(promega)10 μL、Rnase inhibiltor(promega) l μL、dNTP(A-)(33 mmol/L)l μL、dATP(l.5 mmol/L)l μL、M-MLV酶(promega)2 μL、33P-dATP (NEN)(50 mmol/L)15 μL, 混匀. 37 ℃水浴30 min后, 再42 ℃水浴1.5 h; 水浴结束后加1.5 μL 0.5 mol/L的NaOH, 混匀后沸水浴5-7 min, 取出冰上冷却3 min后用离心机轻甩; 再依次加入: 0.9 μL冰醋酸、10 μL 3 mol/L醋酸钠, 混匀后再加入2.5倍体积无水乙醇150 μL, 彻底混匀后加入3 μL 20 g/L的糖原, 混匀后, 15000 g离心10 min. 取上清至另一EP管中, 测量沉淀管和上清管中的Counts. A组上清及沉淀的counts分别为70、110; B组上清及沉淀的counts分别为80、120. 向沉淀中加入40 μL Rnase-free水溶解, 放置待用.
1.2.5 杂交: 实验前将杂交液于37 ℃温浴至无结晶; 每管加入6 mL杂交液和80 μL已经变性过的10 g/L鱼精DNA, 且加入40 μL标记过的探针, 放入杂交炉中68 ℃杂交24 h. 杂交液配方: 5 g/L SDS、6×SSC.
1.2.6 洗膜: 从杂交管中取出杂交膜; 置于500 mL SolⅠ(5 g/L SDS、2×SSC)中, 37 ℃水浴摇床中轻晃5 min; 转移至500 mL SolⅡ(1 g/L SDS、2×SSC)中, 37 ℃水浴摇床振荡15 min; 转移至500 mL SolⅢ(5 g/L SDS、0.1×SSC)中, 37 ℃水浴摇床振荡1 h; 换500 mL SolⅢ(5 g/L SDS、0.1×SSC), 62 ℃水浴摇床振荡1 h; 清水漂洗数次, 用草纸略微吸干膜上的水流; 测量膜上残留counts为2, 根据counts确定压屏时间为5 d.
1.2.7 信号扫描分析: 使用FLA-3000A扫描仪进行图像分析, 数据处理使用Array Gauge软件. 根据扫描丰度值确定信号灰度定量. 为消除背景信号对实验信号的干扰, 以每个矩阵中的最小信号值做为本底, 每次扣除本底. 为消除实验操作对实验结果的影响, 使结果具有可比性, 使每张芯片的信号值总和相等以达到均一化. 在减去背景信号后, 各点位的放射强度在2以上时被认为是阳性信号.
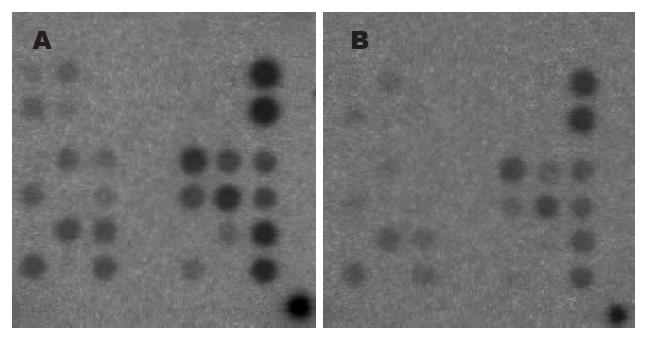
在芯片上共24个细胞周期相关基因. 加入2 μg/L TGFβ1干预前后, BxPC-3胰腺癌细胞系细胞周期相关基因表达有明显差异. 表达增高的基因3条, 表达降低的基因17条, 基本不变的有3条. 另有一条基因位点因芯片上出现负点, 考虑系实验误差, 故不予讨论(图1, 表1).
| clone ID | GenBank ID | Unigene ID | Gene Name | Symbol | TGF/control |
| HTBAVF04 | X64838 | Hs.31638 | Restin (Reed-Steinberg cell-expressed | RSN | 0.52 |
| intermediatefilament-associated protein) | |||||
| ADBBJD02 | D87953 | Hs.75789 | N-myc downstream regulated | NDRG1 | 0.53 |
| ADBDGC09 | X17644 | Hs.2707 | G1 to S phase transition 1 | GSPT1 | 0.59 |
| HTCATB06 | AB028069 | Hs.152759 | Activator of S phase kinase | ASK | 0.61 |
| CBDAOE02 | Z82244 | Hs.9482 | Target of myb1 (chicken) homolog | TOM1 | 0.63 |
| NPCACH06 | D38550 | Hs.1189 | E2F transcription factor 3 | E2F3 | 0.63 |
| 01C08 | U22376 | Hs.1334 | V-myb avian myeloblastosis viral | MYB | 0.65 |
| oncogene homolog | |||||
| GLCCHD06 | U33761 | Hs.334719 | S-phase kinase-associated protein 2 (p45) | SKP2 | 0.65 |
| CBDAOE02 | Z82244 | Hs.202833 | HMOX1 | 0.66 | |
| 0.69 | |||||
| GKCGDB03 | AA932233 | Hs.118442 | Cyclin C | CCNC | 0.69 |
| ADBDCA05 | U01828 | Hs.167 | Microtubule-associated protein 2 | MAP2 | 0.73 |
| HTBATF02 | M15796 | Hs.78996 | Proliferating cell nuclear antigen | PCNA | 0.73 |
| GLCBKA08 | AB040450 | Hs.279862 | Cdk inhibitor p21 binding protein | TOK-1 | 0.82 |
| GLCDLB01 | AB011422 | Hs.162189 | Serine/threonine kinase with Dbl- | TRAD | 0.84 |
| and pleckstrin homology domains | |||||
| ADBBXB12 | U37022 | Hs.95577 | Cyclin-dependent kinase 4 | CDK4 | 0.88 |
| ADBAJF01 | AF155651 | Hs.152663 | p21 (CDKN1A)-activated kinase 3 | PAK3 | 0.89 |
| NPCBSH06 | X76104 | Hs.153924 | Death-associated protein kinase 1 | DAPK1 | 0.90 |
| NPCAVF08 | BE738472 | Hs.2331 | E2F transcription factor 5, p130-binding | E2F5 | 0.92 |
| CBDAOE02 | Z82244 | Hs.77171 | Minichromosome maintenance deficient | MCM5 | 0.99 |
| (S. cerevisiae) 5 (cell division cycle 46) | |||||
| CBFBGB09 | S81439 | Hs.82173 | TGFB inducible early growth response | TIEG | 1.27 |
| ADBAGH06 | AF084530 | Hs.5671 | Cyclin D binding Myb-like transcription factor 1 | DMTF1 | 1.32 |
| HTCBPE01 | AY004255 | Hs.238990 | Cyclin-dependent kinase inhibitor 1B (p27, Kip1) | CDKN1B | 1.95 |
肿瘤的过度增殖与细胞周期调控因子紊乱有关, 这一观点目前已得到国内外学者的一致认同[3]. 目前认为: 在细胞周期中G1末期向S期能否顺利过渡对于推进癌细胞周期进程具有重要意义[4], 此时细胞内相关基因表达水平发生显著的变化, 为下阶段DNA复制做好准备. 在本研究中, 我们采用了胰腺癌癌细胞株BxPC-3作为研究对象, 采用中科院研制的细胞周期基因小芯片观察了2 μg/L TGF-β1干预72 h后BxPC-3细胞细胞周期基因表达谱的改变, 取得了较理想的结果.
本实验显示, TGFβ1干预后上调的细胞周期相关基因有3条: p27KIP1(cyclin-dependent kinase inhibitor 1B, CDKI 1B)、DMTF1(cyclin D binding Myb-like transcription factor 1)、TIEG(TGFB inducible early growth response). 其中上调最明显的是p27KIP1基因. p27KIP1位于染色体12p13区带, 其cDNA编码198个氨基酸残基的多肽, 分子质量27 kDa. p27的结构和功能与p21及p57有许多相似之处. p27在N端的一个60个氨基酸的片段中有40%与p21一致; 同样N端有57%的氨基酸与p57相似. p27主要通过对CDK的抑制作用, 阻断G1到S期的转换. p27主要在两个水平上起作用: 一是抑制cyclins-CDKs和H1组蛋白酶活性; 二是抑制Cyclins-CDKs复合物在Thr-160磷酸化的能力. p27对调节细胞周期、细胞的数量和大小非常重要[5]. TIEG是近年来从胰腺外分泌细胞发现的一组新颖的和Smad4相似的锌指转录因子, 包括TIEG1及TIEG2两个亚型, 可参与TGFβ的调控反应及抑制胰腺上皮细胞增殖[6]. 由于在BxPC-3中存在着TGFβ信号途径下游的Smad4/DPC4基因的纯合缺失, 故TGFβ不能诱导经典Smad4途径下游的p21waf1基因等表达, p27KIP1及TIEG转录水平的明显上调可能有一定的代偿作用[7-8], 使BxPC-3同样具有一定的对TGFβ的反应性.
DMTF1(cyclin D binding Myb-like transcription factor 1)是Wnt基因调控的下游产物. Wnt信号转导途径是调控细胞形状、运动、黏附、增殖、分化、癌变及机体发育等过程的主要途径之一[9]. 目前认为Wnt通路的组成主要包括: 细胞外因子(Wnt)、跨膜受体Frizzled(Frz)、β-连环蛋白(β-catenin) 及T细胞趋化因子(tcell factor, TCF) 等一系列蛋白. 当配体Wnt蛋白与跨膜受体结合后, 能够通过激活胞质中Dsh(dishevelled)蛋白抑制GSK3β(glycogen synthase kinase 3β)的磷酸激酶活性, 拮抗β-连环蛋白的降解, 使其在胞质中大量聚集, 并进入细胞核结合TCF/LEF家族的转录因子, 从而激活下游不同靶基因如cyclin D1、c-myc等, 呈现不同的生物学效应[10]. 另外, Wnt胞内信号途径的异常激活与人类各种癌症的产生有密切联系, 由于该信号转导途径具有如此重要的作用, 因此受到研究者越来越多的重视. DMTF1作为一个新的细胞周期相关基因, 他的激活、上调提示TGFβ信号通路与Wnt信号通路间可能存在串话.
本实验显示, TGF-β1干预后, 有多个促G1期向S期转换的基因的mRNA表达发生下调, 如GSPT1(G1 to S phase transition 1)、ASK(activator of S phase kinase)、CDK4(cyclin-dependent kinase 4)、SKP2(S-phase kinase-associated protein 2/p45)、Cyclin C. 同时有多个转录因子的表达下调, 如E2F3(E2F transcription factor 3)、E2F5(E2F transcription factor 5, p130-binding). 另外, 与丝氨酸、苏氨酸磷酸化有关的激酶也有下调, 如TRAD(serine/threonine kinase with Dbl- and pleckstrin homology domains), 但他们在TGFβ信号通路中的分子机制仍有待深入探讨.
Restin(reed-Steinberg cell-expressed intermediate filament-associated protein)是本实验中下调最明显的基因, TGFβ干预组的Restin表达量仅为对照组的0.52. Restin最早发现于何杰金氏淋巴瘤的R-S细胞, 位于人染色体12q24.3, 编码160 kDa的中间丝蛋白[11]. 此后发现在间变的大细胞淋巴瘤(Ki-1淋巴瘤)中也有表达, 但正常组织中没有表达[12]. 基因转染实验证实Restin的高表达与肿瘤细胞的过度增殖有关[13]. 本研究证实Restin在Bx-PC3胰腺癌细胞中也有表达, TGFβ抑制胰腺癌细胞增殖的机制与下调Restin的表达密切相关.
NDRG家族(n-myc downstream regulated gene family) 是近几年发现的一系列和信号转导相关的分子, 他包括NDRG1、2、3、4四个成员[14]. NDRG1是在n-myc缺陷的小鼠胚胎组织中发现的一异常高表达的新基因[15]. 早期的研究显示其与细胞的增殖能力呈负相关, 在肿瘤细胞中过度表达会降低细胞的增殖速度, 促进细胞的分化, 并减弱癌细胞的转移能力, 所以可能是潜在的抑癌基因[16-18]. 但最新的结果又表明NDRG1在脑瘤、前列腺癌和肾癌等多种癌组织中高表达, 可被视为一种新的肿瘤标志物[19-20]. 已知TGFβ对早期胰腺肿瘤有生长抑制作用, 但对晚期胰腺肿瘤反而有促浸润转移作用, 表现在TGFβ1长期诱导胰腺癌细胞可发生上皮间质变(EMT)而增加其侵袭性[21]. 本研究显示TGFβ干预后, Bx-PC3细胞的NDRG1表达明显下调(仅为对照组的0.53), 这究竟是否与TGFβ1的EMT相关值得深入研究.
虽然本实验cDNA芯片检测从表达水平角度提供了有关信号传导的有用线索, 但由于基因mRNA表达后还受到基因转录后调控与蛋白表达滞后的影响, 再加上基因表达具有组织差异性、较强的时相性等, 都会给实验结果的解释带来困难. 因此我们今后将对基因芯片中差异表达基因进行进一步的功能研究和信息学分析, 以便进一步阐明TGFβ信号通路的传导机制.
胰腺肿瘤中存在TGFβ的高表达. 外源性TGFβ对早期胰腺癌有负性生长调控作用, 但TGFβ对晚期胰腺癌有促浸润转移作用. 所涉机制尚未完全阐明.
陈其奎, 教授, 中山大学附属第二医院消化内科; 李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
外源性TGFβ1(1-10 μg/L)对BxPC-3胰腺癌细胞株的生长有一定抑制作用, 但胰腺癌又存在着复杂的信号通路的突变以逃逸TGFβ的生长抑制效应并不断恶性演进. 如何用现代分子生物学手段去恢复早期肿瘤对TGFβ负性生长调控的敏感性, 解除TGFβ对晚期肿瘤的促浸润转移作用. 这将是一项极有意义的研究.
本研究采用含有24个细胞周期相关基因位点的cDNA微阵列基因芯片, 研究探讨TGFβ1对BxPC-3胰腺癌细胞周期调控的机制, 尚属首次.
对基因芯片中获得的新老差异表达基因进行进一步的功能研究和信息学分析, 有助于阐明TGFβ信号通路的传导机制, 尤其是Smad4依赖性与非依赖性通路之间可能存在的串话(cross talking), 发现新的细胞周期调控限制点.
本文探讨TGF对胰腺癌细胞周期调控, 对于胰腺癌的治疗有指导意义, 学术价值较好.
编辑: 李军亮 电编: 吴鹏朕
| 3. | Dekoj T, Lee S, Desai S, Trevino J, Babcock TA, Helton WS, Espat NJ. G2/M cell-cycle arrest and apoptosis by n-3 fatty acids in a pancreatic cancer model. J Surg Res. 2007;139:106-112. [PubMed] [DOI] |
| 4. | Goodell JR, Ougolkov AV, Hiasa H, Kaur H, Remmel R, Billadeau DD, Ferguson DM. Acridine-based agents with topoisomerase II activity inhibit pancreatic cancer cell proliferation and induce apoptosis. J Med Chem. 2008;51:179-182. [PubMed] [DOI] |
| 5. | Wiseman DA, Werner SR, Crowell PL. Cell cycle arrest by the isoprenoids perillyl alcohol, geraniol, and farnesol is mediated by p21(Cip1) and p27(Kip1) in human pancreatic adenocarcinoma cells. J Pharmacol Exp Ther. 2007;320:1163-1170. [PubMed] [DOI] |
| 6. | Cook T, Gebelein B, Mesa K, Mladek A, Urrutia R. Molecular cloning and characterization of TIEG2 reveals a new subfamily of transforming growth factor-beta-inducible Sp1-like zinc finger-encoding genes involved in the regulation of cell growth. J Biol Chem. 1998;273:25929-25936. [PubMed] [DOI] |
| 7. | Wang H, Han H, Von Hoff DD. Identification of an agent selectively targeting DPC4 (deleted in pancreatic cancer locus 4)-deficient pancreatic cancer cells. Cancer Res. 2006;66:9722-9730. [PubMed] [DOI] |
| 8. | Ijichi H, Otsuka M, Tateishi K, Ikenoue T, Kawakami T, Kanai F, Arakawa Y, Seki N, Shimizu K, Miyazono K. Smad4-independent regulation of p21/WAF1 by transforming growth factor-beta. Oncogene. 2004;23:1043-1051. [PubMed] [DOI] |
| 9. | Li M, Becnel LS, Li W, Fisher WE, Chen C, Yao Q. Signal transduction in human pancreatic cancer: roles of transforming growth factor beta, somatostatin receptors, and other signal intermediates. Arch Immunol Ther Exp (Warsz). 2005;53:381-387. [PubMed] |
| 10. | Chetty R, Serra S, Salahshor S, Alsaad K, Shih W, Blaszyk H, Woodgett JR, Tsao MS. Expression of Wnt-signaling pathway proteins in intraductal papillary mucinous neoplasms of the pancreas: a tissue microarray analysis. Hum Pathol. 2006;37:212-217. [PubMed] [DOI] |
| 11. | Delabie J, Shipman R, Brüggen J, De Strooper B, van Leuven F, Tarcsay L, Cerletti N, Odink K, Diehl V, Bilbe G. Expression of the novel intermediate filament-associated protein restin in Hodgkin's disease and anaplastic large-cell lymphoma. Blood. 1992;80:2891-2896. [PubMed] |
| 12. | Hilliker C, Delabie J, Speleman F, Bilbe G, Bruggen J, Van Leuven F, Van den Berghe H. Localization of the gene (RSN) coding for restin, a marker for Reed-Sternberg cells in Hodgkin's disease, to human chromosome band 12q24.3 and YAC cloning of the locus. Cytogenet Cell Genet. 1994;65:172-176. [PubMed] [DOI] |
| 13. | Delabie J, Bilbe G, Brüggen J, Van Leuven F, De Wolf-Peeters C. Restin in Hodgkin's disease and anaplastic large cell lymphoma. Leuk Lymphoma. 1993;12:21-26. [PubMed] [DOI] |
| 14. | Kim KT, Ongusaha PP, Hong YK, Kurdistani SK, Nakamura M, Lu KP, Lee SW. Function of Drg1/Rit42 in p53-dependent mitotic spindle checkpoint. J Biol Chem. 2004;279:38597-38602. [PubMed] [DOI] |
| 15. | Shimono A, Okuda T, Kondoh H. N-myc-dependent repression of ndr1, a gene identified by direct subtraction of whole mouse embryo cDNAs between wild type and N-myc mutant. Mech Dev. 1999;83:39-52. [PubMed] [DOI] |
| 16. | Koshiji M, Kumamoto K, Morimura K, Utsumi Y, Aizawa M, Hoshino M, Ohki S, Takenoshita S, Costa M, Commes T. Correlation of N-myc downstream-regulated gene 1 expression with clinical outcomes of colorectal cancer patients of different race/ethnicity. World J Gastroenterol. 2007;13:2803-2810. [PubMed] |
| 17. | Kovacevic Z, Richardson DR. The metastasis suppressor, Ndrg-1: a new ally in the fight against cancer. Carcinogenesis. 2006;27:2355-2366. [PubMed] [DOI] |
| 18. | Shah MA, Kemeny N, Hummer A, Drobnjak M, Motwani M, Cordon-Cardo C, Gonen M, Schwartz GK. Drg1 expression in 131 colorectal liver metastases: correlation with clinical variables and patient outcomes. Clin Cancer Res. 2005;11:3296-3302. [PubMed] [DOI] |
| 19. | Berger P, Sirkowski EE, Scherer SS, Suter U. Expression analysis of the N-Myc downstream-regulated gene 1 indicates that myelinating Schwann cells are the primary disease target in hereditary motor and sensory neuropathy-Lom. Neurobiol Dis. 2004;17:290-299. [PubMed] [DOI] |
| 20. | Tu LC, Yan X, Hood L, Lin B. Proteomics analysis of the interactome of N-myc downstream regulated gene 1 and its interactions with the androgen response program in prostate cancer cells. Mol Cell Proteomics. 2007;6:575-588. [PubMed] [DOI] |