修回日期: 2008-08-18
接受日期: 2008-08-26
在线出版日期: 2008-10-08
目的: 探讨食管鳞癌中是否存在TGF-β1引发的EMT, 及其与食管鳞癌的浸润转移的关系.
方法: 选用郑州大学第一附属医院2000-01/2004-12食管鳞癌手术切除标本100例, 每例标本均选用癌组织中心及其远端正常黏膜对照. 采用免疫组织化学技术检测100例食管鳞癌手术切除标本中的TGF-β1、E-cadherin和Vimentin蛋白的表达.
结果: TGF-β1蛋白在食管鳞癌组织中的表达明显高于正常黏膜(85% vs 27%, P<0.01), 其在深层浸润组中的表达高于浅层浸润组(91% vs 75%, P<0.05); E-cadherin蛋白在食管鳞癌组织中的表达明显低于正常黏膜(43% vs 85%, P<0.01); Vimentin蛋白在食管鳞癌组织中的表达高于正常黏膜(23% vs 0%, P<0.05); 食管鳞癌组织中, TGF-β1与E-cadherin表达呈负相关(Tb = -0.257, P = 0.013), 而与Vimentin表达呈正相关(Tb = 0.163, P = 0.030), E-cadherin与Vimentin表达呈负相关(Tb = -0.379, P = 0.000).
结论: 食管鳞癌中可能存在TGF-β1引发的EMT, 且可能与食管鳞癌的浸润转移有关.
引文著录: 张红燕, 孙洋, 李珊珊, 杨建萍, 阎爱华, 王新华, 王小军. TGF-β1引发的上皮-间质转化与食管鳞癌浸润转移的关系. 世界华人消化杂志 2008; 16(28): 3162-3166
Revised: August 18, 2008
Accepted: August 26, 2008
Published online: October 8, 2008
AIM: To investigate the correlation of TGF-β1-induced epithelial-mesenchymal transition to infiltration and metastasis of esophageal squamous cell carcinoma (ESCC).
METHODS: One hundred ESCC specimens from January 2000 to December 2004 in our hospital were selected. For each specimen, the cancerous tissue and its remote normal mucosa were analyzed and compared. Immunohistochemistry was used to detect the expressions of TGF-β1, E-cadherin and Vimentin proteins.
RESULTS: The expression rate of TGF-β1 protein was significantly higher in ESCC tissues than in normal tissues (85% vs 27%, P < 0.01), and the expression rate of TGF-β1 protein in deeply infiltrating group was significantly higher than that in superficially infiltrating group(91% vs 75%, P < 0.05); the expression rate of E-cadherin protein was significantly lower in ESCC tissues than in normal tissues (43% vs 85%, P < 0.01); the expression rate of Vimentin protein was higher in ESCC tissues than in normal tissues (23% vs 0%, P < 0.05). In esophageal carcinoma, the expression of TGF-β1 was negatively correlated to that of E-cadherin (Tb = -0.257, P = 0.013), but positively correlated to that of Vimentin protein (Tb = 0.163, P = 0.030); in addition, the expression of E-cadherin was negatively correlated to that of Vimentin protein (Tb = -0.379, P = 0.000).
CONCLUSION: Epithelial-mesenchymal transition induced by TGF-β1 may be present in ESCC, and is possibly related to ESCC infiltration and metastasis.
- Citation: Zhang HY, Sun Y, Li SS, Yang JP, Yan AH, Wang XH, Wang XJ. Relationship between TGF-β1-induced epithelial-mesenchymal transition and infiltration, metastatis of esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(28): 3162-3166
- URL: https://www.wjgnet.com/1009-3079/full/v16/i28/3162.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i28.3162
上皮-间质转化(epithelial-mesenchymal transition, EMT)是胚胎发育、组织重建和伤口修复中的基础过程, 同时也是肿瘤浸润、转移的一个非常重要的机制[1]. TGF-β是一种具有多种功能的细胞因子, 已有研究发现TGF-β在诱发EMT中起关键作用[2-3]. 在EMT过程中表达下调的因子主要是上皮性标志物如E-cadherin, 表达上调的因子主要是间质性标志物(如Vimentin)[4]. 本研究应用免疫组化技术检测TGF-β1、E-cadherin和Vimentin蛋白在100例食管鳞癌组织中的表达, 旨在探讨食管鳞癌中是否存在TGF-β1引发的EMT, 及其是否与食管鳞癌的浸润转移有关.
选用郑州大学第一附属医院2000-01/2004-12食管鳞癌手术切除标本存档蜡块100例, 每例标本均选用癌组织中心及其远端正常黏膜对照. 100例标本病理诊断均为鳞状细胞癌, 分化Ⅰ级23例, Ⅱ级66例, Ⅲ级11例; 浸润至浅层(黏膜下层及浅肌层)36例, 深层(深肌层及外膜)64例; 有淋巴结转移者22例, 未确认有淋巴结转移者78例. 免疫组织化学染色采用链霉卵白素-生物素过氧化物酶法(Streptavidin Peroxidase,S-P). TGF-β1兔抗人多克隆抗体为美国Santa Cruz公司产品, E-cadherin鼠抗人单克隆抗体、Vimentin鼠抗人单克隆抗体、S-P试剂盒及DAB均购自北京中杉金桥生物技术有限公司.
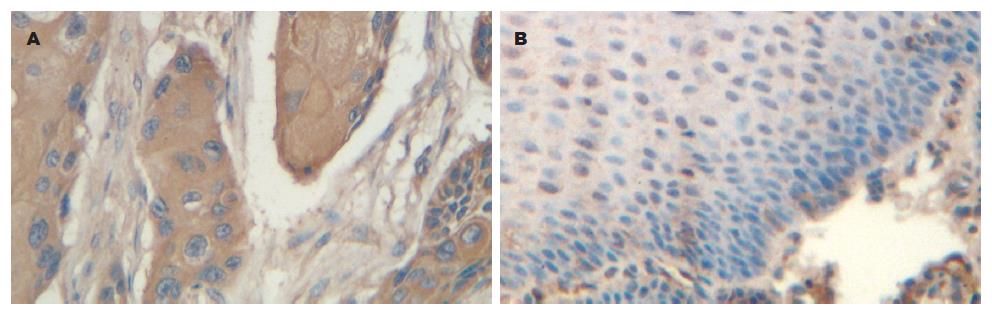
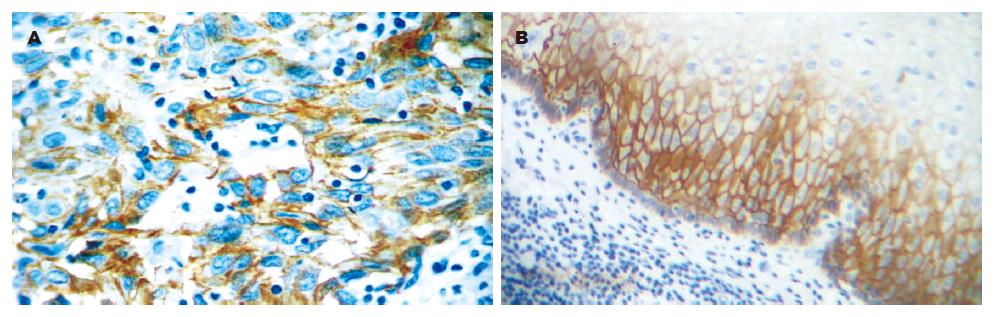
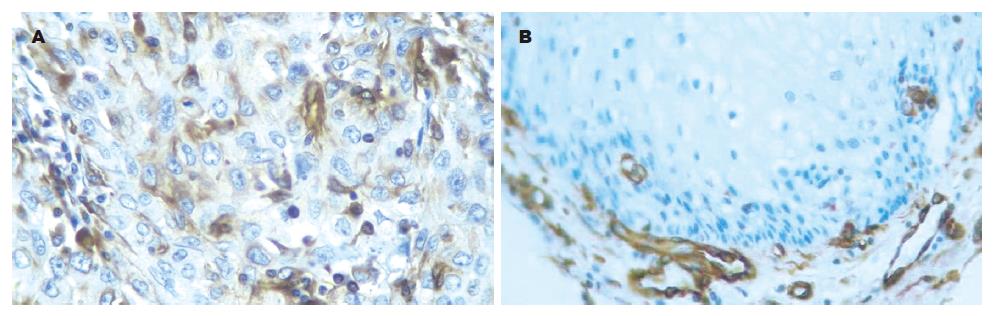
TGF-β1以胞膜和胞质着色为阳性细胞. 每张切片随机观察5个高倍视野, 计数500个细胞中染色阳性细胞数, 按阳性细胞所占比例进行分级, <20%为(-), ≥20%为(+)[5]. E-cadherin以胞膜和胞质着色为阳性细胞. 结果判断参照sulzers分级法[6], 阳性细胞<10%为(-), ≥10%为(+). Vimentin以胞质着色为阳性细胞. 每张切片随机观察5个高倍视野, 计数500个细胞中染色阳性细胞数, 按阳性细胞所占比例进行分级, <10%为(-), ≥10%为(+).
统计学处理 所有数据均经SPSS13.0软件进行统计分析. 阳性率之间的比较采用χ2检验, 阳性率间相关性采用Kendall等级相关进行比较. 以α = 0.05作为检验水准.
TGF-β1蛋白在食管鳞癌组织中的阳性染色定位于细胞质. 100例食管鳞癌中TGF-β1蛋白阳性表达率明显高于正常黏膜(85% vs 27%, P<0.01); TGF-β1蛋白表达与肿瘤分化程度及淋巴结转移无关(P>0.05), 但与肿瘤浸润深度有关(P<0.05), TGF-β1蛋白在深层浸润组中的阳性表达率明显高于浅层浸润组(91% vs 75%, P<0.05, 表1, 图1).
| n | TGF-β1 | P值 | E-cadherin | P值 | Vimentin | P值 | ||||
| - | + | - | + | - | + | |||||
| 正常 | 100/20 | 73 | 27 | 15 | 85 | 20 | 0 | |||
| 食管鳞癌 | 100 | 15 | 85 | 0.000 | 57 | 43 | 0.000 | 77 | 23 | 0.038 |
| 分化程度 | ||||||||||
| Ⅰ级 | 23 | 4 | 19 | 14 | 9 | 17 | 6 | |||
| Ⅱ级 | 66 | 7 | 59 | 39 | 27 | 51 | 15 | |||
| Ⅲ级 | 11 | 4 | 7 | 0.080 | 4 | 7 | 0.341 | 9 | 2 | 0.871 |
| 浸润深度 | ||||||||||
| 浅层 | 36 | 9 | 27 | 21 | 15 | 30 | 6 | |||
| 深层 | 64 | 6 | 58 | 0.036 | 36 | 28 | 0.840 | 47 | 17 | 0.259 |
| 淋巴结转移 | ||||||||||
| 无 | 78 | 9 | 69 | 47 | 31 | 58 | 20 | |||
| 有 | 22 | 6 | 16 | 0.087 | 10 | 12 | 0.216 | 19 | 3 | 0.237 |
E-cadherin蛋白在食管鳞癌组织中的阳性染色定位于细胞质. 100例食管鳞癌中E-cadherin蛋白阳性表达率明显低于正常黏膜(43% vs 85%, P<0.01); E-cadherin蛋白表达与肿瘤分化程度、浸润深度及淋巴结转移无关(P>0.05, 表1, 图2).
Vimentin蛋白在食管鳞癌组织中的阳性染色定位于细胞质. 100例食管鳞癌中Vimentin蛋白阳性表达率高于正常黏膜(23% vs 0%, P<0.05); Vimentin蛋白表达与肿瘤分化程度、浸润深度及淋巴结转移无关(P>0.05, 表1, 图3).
100例食管鳞癌组织中, TGF-β1与E-cadherin表达呈负相关(P<0.05), 而与Vimentin表达呈正相关(P<0.05), E-cadherin与Vimentin表达呈负相关(P<0.01, 表2-3).
| E-cadherin | TGF-β1 | Vimentin | ||
| - | + | - | + | |
| - | 4 | 53 | 36 | 21 |
| + | 11 | 32 | 41 | 2 |
| 合计 | 15 | 85 | 77 | 23 |
| Vimentin | TGF-β1 | 合计 | |
| - | + | ||
| - | 14 | 63 | 77 |
| + | 1 | 22 | 23 |
| 合计 | 15 | 85 | 100 |
食管癌是我国常见的恶性肿瘤之一, 河南省又是高发区域. 到目前为止, 食管癌仍严重地危害着人们的生命健康, 因此对食管癌浸润和转移机制的研究显得尤为重要和突出. EMT最早被发育生物学家用来描述在胚胎发育过程中某些特定部位的上皮细胞所发生的形态学改变. 例如在胚胎期器官形成的过程中, 上皮细胞变得类似于成纤维细胞, 从而具有了强大的移动能力. 发生EMT的上皮细胞在经历了短暂的结构改变后, 细胞的迁移和运动能力增强, 因此, 通过EMT肿瘤细胞可获得侵袭转移能力.
EMT的诱导因素来源于细胞外界刺激, 如多种细胞因子、生长因子以及缺血缺氧等, 其中生长因子在诱导肿瘤细胞EMT中的作用最受关注. TGF-β是一种多功能的多肽类细胞因子, 首先由Assoian et al[7]在1983年自人血小板中成功提取, 已被证实在多种生理病理过程中起重要作用. Zavadil et al[8]的实验证明TGF-β能够诱导培养集中正常细胞和转化细胞形态的改变以及EMT特征的出现, Han et al[9]报道TGF-β1诱导皮肤鳞癌细胞发生EMT, 形成梭形细胞癌. 提示TGF-β表达上调会开启EMT, 并导致肿瘤的浸润及转移. 为了探讨食管鳞癌中是否存在TGF-β1引发的EMT以及食管鳞癌的浸润转移是否与TGF-β1引发的EMT有关, 作者研究了食管鳞癌中TGF-β1的表达. 研究结果显示, 100例食管鳞癌中TGF-β1蛋白阳性表达率明显高于正常黏膜(85% vs 27%, P<0.01), 提示TGF-β1的高表达可能与食管鳞癌EMT有关. TGF-β1高表达的原因可能为: (1)肿瘤细胞失去对TGF-β1的敏感性而导致TGF-β1反馈性的表达增多; (2)肿瘤细胞自主分泌TGF-β1, 从而维持肿瘤细胞的侵袭力. 另外, 本研究结果还显示100例食管鳞癌中TGF-β1在深层浸润组的阳性表达率高于浅层浸润组(91% vs 75%, P<0.05), 说明发生了EMT的食管鳞癌细胞运动能力增强, 侵袭能力增强. TGF-β1促进肿瘤侵袭转移的机制可能为: (1)诱导有利于浸润转移的基质环境形成; (2)促进血管新生; (3)抑制宿主抗肿瘤免疫反应等.
E-cadherin是钙黏蛋白家族的一个重要成员, 是维持上皮细胞极性及细胞间黏附连接的主要分子[10]. Vimentin是细胞骨架的重要成分之一, 主要分布于间叶组织来源的细胞及某些未分化细胞. 现已发现, 在多种发生EMT的肿瘤中, E-cadherin表达下降或缺失, 而Vimentin异常高表达. 本研究结果显示100例食管鳞癌中E-cadherin蛋白阳性表达率明显低于正常黏膜(43% vs 85%, P<0.01), Vimentin蛋白阳性表达率高于正常黏膜(23% vs 0%, P<0.05), 进一步证实食管鳞癌细胞在发生恶性转化的过程中可能有EMT参与. 由于E-cadherin表达下降, 使得细胞形态改变, 细胞间连接变化, 允许肿瘤细胞摆脱细胞-细胞间连接而表现得更具侵袭性. 另外Vimentin表达增多使得细胞骨架结构变化, 上皮源性细胞由立方形变为纺锤形纤维样细胞, 更易于迁移游动, 而且细胞骨架作为细胞内外信号传递系统的载体, 其结构的变化可干扰信号传导系统的正常工作, 进一步导致细胞生物学性状改变, 如黏附性下降, 运动能力增强.
100例食管鳞癌中TGF-β1与E-cadherin表达呈负相关(P<0.05), 而与Vimentin表达呈正相关(P<0.05). 此研究结果进一步说明了TGF-β1与EMT的关系. 由于食管鳞癌组织中TGF-β1的过表达, 导致上皮性标志物E-cadherin表达明显下降, 间质性标志物Vimentin表达明显增多, 结果使得细胞骨架重排, 上皮细胞变得类似于成纤维细胞, 从而引发EMT.
总之, TGF-β1诱导的EMT及其与食管鳞癌浸润转移的密切关系使其在食管鳞癌发病机制的阐明和治疗上具有一定的价值. 如果能够使具有间质特性的细胞恢复上皮细胞特性, 那么就有可能逆转EMT, 阻碍肿瘤浸润转移, 这将为食管鳞癌的治疗打开一个新的思路.
食管癌是死亡率很高的恶性肿瘤之一, 尤其在我国河南省更常见. 目前已知肿瘤的浸润转移是导致恶性肿瘤患者死亡的主要原因, 因此研究肿瘤的浸润转移机制, 对于降低肿瘤患者的死亡率至关重要.
王健生, 副教授, 西安交通大学医学院第一附属医院肿瘤外科
肿瘤的浸润转移是一复杂过程, 目前EMT在肿瘤浸润转移中的作用逐渐引起人们的关注. 已有研究发现TGF-β1在诱发EMT中起关键作用. TGF-β1引发的EMT及其促肿瘤浸润转移的机制是目前研究的热点.
Zavadil et al的实验证明TGF-β能够诱导培养基中正常细胞和转化细胞形态的改变以及EMT特征的出现; Han et al报道TGF-β1诱导皮肤鳞癌细胞发生EMT, 形成梭形细胞癌, 提示TGF-β1表达上调会开启EMT, 并导致肿瘤的浸润及转移.
截至目前, 有关EMT在食管鳞癌浸润转移中的研究鲜见报道, 探讨食管鳞癌的EMT, 有助于阐明食管鳞癌的浸润转移机制, 并为食管鳞癌的治疗打开一个新的思路.
本文研究结果表明食管鳞癌组织中TGF-β1的过表达与EMT有关, 发生了EMT的食管鳞癌细胞运动能力及侵袭转移能力增强. TGF-β1可能通过对上皮性标志物E-cadherin和间质性标志物Vimentin的调控在食管鳞癌EMT及浸润转移中起关键作用, 这对食管鳞癌发病机制的阐明和治疗具有一定的价值.
上皮间质转化: 上皮细胞在与周围间质的相互作用过程中逐渐获得了某些间质细胞所特有的性状的现象. 最早被发育生物学家用来描述在胚胎发育过程中某些特定部位的上皮细胞所发生的形态学改变.
本研究方法合理, 对照可靠, 统计方法运用恰当,结果明确, 并附有相应的图片资料, 具有一定的科学性、可读性和创新性.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Shook D, Keller R. Mechanisms, mechanics and function of epithelial-mesenchymal transitions in early development. Mech Dev. 2003;120:1351-1383. [PubMed] [DOI] |
| 2. | Cho HJ, Baek KE, Saika S, Jeong MJ, Yoo J. Snail is required for transforming growth factor-beta-induced epithelial-mesenchymal transition by activating PI3 kinase/Akt signal pathway. Biochem Biophys Res Commun. 2007;353:337-343. [PubMed] [DOI] |
| 3. | Janda E, Lehmann K, Killisch I, Jechlinger M, Herzig M, Downward J, Beug H, Grünert S. Ras and TGF[beta] cooperatively regulate epithelial cell plasticity and metastasis: dissection of Ras signaling pathways. J Cell Biol. 2002;156:299-313. [PubMed] [DOI] |
| 4. | LaGamba D, Nawshad A, Hay ED. Microarray analysis of gene expression during epithelial-mesenchymal transformation. Dev Dyn. 2005;234:132-142. [PubMed] [DOI] |
| 6. | Sulzer MA, Leers MP, van Noord JA, Bollen EC, Theunissen PH. Reduced E-cadherin expression is associated with increased lymph node metastasis and unfavorable prognosis in non-small cell lung cancer. Am J Respir Crit Care Med. 1998;157:1319-1323. [PubMed] |
| 7. | Assoian RK, Komoriya A, Meyers CA, Miller DM, Sporn MB. Transforming growth factor-beta in human platelets. Identification of a major storage site, purification, and characterization. J Biol Chem. 1983;258:7155-7160. [PubMed] |
| 8. | Zavadil J, Bottinger EP. TGF-beta and epithelial-to-mesenchymal transitions. Oncogene. 2005;24:5764-5774. [PubMed] [DOI] |
| 9. | Han G, Lu SL, Li AG, He W, Corless CL, Kulesz-Martin M, Wang XJ. Distinct mechanisms of TGF-beta1-mediated epithelial-to-mesenchymal transition and metastasis during skin carcinogenesis. J Clin Invest. 2005;115:1714-1723. [PubMed] [DOI] |
| 10. | Takeichi M. Morphogenetic roles of classic cadherins. Curr Opin Cell Biol. 1995;7:619-627. [PubMed] [DOI] |