修回日期: 2008-09-10
接受日期: 2008-09-17
在线出版日期: 2008-10-08
目的: 探讨启膈散及其拆方抑制肿瘤血管生成的作用和机制.
方法: 取对数生长期的人食管癌EC9706细胞, 接种于裸鼠右胁皮下制备荷瘤裸鼠模型. 自接种后第2天开始, 每天用40倍成人剂量的启膈散全方及其活血和化痰两个拆方水煎液灌胃给药, 连续60 d. 用免疫组化方法检测移植瘤中Fac-Ⅷ因子相关抗原标记的微血管密度(MVD)和VEGF的表达, Western blot方法检测肿瘤组织EGFR、PDGFR、VEGF及PLC-γ1蛋白表达.
结果: 各用药组肿瘤MVD与模型组相比明显降低(36.43±4.16, 40.29±2.87 42.43±3.04 vessels/mm2vs 48.57±7.45 vessels/mm2, P<0.05或0.01). 各组肿瘤MVD值与VEGF表达量呈正相关(r = 0.712, P = 0.0005). 各用药组肿瘤EGFR、PDGFR、VEGF、PLC-γ1蛋白表达与模型组相比明显降低. 启膈散及其拆方抑制裸鼠移植瘤MVD及EGFR、PDGFR、VEGF、PLC-γ1蛋白表达的作用以全方组最好, 活血组次之.
结论: 启膈散及其拆方能够抑制肿瘤血管生成, 其作用机制与抑制EGFR、PDGFR、VEGF及PLC-γ1蛋白表达相关.
引文著录: 司富春. 启膈散及其拆方对人食管癌Eca109细胞裸鼠移植瘤血管生成的抑制作用. 世界华人消化杂志 2008; 16(28): 3139-3145
Revised: September 10, 2008
Accepted: September 17, 2008
Published online: October 8, 2008
AIM: To explore the effects and mechanism of Qigesan and its separated formula on tumor angiogenesis.
METHODS: Exponentially growing Eca109 human esophageal carcinoma cells (1 × 106 cells/mouse) were injected subcutaneously into the flank of 6- week-old female BALB/c nude mice. On the next day after inoculation, the decoctions (40 folds of adult dosage) of Qigesan (W) and its separated formula (blood-activating group P and resolving phlegm group R) were administered by oral gavage once a day for 60 days. Microvessel density (MVD) and VEGF expression in the transplanted tumor was detected using immunohistochemtry, and the protein expressions of EGFR, PDGFR, VEGF and phospholipase C-γ1 (PLC-γ1) were determined using Western blot.
RESULTS: Microvessel density (MVD) in the transplanted tumor of all treatment groups were markedly decreased compared with that in control group (36.43 ± 4.16, 40.29 ± 2.87 42.43 ± 3.04 vessels/mm2vs 48.57 ± 7.45 vessels/mm2, P < 0.05 or 0.01) MVD and VEGF had statistically positive correlation by SPASS13.0 (r = 0.712, P = 0.0005). The protein expressions of EGFR, PDGFR, VEGF and phospholipase C-γ1 (PLC-γ1) were obviously decreased compared with that in control group. Inhibitory effects of Qigesan and its separated formula on MVD and those protein expressions were the best in group W and second in group P.
CONCLUSION: Qigesan and its separated formula can inhibit tumor angiogenesis, which is related to the inhibition of protein expressions of EGFR, PDGFR, VEGF and PLC-γ1.
- Citation: Si FC. Inhibitory effect of Qigesan and its separated formula on angiogenesis of esophageal carcinoma Eca109 cell-transplanted nude mouse tumor. Shijie Huaren Xiaohua Zazhi 2008; 16(28): 3139-3145
- URL: https://www.wjgnet.com/1009-3079/full/v16/i28/3139.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i28.3139
肿瘤的生长促使依赖血管生成, 肿瘤的生长依赖血管供应的氧和营养物质的支持, 同时血管内皮细胞分泌多种生长因子促进肿瘤细胞增殖, 肿瘤血管生成是肿瘤转移的重要环节. 因此, 抑制肿瘤血管生成已成为治疗肿瘤的重要策略. 我们以往研究发现, 启膈散及其拆方明显抑制食管癌体外培养细胞和裸鼠移植瘤生长[1-2], 为了进一步研究其作用机制, 本研究观察了该方对食管癌Eca109细胞裸鼠移植瘤微血管密度及EGFR、PDGFR、VEGF、PLC-γ1蛋白表达的影响.
丹参、郁金、砂仁壳、北沙参、贝母、茯苓购于河南中医学院第三附属医院, 经鉴定皆为正品. 分为全方组(W组, 方含丹参、郁金、砂仁壳、北沙参、贝母、茯苓)、活血行气组, 简称活血组(P组, 方含丹参、郁金、砂仁壳)、润燥化痰组, 简称化痰组(R组, 方含北沙参、贝母、茯苓), 每味药各10 g, 煎煮、浓缩、5000 g离心、0.22 μm过滤, 取部分干燥称重, 换算出浓度, 用时调至所需浓度. 人食管癌细胞株Eca109从郑州大学医学院组胚教研室引进. BALB/C(nu/nu)♀裸鼠, 6周龄, 购自中国科学院上海实验动物中心/上海斯莱克实验动物有限公司. DMEM培养基和多聚甲醛(Gibco公司)、PMSF与Leupeptin (Amresco公司), 丙烯酰胺(Biomol公司)、胰蛋白酶、山羊抗小鼠IgG-HRP和山羊抗兔IgG-HRP(华美公司)、 ECL试剂盒(Santa Cruz公司)、PLC-γ1 mAb(韩国浦项科技大学国家信号传导网络实验室惠赠)、鼠抗人EGFR mAb、兔抗人PDGFRβ多克隆抗体和兔抗人VEGF多克隆抗体(Santa Cruz公司)、兔抗人八因子(FactorⅧ related antigen, Fac-Ⅷ)相关抗原多克隆抗体(北京中杉公司), 山羊抗兔SABC免疫组化试剂盒(博士德公司), 考马斯亮蓝G250(Amresco公司). Heraeus细胞培养箱(德国Kendro公司产品)、倒置显微镜(德国ZEISS公司产品)、SG-603生物安全柜(Bake公司产品)、BCM-1000A型生物洁净工作台(苏州安泰空气技术有限公司)、紫外分光光度计(Thermo公司)、蛋白电泳系统(BIO-RAD公司)、台式冷冻离心机(Sigma公司)、切片机(Zeiss公司)、Olympus显微镜、游标卡尺(上海量具刀刃厂产品)、BIO2000医学图像分析系统.
1.2.1 细胞培养: 生长于含100 mL/L胎牛血清的DMEM培养液中, 置于37 ℃、50 mL/L CO2培养箱, 每间隔48 h更换一次培养基, 待细胞生长至70%汇合率时, 用胰蛋白酶溶液[用D-Hans液配制, 含2.5 g/L胰蛋白酶, 0.2 g/L乙二胺四乙酸二钠(EDTA), pH 8.3]消化, 用于裸鼠移植瘤接种.
1.2.2 裸鼠饲养: 裸鼠饲养于生物安全柜内, 饲养房间每周2次紫外线照射, 出入人员更换洁净工作衣. 裸鼠食物、垫料进行湿热消毒后烘干使用, 饮用水加入盐酸使pH稳定在3-4之间, 定期喂养消毒后的黄豆. 一切严格无菌操作.
1.2.3 Eca109细胞裸鼠移植瘤模型建立: 收集对数期生长细胞, 1000 r/min离心, 无血清DMEM培养基洗涤2次, 细胞计数, 用不含血清的DMEM培养基调细胞浓度至5×106 个/mL, 以0.2 mL/鼠右胁皮下接种. 50只裸鼠随机取10只为空白组, 其余40只造模. 造模裸鼠随机分为对照组C、W组、P组、R组共4组, 每组10只. 所有处理自造模后第2天开始, 均采用人常用量的40倍ig, 每日1次, 每只0.2 mL. 自肿瘤长出之日起, 每10 d称体质量, 测量肿瘤大小, 以上处理连续进行60 d后, 脱颈椎处死裸鼠, 剥离瘤块, 称取肿瘤重量和计算药物抑瘤率[2].
1.2.4 病理观察: HE染色进行肿瘤病理组织学观察.
1.2.5 VEGF蛋白表达检测: 免疫组化法(SABC法)检测VEGF蛋白表达. 按试剂盒说明操作. 兔抗人VEGF多克隆抗体浓度1:200, PBS代替一抗作为阴性对照.应用BI2000医学图像分析系统进行分析, 在显微镜×200视野下, 每个切片随机在4个视野, 取分布密度值.
1.2.6 Fac-Ⅷ因子相关抗原抗体标记的肿瘤微血管密度MVD值的测定: 免疫组化法(SABC法)检测Fac-Ⅷ因子相关抗原抗体标记的肿瘤微血管密度(MVD). 按试剂盒说明操作. 兔抗人F-Ⅷ因子相关抗原抗体浓度1:50, PBS代替一抗作为阴性对照, 任何被染成棕黄或棕褐色的、分界清楚的内皮细胞或内皮细胞团簇, 均作为一个血管计数. 低倍视野×40或×100下选择3个微血管新生活跃区, ×200视野下(0.739 mm2/视野)分别计数F-Ⅷ因子相关抗原抗体标记的微血管数, 取其平均值, 计算MVD值(vessels/mm2), 反映新血管生成活跃度.
1.2.7 Western blot法检测瘤体组织EGFR、PLC-γ1、PDGFRβ、VEGF蛋白表达: 取裸鼠肿瘤组织0.5 g, 用细胞裂解液裂解(裂解液组成: 20 mmol/L HEPES, pH 7.2, 100 mL/L甘油, 50 mmol/L NaCl, 10 mL/L TritonX-100, 1 mmol/L Na3VO4, 10 mg/L Leupeptin和1 mmol/L PMSF), 用80 g/L SDS-PAGE电泳, 分离的蛋白质转移到硝酸纤维素膜, 50 g/L脱脂奶粉TTBS溶液封闭滤膜1 h(TTBS: 10 mmol/L Tris, pH 7.6, 150 mmol/L MNaCl, 0.5 mL/L Tween 20), 每张膜用所要检测蛋白相应抗体反应, EGFR、PDGFRβ和VEGF抗体用50 g/L脱脂奶粉TTBS溶液稀释浓度为0.4 mg/L, PLC-γ1抗体稀释浓度为1 mg/L, 再用相应的羊抗鼠或羊抗兔IgG-HRP(1:50)检测和ECL底物显影.
统计学处理 计量数据应用软件SPSS13.0 进行单因素方差分析和Spearman相关分析(α = 0.05).
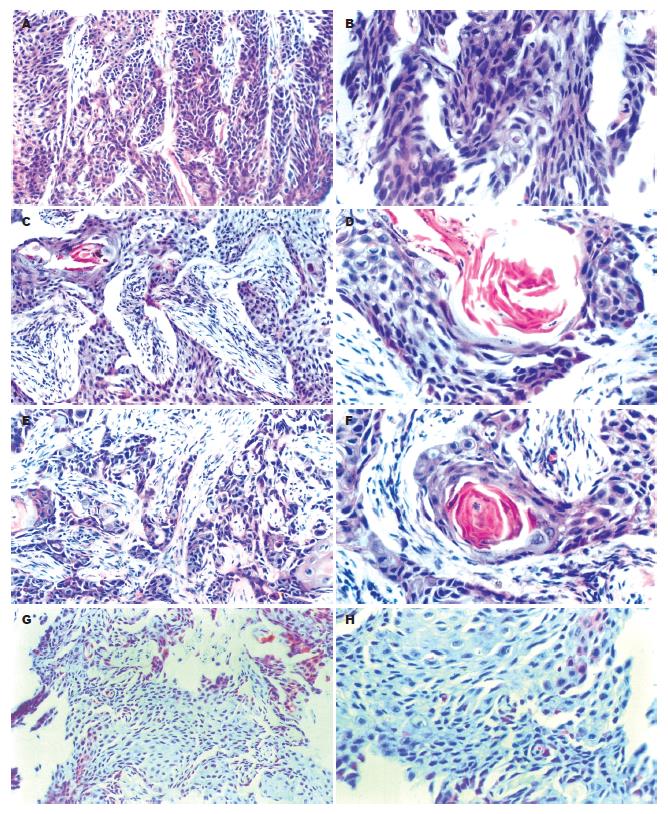
肿瘤组织为典型的鳞状上皮癌. 模型组肿瘤细胞呈片状或巢状分布, 胞质丰富呈嗜碱性, 可见病理核分裂像, 角化珠消失, 内有散在毛细血管, 间质相对较少; 全方组肿瘤细胞出现萎缩现象, 病理核分裂像明显减少, 角化珠增多体积增大, 间质明显增多, 纤维细胞明显增多; 活血组肿瘤细胞出现萎缩现象, 病理核分裂像明显减少, 肿瘤细胞凋亡增多, 角化珠增多体积缩小, 间质明显增多, 纤维细胞明显增多; 化痰组肿瘤细胞出现一定的萎缩, 病理核分裂像明显减少, 角化珠明显减少或消失, 间质明显减少并纤维细胞明显减少(图1).
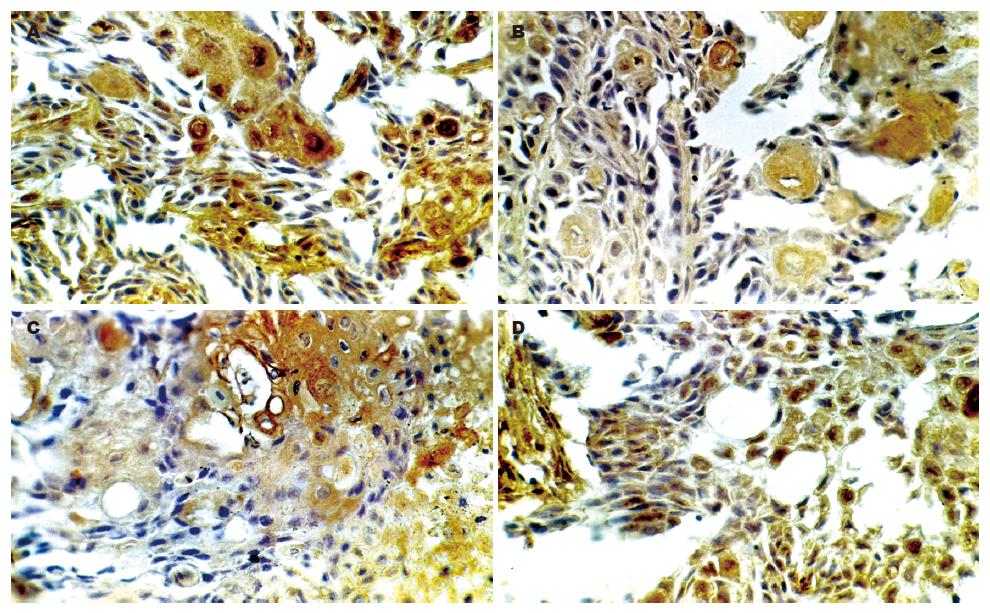
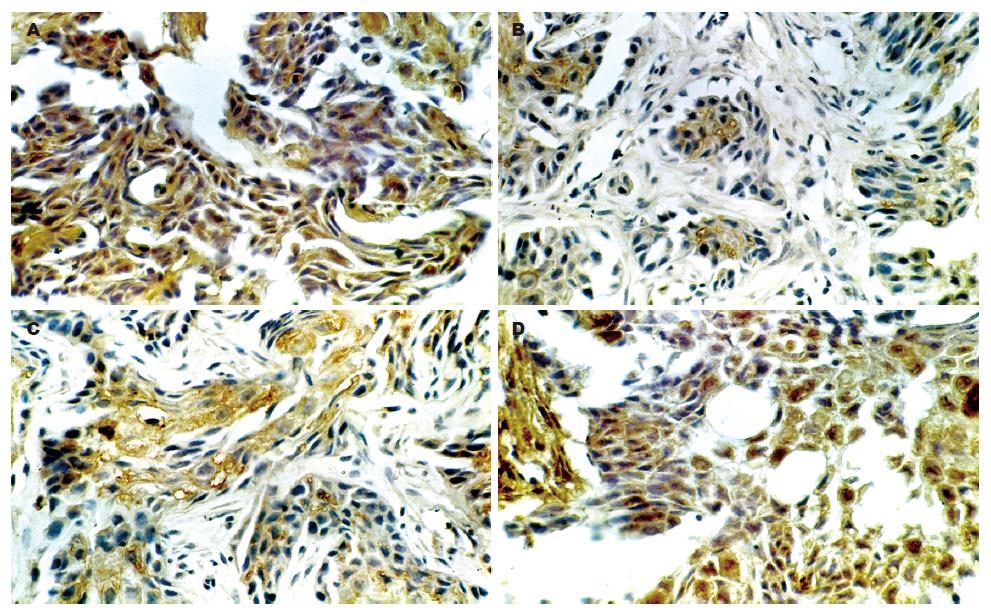
各组肿瘤微血管密度, 经单因素方差分析, 模型组C和W、P比较具有统计学意义(P = 0.0005, 0.021), W和R比较P = 0.004, 说明启膈散及其拆方可以抑制微血管的生成, 以全方组最好、活血组次之(表1, 图2). VEGF在肿瘤组织中的表达, 呈棕黄色颗粒状或弥漫性分布, 肿瘤细胞、间质、血管都有表达. 癌巢周边的癌细胞表达呈强阳性, 近角化珠的癌细胞表达呈弱阳性, 微血管上皮表达呈强阳性. W组、P组、R组VEGF表达呈弱阳性(图3); 模型组C和W、P、R相比, P值分别为0.039、0.081和0.118. MVD和VEGF两者作Spearman等级相关分析, 相关系数r = 0.712, P = 0.0005. 说明启膈散及其拆方抑制微血管的生成与抑制VEGF表达有相关性.
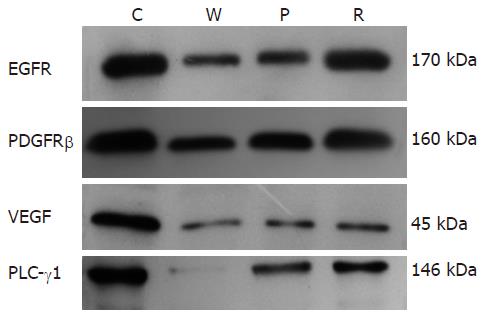
Western blot检测结果显示, 用启膈散及其拆方治疗的裸鼠肿瘤组织内EGFR、PDGFR、VEGF、PLC-γ1蛋白表达与对照组相比明显减弱, 说明启膈散及其拆方对这些蛋白表达具有很强的抑制作用, 其中全方组作用最强, 活血组次之(图4).
肿瘤血管的生成促使肿瘤的生长. 肿瘤大于1-2 mm3时, 肿瘤生长依赖于血管供应的氧和养料, 同时, 血管内皮细胞还可分泌多种生长因子促进肿瘤细胞增殖. 肿瘤血管生成还是肿瘤转移的重要环节, 发育不良的肿瘤血管和新生的血管内皮细胞分泌的多种蛋白酶都易使肿瘤细胞进入血流发生转移[3]. 因此, 抑制肿瘤血管生成, 已成为治疗肿瘤的重要策略[4-6]. MVD是研究肿瘤血管的重要测定指标[7]. 在食管癌中, 随着肿瘤组织中MVD值的增高, 患者的生存时间明显缩短, 生存率显著下降, 多因素预后分析表明, MVD值可作为食管鳞状细胞癌患者的预后判断指标[8-9]. 我们以前报道启膈散全方及其活血组拆方对裸鼠食管癌肿瘤生长抑制作用有很大差异, 在移植瘤生长前20 d, 活血组作用强于全方组, 与体外实验一致, 在移植瘤生长20 d后瘤体大于2 mm3, 全方组效果好于活血组, 推测肿瘤微环境中血管生成对启膈散及其拆方作用有很大影响[2]. 本研究对移植瘤病理组织学检测显示模型组胞质丰富呈嗜碱性, 角化珠消失, 间质较少, 各用药组肿瘤细胞出现不同程度萎缩, 胞漿减少, 嗜碱性改变减轻, 角化珠增多, 体积增大, 间质增宽, 表明所建立的食管癌移植瘤模型细胞代谢增强, 启膈散及其拆方对其有明显的抑制作用. 免疫组化结果进一步表明模型组移植瘤组织中毛细血管增生活跃, MVD为48.57±7.45 vessels/mm2, 启膈散及其拆方可以不同程度减少MVD, 说明该方可以抑制微血管的生成, 以全方组效果最好, 活血组次之.
肿瘤细胞和肿瘤微环境中的其他细胞可以分泌很多促进血管生成的因子, 如EGF、PDGF、VEGF、FGF、TGFβ等. 而这些生长因子信号有一个共同的细胞内效应分子PLC-γ1, 研究表明PLC-γ1介导的信号传导参与了血管生成[10]. VEGF在大、小血管内皮细胞均有高亲合结合位点, 在生理性血管生成和肿瘤血管生成中都起着极其重要的作用[11-12]. 他一方面可以增加血管通透性, 有利于血浆蛋白、纤维蛋白原外渗, 促进血管生成和新基质形成; 另一方面, 通过其受体促进血管内皮细胞增殖、迁移. VEGF在食管鳞癌和腺癌中都有表达[8,13-14], 本实验结果表明, VEGF在Eca109细胞裸鼠移植瘤组织中具有很强表达, 分布于肿瘤细胞胞质、血管上皮细胞及间质中, 启膈散及其拆方可以不同程度的抑制VEGF的表达, 并与MVD具有相关性, Western blot分析也证明了这一点, 说明启膈散及其拆方抑制VEGF表达是其抑制肿瘤血管生成的途径之一.
血小板衍生生长因子受体(platelet-derived growth factor receptorα/β, PDGFR)是一个酪氨酸激酶受体, 参与各种各样生理活动[15], PDGFR异常在肿瘤发生、生长和转移中起关键作用[16-17]. PDGF可以自分泌和旁分泌的形式与其受体结合刺激肿瘤细胞和基质细胞增殖或活化, 募集肿瘤成纤维细胞, 同时参与肿瘤血管的生成[18-19]. 已发现PDGF在食管癌肿瘤细胞中以自分泌形式刺激细胞的生长和生存[20]. 本研究发现Eca109细胞裸鼠移植瘤组织中表达PDGFR蛋白, 启膈散及其拆方可以不同程度的抑制PDGFR的表达, 以全方组最好, 说明PDGFR参与移植肿瘤组织生长, 也可能参与移植肿瘤的血管生成, 抑制PDGFR表达是启膈散及其拆方抑制肿瘤生长的重要途径.
EGFR不但参与肿瘤细胞的增殖、分化和抗凋亡, 同时还参与血管的生成, 与肿瘤生长和转移具有密切关系[21-23]. EGFR在多种肿瘤组织的血管内皮细胞中表达, 通过促进VEGF、IL-8、FGF的表达间接促进肿瘤血管生成[24]. EGFR在食管癌细胞中高度表达, 表达及活性的强度与食管癌的恶性程度、耐药性及发展和预后相关[25-27]. 在体外实验中已表明启膈散及其拆方可以不同程度的抑制Eca109细胞EGFR表达[1], 本实验也显示了类似的结果, 不过全方组优于活血组. 进一步说明下调EGFR是启膈散及其拆方治疗肿瘤的重要机制.
磷脂酶Cγ1(phospholipase C-γ1, PLC-γ1)是EGF、VEGF、PDGF等多种细胞生长因子信号传导的细胞内效应分子, 在细胞信号转导中起关键作用[28-29], 其超量表达和激活引起肿瘤发生、浸润和转移[30-32]. 我们以往的研究发现PLC-γ1在食管癌组织中超量表达, 体外实验证明启膈散及其拆方可以抑制Eca109细胞PLC-γ1介导的信号传导[1]; 本次体内实验表明启膈散及其拆方不但可以抑制Eca109细胞裸鼠移植瘤组织中PLC-γ1蛋白表达而抑制肿瘤生长, 而且通过抑制PLC-γ1介导的信号传导起到抑制生长因子引起的肿瘤血管生成作用.
总之, 启膈散及其拆方可以不同程度地抑制Eca109细胞裸鼠移植瘤生长、肿瘤血管生成和VEGF、EGFR、PDGFRβ、PLC-γ1蛋白表达, 其作用以全方组最好, 活血组次之. 血管生成是肿瘤生长的重要条件, VEGF、EGF、PDGF可以促进血管生成, PLC-γ1是这些生长因子信号的细胞内效应分子, 因此, 启膈散及其拆方通过抑制生长因子-PLC-γ1信号传导直接抑制肿瘤细胞的生长, 又可以通过此途径抑制肿瘤血管生成, 间接地抑制肿瘤细胞的增殖和肿瘤生长.
1971年Folkman提出了癌症发育过程中血管形成假说, 从而开创了癌症发生机制和治疗研究的新领域. 30多年来对肿瘤血管形成在肿瘤发生中的作用和抗血管形成药物进行了大量研究, 发现了血管内皮生长因子(VEGF)、成纤维细胞生长因子(BFGF)等多种促血管形成因子, 2004年两种抗血管内皮药物Avastin和 Lucentis在美国上市, 至今抗肿瘤血管形成仍是肿瘤治疗研究的焦点. 启膈散是清代名医程钟龄在他的《医学心悟》中为治疗噎膈病所创制的方剂, 以往研究发现该方具有抑制食管癌细胞和肿瘤生长的作用, 临床上治疗食管癌有肯定疗效.
唐志鹏, 研究员, 上海中医药大学附属龙华医院消化内科
针对肿瘤血管形成的关键分子机制是目前肿瘤药物研发的焦点之一.
PLC-γ1是EGF、PDGF、VEGF、FGF、TGFb等生长因子共同的细胞内效应分子, PLC-γ1介导的信号传导调节细胞增殖和分化, 参与肿瘤血管生成.
本文首次报道了启膈散及其拆方通过抑制生长因子- PLC-γ1信号传导抑制肿瘤血管生成.
本文为启膈散治疗食管癌的临床应用和进一步药物研发提供实验依据.
肿瘤微血管形成: 是瘤细胞获得血管生长能力, 分泌血管生长因子, 诱导毛细血管形成而建立血液循环的过程. 肿瘤血管生成机制及抗血管生成治疗肿瘤研究是当前肿瘤研究的热点.
本文选题较好, 设计合理, 结果可靠, 结论可信, 具有一定的理论指导价值.
编辑: 李军亮 电编: 何基才
| 2. | 司 富春. 启膈散及其拆方抑制人食管癌细胞裸鼠移植瘤作用的机理研究. 中国中医基础医学杂志. 2007;13:451-453. |
| 3. | Kerbel RS. Tumor angiogenesis. N Engl J Med. 2008;358:2039-2049. [PubMed] [DOI] |
| 4. | Marx J. Cancer research. Obstacle for promising cancer therapy. Science. 2002;295:1444. [PubMed] [DOI] |
| 5. | Shojaei F, Ferrara N. Antiangiogenic therapy for cancer: an update. Cancer J. 2007;13:345-348. [PubMed] [DOI] |
| 6. | Ferrara N, Kerbel RS. Angiogenesis as a therapeutic target. Nature. 2005;438:967-974. [PubMed] [DOI] |
| 7. | Rmali KA, Puntis MC, Jiang WG. Tumour-associated angiogenesis in human colorectal cancer. Colorectal Dis. 2007;9:3-14. [PubMed] [DOI] |
| 8. | Du JR, Jiang Y, Zhang YM, Fu H. Vascular endothelial growth factor and microvascular density in esophageal and gastric carcinomas. World J Gastroenterol. 2003;9:1604-1606. [PubMed] |
| 9. | Xu W, Zhang L, Xie Y. [Expression of vascular endothelial growth factor in primary esophageal squamous cell carcinoma and its significance in angiogenesis and prognosis of the tumor]. Zhonghua Yixue Zazhi. 2001;81:860-862. [PubMed] |
| 10. | Singh AJ, Meyer RD, Navruzbekov G, Shelke R, Duan L, Band H, Leeman SE, Rahimi N. A critical role for the E3-ligase activity of c-Cbl in VEGFR-2-mediated PLCgamma1 activation and angiogenesis. Proc Natl Acad Sci USA. 2007;104:5413-5418. [PubMed] [DOI] |
| 11. | Breen EC. VEGF in biological control. J Cell Biochem. 2007;102:1358-1367. [PubMed] [DOI] |
| 12. | Roskoski R Jr. Vascular endothelial growth factor (VEGF) signaling in tumor progression. Crit Rev Oncol Hematol. 2007;62:179-213. [PubMed] [DOI] |
| 13. | Möbius C, Freire J, Becker I, Feith M, Brücher BL, Hennig M, Siewert JR, Stein HJ. VEGF-C expression in squamous cell carcinoma and adenocarcinoma of the esophagus. World J Surg. 2007;31:1768-1772; discussion 1773-1774. [PubMed] [DOI] |
| 14. | Kleespies A, Guba M, Jauch KW, Bruns CJ. Vascular endothelial growth factor in esophageal cancer. J Surg Oncol. 2004;87:95-104. [PubMed] [DOI] |
| 15. | Andrae J, Gallini R, Betsholtz C. Role of platelet-derived growth factors in physiology and medicine. Genes Dev. 2008;22:1276-1312. [PubMed] [DOI] |
| 16. | Yu J, Ustach C, Kim HR. Platelet-derived growth factor signaling and human cancer. J Biochem Mol Biol. 2003;36:49-59. [PubMed] |
| 17. | Betsholtz C. Biology of platelet-derived growth factors in development. Birth Defects Res C Embryo Today. 2003;69:272-285. [PubMed] [DOI] |
| 18. | Alvarez RH, Kantarjian HM, Cortes JE. Biology of platelet-derived growth factor and its involvement in disease. Mayo Clin Proc. 2006;81:1241-1257. [PubMed] |
| 19. | Shih AH, Holland EC. Platelet-derived growth factor (PDGF) and glial tumorigenesis. Cancer Lett. 2006;232:139-147. [PubMed] [DOI] |
| 20. | Liu YC, Chen SC, Chang C, Leu CM, Hu CP. Platelet-derived growth factor is an autocrine stimulator for the growth and survival of human esophageal carcinoma cell lines. Exp Cell Res. 1996;228:206-211. [PubMed] [DOI] |
| 21. | De Luca A, Carotenuto A, Rachiglio A, Gallo M, Maiello MR, Aldinucci D, Pinto A, Normanno N. The role of the EGFR signaling in tumor microenvironment. J Cell Physiol. 2008;214:559-567. [PubMed] [DOI] |
| 22. | Lui VW, Grandis JR. EGFR-mediated cell cycle regulation. Anticancer Res. 2002;22:1-11. [PubMed] |
| 23. | Ciardiello F. Epidermal growth factor receptor inhibitors in cancer treatment. Future Oncol. 2005;1:221-234. [PubMed] [DOI] |
| 24. | Ellis LM. Epidermal growth factor receptor in tumor angiogenesis. Hematol Oncol Clin North Am. 2004;18:1007-1021, viii. [PubMed] [DOI] |
| 25. | Pande AU, Iyer RV, Rani A, Maddipatla S, Yang GY, Nwogu CE, Black JD, Levea CM, Javle MM. Epidermal growth factor receptor-directed therapy in esophageal cancer. Oncology. 2007;73:281-289. [PubMed] [DOI] |
| 26. | Wang KL, Wu TT, Choi IS, Wang H, Reseetkova E, Correa AM, Hofstetter WL, Swisher SG, Ajani JA, Rashid A. Expression of epidermal growth factor receptor in esophageal and esophagogastric junction adenocarcinomas: association with poor outcome. Cancer. 2007;109:658-667. [PubMed] [DOI] |
| 27. | Wilkinson NW, Black JD, Roukhadze E, Driscoll D, Smiley S, Hoshi H, Geradts J, Javle M, Brattain M. Epidermal growth factor receptor expression correlates with histologic grade in resected esophageal adenocarcinoma. J Gastrointest Surg. 2004;8:448-453. [PubMed] [DOI] |
| 28. | Meisenhelder J, Suh PG, Rhee SG, Hunter T. Phospholipase C-gamma is a substrate for the PDGF and EGF receptor protein-tyrosine kinases in vivo and in vitro. Cell. 1989;57:1109-1122. [PubMed] [DOI] |
| 29. | McLaughlin AP, De Vries GW. Role of PLCgamma and Ca(2+) in VEGF- and FGF-induced choroidal endothelial cell proliferation. Am J Physiol Cell Physiol. 2001;281:C1448-C1456. [PubMed] |
| 30. | Wells A, Grandis JR. Phospholipase C-gamma1 in tumor progression. Clin Exp Metastasis. 2003;20:285-290. [PubMed] [DOI] |
| 31. | Choi JH, Ryu SH, Suh PG. On/off-regulation of phospholipase C-gamma 1-mediated signal transduction. Adv Enzyme Regul. 2007;47:104-116. [PubMed] [DOI] |